Resumo nº1 – Conceitos de oxidação e redução
- Conceitos de oxidação e redução
- Espécie oxidada e espécie reduzida
- Oxidante e redutor
- Número de oxidação
- Semirreações de oxidação e de redução
As reações de oxidação-redução são muito importantes. Nelas ocorrem trocas de eletrões entre átomos e entre iões.
Do ponto de vista histórico, durante muito tempo os químicos chamaram às reações em que uma substância se combina com o oxigénio reações de oxidação.
- 4 Fe (s) + 3 O2 (g) → 2 Fe2O3 (s)
- 2 Cu (s) + O2 (g) → 2 Cu0 (s)
Ao processo inverso, isto é, à diminuição do teor em oxigénio de uma substância, os químicos chamaram redução.
Atualmente, associa-se a oxidação e a redução, processos que acontecem simultaneamente, à transferência de eletrões entre as substâncias envolvidas numa reação química.
A definição de oxidação como perda de eletrões também se aplica a outras reações em que não entra oxigénio como na reação de um metal com um não-metal.
A reação do magnésio com o cloro pode ser descrita pela seguinte equação química:
Mg (s) + Cl2 (g) → MgCl2 (s)
Sendo o cloreto de magnésio um composto iónico formado pelos iões Mg2+ e Cl–, podemos considerar as duas semirreações que se seguem:
• semirreação de oxidação: Mg → Mg2+ + 2 e–
• semirreação de redução: Cl2 + 2 e– → 2 Cl-
Durante este processo, o magnésio perdeu eletrões e o dicloro ganhou eletrões.
Por perder eletrões, o magnésio sofre oxidação e, pelo facto de ganhar eletrões, o dicloro sofre redução.
A oxidação do magnésio e a redução do dicloro aconteceram simultaneamente.
A este processo químico simultâneo de transferência de eletrões atribuiu-se a designação de reação de oxidação-redução ou, de forma abreviada, de reação redox.
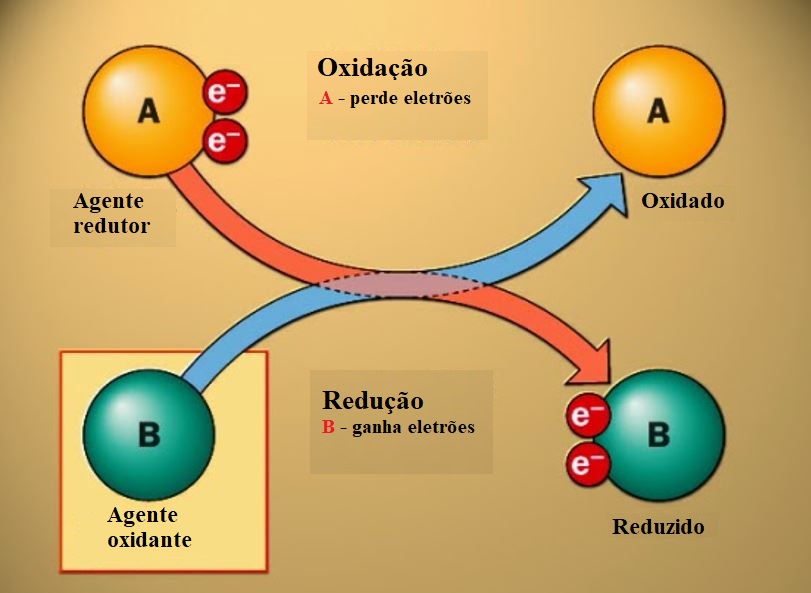
Oxidação – processo que consiste na cedência de eletrões.
Redução – processo que consiste no ganho de eletrões.
Reação de oxidação-redução – reação que acontece por transferência de eletrões entre as espécies reagentes.
Neste exemplo, a oxidação do magnésio foi provocada pelo dicloro.
Por essa razão, a substância dicloro também é designada por agente oxidante (ou, simplesmente, oxidante).
Por outro lado, a redução do dicloro é provocada pelo magnésio.
Por esta razão, o magnésio toma a designação de agente redutor (ou, simplesmente, redutor) .
A espécie que se oxida ⇒ Cede eletrões à outra espécie reduzindo-a ⇒ Espécie redutora
A espécie que se reduz ⇒ Capta eletrões da outra espécie oxidando-a ⇒ Espécie oxidante
Metais como o ferro reagem em contacto com o oxigénio atmosférico:
4 Fe(s) + 3 O2 (g) → 2 Fe2O3 (s)
• O metal transfere eletrões para as moléculas de oxigénio, originando o ião Fe2+;
• O oxigénio recebe eletrões, originando o ião óxido (O2- ) ;
• Forma-se óxido de ferro (Fe2O3) à superfície.
Como o ferro perde eletrões, diz-se que sofre oxidação.
Como o oxigénio ganha eletrões, diz-se que sofre redução.
Quando, num processo químico, ocorre transferência de eletrões …
… a espécie que perdeu e eletrões, diz-se que esta sofreu oxidaçao.
… da espécie que ganhou eletrões, diz-se que esta sofreu redução.
A oxidação e a redução ocorrem em simultâneo, não existindo uma sem a outra.
N.0 de eletrões perdidos pelas espécies oxidadas = N.0 de eletrões ganho pelas espécies que se reduzem
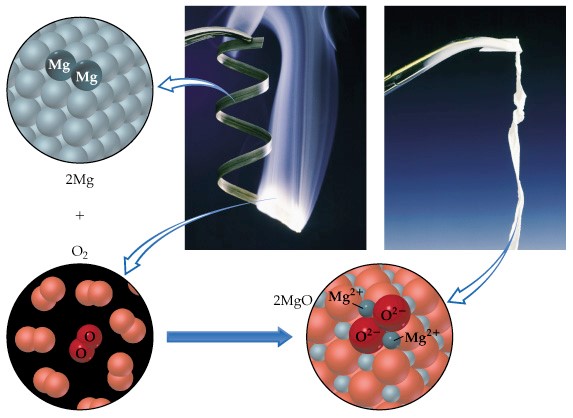
A equação que traduz a combustão do magnésio metálico, Mg (s), é:
2 Mg (s) + O2 (g) → 2 MgO (s)
Esta reação pode ser representada por duas semiequações:
(1) 2 Mg → 2 Mg2+ + 4 e–
(2) O2 + 4 e– → 2 O2-
Na semirreação de oxidação (1), o magnésio cede quatro eletrões e na semirreação de redução (2) o oxigénio capta quatro eletrões.
Na oxidação, o magnésio cedeu eletrões.
Podemos então dizer que a oxidação é um processo em que há perda de eletrões.
Por sua vez, o oxigénio que sofre a redução ganha eletrões, ou seja, a redução é um processo em que há ganho de eletrões.
A oxidação do magnésio e a redução do oxigénio produzem-se simultaneamente.
Uma reação de oxidação-redução é um processo em que ocorrem simultaneamente uma oxidação e uma redução.
- Um outro exemplo de reação de oxidação-redução é o da oxidação de alguns metais pelos ácidos, o que explica um dos impactos das chuvas ácidas.
A reação do ácido sulfúrico com o zinco é um exemplo de reação deste tipo:
H2SO4 (aq) + Zn(s) → ZnSO4 (aq) + H2 (g)
Escrevendo a equação sob a forma iónica, apenas com as espécies oxidante e redutora :
2 H+ (aq) + Zn (s) → Zn 2+ (aq) + H2 (s)
• semirreação de oxidação: Zn (s) → Zn2+ (aq) + 2 e–
• semirreação de redução: 2 H+ (aq) + 2 e– → H2 (g)
- São também exemplos de reações de oxidação-redução as reações entre um metal e um ião de outro metal em solução.
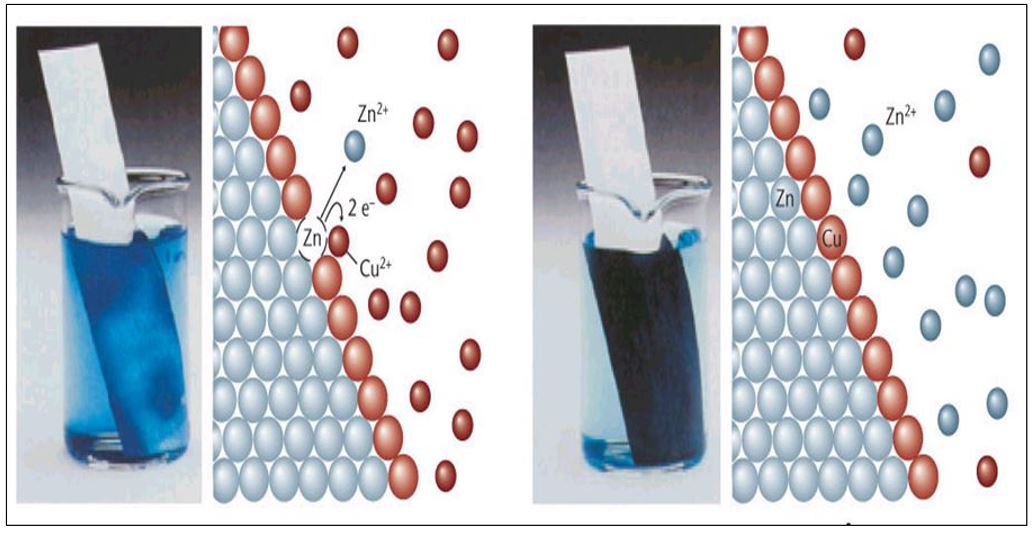
Considere que uma solução de sulfato de cobre (II), CuSO4 (aq), de cor azul característica se introduz-se nessa solução uma placa metálica de zinco, Zn (s).
A reação que ocorre é: Zn (s) + Cu2+ (aq) → Zn 2+ (aq) + Cu (s)
• semirreação de oxidação: Zn (s) → Zn 2+ (aq) + 2 e–
• semirreação de redução: Cu2+ (aq) + 2 e– → Cu (s)
Oxidantes e redutores
Numa reação de oxidação-redução há sempre uma espécie que sofre a oxidação e outra que sofre a redução.
Por isso, a espécie que se oxida chama-se redutor, ou agente redutor.
Uma espécie que se reduz capta eletrões da outra, oxidando-a.
Por essa razão, a espécie que se reduz chama-se oxidante, ou agente oxidante.
Por outras palavras, o oxidante obriga a outra espécie a oxidar-se (logo, reduz-se); o redutor obriga a outra espécie a reduzir-se (logo, oxida-se).
A reação entre o magnésio e o cloro pode ser traduzida pela seguinte equação química:
Mg (s) + Cl2 (g) → MgCl2 (s)
Na forma iónica, esta equação será:
Mg + Cl2 → Mg2+ + 2 Cl–
O magnésio é o redutor porque, ao ceder eletrões ao cloro, vai reduzi-lo.
O cloro é o oxidante porque, ao captar eletrões do magnésio, vai oxidá-lo.