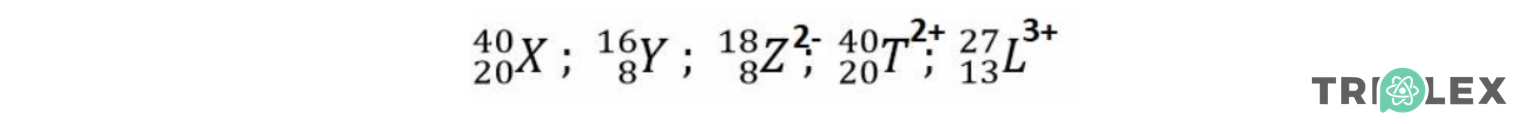Ficha nº2 – Representação simbólica de alguns átomos
Voltar a: 10ºAno – Química
1*. Considera os elementos químicos cujos átomos são representados a seguir (as letras X, Y, R e T não são os verdadeiros símbolos atómicos).
1.1. Indica a constituição dos átomos dos elementos X e Y.
1.2. Identifica o número atómico e o número de massa do átomo do elemento T.
1.3. Qual é o número de protões do átomo do elemento R?
1.4. Seleciona os átomos que são isótopos, fundamentando a sua resposta.
1.1 O átomo X, sendo Z=6, é constituído por seis protões e por seis eletrões (pois o número de eletrões é igual ao número de protões para o átomo ser neutro); sendo A = 12, o número de neutrões é 12 – 6 = 6.
⇒ O átomo Y, o número de protões e eletrões é 18 e o número de neutrões é 22.
1.2 o número atómico, Z, é 12 e o número de massa, A, é 24.
1.3 O elemento R possui 6 protões, pois esse é o valor do seu número atómico.
1.4 Os átomos que são isótopos são X e R, pois são átomos do mesmo elemento, uma vez que possuem o mesmo número atómico, e diferem no número de massa, ou seja, que apresentam número de neutrões diferentes
2. Relativamente a substâncias químicas, seleciona a opção correta.
(A) Uma substância é sempre elementar.
(B) Uma substância pode ser constituída por átomos de diferentes elementos.
(C) Uma substância composta contém sempre Impurezas, em maior ou menor quantidade.
(D) Uma substância é sempre composta.
- Opção (B)
3. Considera a representação simbólica de alguns átomos (as letras não representam símbolos químicos):
Indica:
3.1 quantos elementos químicos estão presentes;
3.2 os átomos que têm o mesmo número de neutrões:
3.3 os isótopos.
3.1 3
3.2 A e B
3.3 A e E ; B e D
4. Indica a afirmação verdadeira.
(A) Os átomos têm diferente número de eletrões e de protões.
(B) Os aniões resultam de átomos que ganharam eletrões.
(C) Os átomos têm igual número de neutrões e de protões.
(D) Os catiões resultam de átomos que ganharam eletrões.
- Opção (B)
5*. O ferro tem quatro isótopos estáveis.
5.1 Indica a constituição dos núcleos de cada um destes átomos.
5.2 Quantos eletrões tem cada um destes átomos?
6*. Preenche os espaços em branco da seguinte tabela:
7*. Completa o quadro sem consultar outra informação.
a) 13 ;
b) 8 ;
c) 16 ;
d) 28 ;
e) 48;
f) 50
8*. O vanádio (símbolo químico V, número atómico Z = 23) tem nove isótopos (naturais e sintéticos), com número de neutrões entre 23 e 31 .
⇒ Representa todos os isótopos deste elemento.
9*. Indica, dos átomos:
9.1 os que são isótopos;
9.2 os que têm o mesmo número de massa;
9.3 os que têm o mesmo número de neutrões.
10*. As afirmações seguintes referem-se à constituição do átomo. Seleciona a opção correta.
(A) As partículas constituintes do núcleo são os protões e os eletrões.
(B) O protão é uma partícula com carga elétrica unitária positiva.
(C) Num átomo, o número de protões é sempre igual ao número de neutrões.
(D) A massa de um protão é, aproximadamente, Igual à massa do eletrão.
- Opção (B)
11*. Somando-se todas as partículas (protões, neutrões e eletrões) do átomo 5928Ni com as do átomo 20180Hg, o total de partículas será:
(A) 281
(B) 158
(C) 368
(D) 108
- Opção (C)
12*. Dois átomos genéricos A e B são isótopos e as suas características constam da tabela seguinte.
Determina o valor da soma do número de neutrões dos átomos A e B.
- 30 neutrões no total
13*. Observa as seguintes representações simbólicas, em que as letras não representam símbolos químicos.
13.1 Quantos elementos químicos diferentes se encontram representados? Justifica a sua resposta.
13.2 Considerando algumas das representações simbólicas indicadas, preenche o quadro seguinte.
13.1 Encontram-se representados três elementos químicos, pois o que caracteriza um elemento é o número atómico Z (índice inferior).
13.2 O número atómico Z é o índice inferior; o número de massa A é o índice superior; o número de neutrões é dado por A – Z; o número de protões é igual ao de eletrões e igual a Z.
Logo:
14*. Embora atualmente sejam conhecidos mais de vinte isótopos de cobre na Terra existem apenas o cobre-63 e um outro isótopo menos abundante 6529Cu.
O cobre pode apresentar-se em compostos iónicos, na forma de catião mono ou di carregado.
14.1 Descreve os dois isótopos de cobre existentes na Terra em termos de protões, neutrões e eletrões.
14.2 Os iões habitualmente formados pelo cobre são:
(A) Cu e Cu2+
(B) Cu e Cu2-
(C) Cu+ e Cu2+
(D) Cu– e Cu2-
14.1
- Cobre-63 : 29 protões, 34 neutrões e 29 eletrões;
- Cobre-65 : 29 protões, 36 neutrões e 29 eletrões
14.2 Opção (C)
15*. Seleciona a afirmação que completa corretamente a seguinte afirmação.
Um elemento químico
(A) é o conjunto de átomos com a mesma massa isotópica relativa.
(B) caracteriza-se por um número de massa [A] e um número atómico [Z].
(C) é o conjunto dos átomos com a mesma carga nuclear.
(D) diferencia-se dos outros pelo número de eletrões dos seus átomos e iões.
- Opção (C)
16*. Seleciona a opção correta.
(A) O eletrão é uma partícula de carga elétrica unitária positiva.
(B) Num átomo, o número de protões é igual ao número de neutrões.
(C) O núcleo é a região com menor massa do átomo.
(D) O átomo apresenta, predominantemente, espaços vazios.
- Opção (D)
17*. Um elemento tem número de massa (3X + 6), em que X é o seu número atómico. O número de neutrões desse elemento será dado por:
(A) 2X + 2
(B) 2X + 3
(C) 2X + 6
(D) X + 6
- Opção (C)
18*. Existem três isótopos de potássio estáveis, representados por:
18.1 Em relação a 4019K podemos afirmar que:
(A) o número de eletrões é 19.
(B) o número de neutrões é 19.
(C) o número de protões é 21.
(D) o número de neutrões é 39.
18.2 Um dos isótopos instáveis de potássio tem 31 neutrões. Representa-o pela notação AZX.
18.1 Opção (A)
18.2 5019K
19*. O néon tem três isótopos. As abundâncias relativas dos isótopos 2010Ne e 2110Ne são, respetivamente, 90,51 % e 0,27%.
19.1 Justifica por que razão os átomos de néon referidos são isótopos.
19.2 Indica a abundância relativa do terceiro isótopo, 2210Ne.
19.3 Assumindo que o número de massa é numericamente igual à massa do isótopo, calcule a massa atómica relativa do elemento néon.
19.1 porque têm o mesmo número atómico (10) mas números de massa diferentes, e portanto número de neutrões diferente.
19.2 2210Ne = 9,22 %
19.3 Ar ( Ne ) = 20,19
20*. Relativamente às espécies seguintes, seleciona a[s] afirmação[ões] correta[s].
A. A espécie T2+ tem vinte e dois protões.
B. A espécie X tem 20 neutrões.
C. A espécie L3+ tem 27 protões.
D. A espécie Z tem o mesmo número de neutrões de Y.
E. As espécies X e T2+ têm igual número de protões e eletrões.
F. A espécie L3+ tem 10 eletrões.
G. A espécie Y tem o dobro de neutrões relativamente aos seus protões.
A. Falsa
B. Verdadeira
C. Falsa
D. Falsa
E. Falsa
F. Verdadeira
G. Falsa
21*. Um átomo W tem 9 protões, 9 eletrões e 10 neutrões. Outro átomo Z tem 10 protões, 10 eletrões e 9 neutrões.
Pode concluir-se que:
(A) Os átomos W e Z são isótopos.
(B) O átomo W tem maior massa que o átomo Z.
(C) Os átomos W e Z têm o mesmo número de massa.
(D) Os átomos W e Z têm o mesmo número atómico.
- Opção (C)