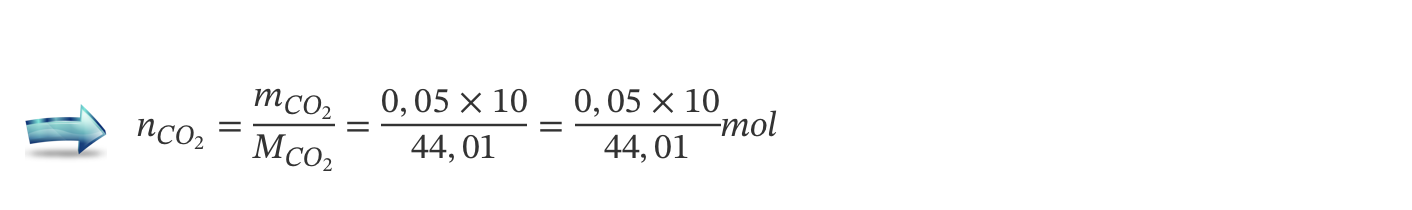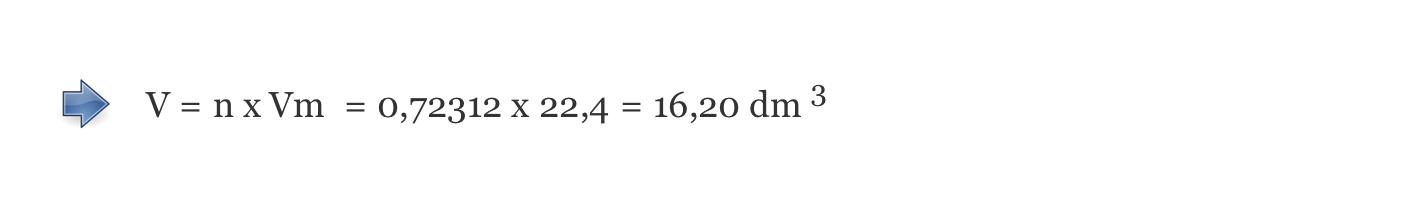Ficha nº5 : Exames e TI (2014 – 2017)
Voltar a: 10ºAno – Química
Ficha nº5
Exercícios de exames e testes intermédios (2014 – 2017)
10ºano – Química – Domínio 2 – Subdomínio 2 (Gases e dispersões)
1. (2014 – 1ªF) A reação de síntese do amoníaco pode ser traduzida por
N2 (g) + 3 H2 (g) ⇋ 2 NH3 (g) ΔH = -92 kJ mol-1
Considere que se introduziu, num reator com a capacidade de 1,00L, uma mistura de nitrogénio, hidrogénio e amoníaco, em fase gasosa, em diferentes concentrações.
O gráfico da Figura 4 representa a evolução, ao longo do tempo, t, das concentrações, c, dessas substâncias, à temperatura T.
A fração molar de NH3, na mistura gasosa inicialmente introduzida no reator, é
(A) 7,1 × 10-2
(B) 6,7 × 10-2
(C) 3,6 × 10-1
(D) 2,1 × 10-1
- Opção (B)
⇒ Determinar a quantidade de cada constituinte do sistema na mistura gasosa inicialmente introduzida no reator
n(NH3) = [NH3] x V = 0,050 x 1,0 = 0,050 mol
n(N2) = [N2] x V = 0,500 x 1,0 = 0,500 mol
n(H2) = [H2] x V = 0,200 x 1,0 = 0,200 mol
⇒ Calcular a fração molar de NH3 na mistura gasosa inicial
- Opção (B) …………. 5 pontos
2. (2014 – 2ªF) As soluções aquosas de ácido acético a partir das quais se obtém uma curva de calibração são preparadas a partir de uma solução inicial de concentração 4,50 mol dm-3.
Qual é o fator de diluição a considerar na preparação da solução de ácido acético de concentração 0,50 mol dm-3?
(A) 9
(B) 5
(C) 4
(D) 2
- Opção (A)
- Fator de diluição = csolução concentrada/csolução diluída ⟺ Fator de diluição = 4,50/0,50 ⟺ Fator de diluição = 9
- Opção (A) …………. 5 pontos
3. (2014 – 2ªF) A densidade de uma solução de ácido acético de concentração 0,50 mol dm-3 é 1,0025 × 103 g dm-3, a 20 ºC.
Qual das expressões seguintes permite calcular a quantidade de ácido acético que existe em 100 g da solução?
- Opção (A) …………. 5 pontos
4. (2014 – 2ªF) Quantos átomos de hidrogénio existem em 5,0 moles de moléculas de ácido acético, CH3COOH?
(A) 2,4 ×1025
(B) 3,0 ×1024
(C) 2,4 ×1024
(D) 1,2 ×1025
- Opção (D)
⇒ Analisando a fórmula química do ácido acético, verifica-se que cada molécula é constituída por 8 átomos (4 átomos de hidrogénio, 2 átomos de carbono e 2 átomos de oxigénio), permitindo concluir que o número de átomos de hidrogénio é 4 vezes superior ao número de moléculas.
⇒ Calcular o número de moléculas, N, de ácido acético existente em 5 moles, n, de moléculas de CH3COOH
- N(CH3COOH) = n(CH3COOH) × NA ⇔ N(CH3COOH) = 5 × 6,02×1023 ⇔ N(CH3COOH) = 3,01×1024 moléculas
⇒ Calcular o número de átomos de hidrogénio, N, existente em 3,01×1024 moléculas de CH3COOH
- N(H) = 4 × N(CH3COOH) ⇔ N(H) = 3,01×1024 × 4 ⇔ N(H) = 1,2×1025 átomos.
- Opção (D) …………. 5 pontos
5. (2014 – EE) Numa terceira fase, o hidróxido de magnésio sólido, entretanto separado, reage com ácido clorídrico, formando cloreto de magnésio, MgCl2.
A reação que ocorre é traduzida por
Mg(OH)2(s) + 2 HCl(aq) → MgCl2(aq) + 2 H2O(l)
Considere que se utiliza uma solução de ácido clorídrico, de densidade 1,15 gcm-3, que contém 30%, em massa, de HCl.
Qual das expressões seguintes permite calcular a massa de HCl que existe em 500cm3 da solução?
- Opção (A) …………. 5 pontos
6. (2014 – EE) Numa atividade laboratorial, um grupo de alunos preparou, com rigor, 100,00 cm3 de uma solução aquosa de sulfato de cobre (II), CuSO4, de concentração 0,400 mol dm-3, por dissolução de sulfato de cobre (II) penta-hidratado, CuSO4 • 5H2O, sólido.
6.1. Calcule a massa de sulfato de cobre penta-hidratado que foi necessário medir, para preparar essa solução.
Apresente todas as etapas de resolução.
- V (CuSO4 (aq)) = 100,00 cm3
- c (CuSO4 (aq)) = 0,400 mol dm-3
- m (CuSO4.5 H2O (s)) = ?
- M (CuSO4.5 H2O (s)) = 249,52 g mol-1
⇒ Cálculo da quantidade 1 mol de sulfato de cobre II existente em 100,00 cm3 de solução:
- c = n/V ⇔ n = c x V = 0,100 dm3 x 0,400 mol dm-3 = 4,00 x 10-2 mol
⇒ A quantidade (mol) de sulfato de cobre (II) existente em 100,00 cm3 de solução é igual à quantidade (mol) de sulfato de cobre (II) penta-hidratado necessário para preparar a solução.
⇒ Cálculo da massa de sulfato de cobre (II) penta-hidratado, CuSO4.5 H2O (s), necessária:
- n = m/M ⇔ m = n x M = 4,00 x 10-2 mol x 249,52 g mol-1 = 9,99 g
- Etapas de resolução:
A) Cálculo da quantidade de sulfato de cobre penta-hidratado necessária (n = 4,000 × 10-2 mol) …….. 5 pontos
B) Cálculo da massa de sulfato de cobre penta-hidratado necessária (m = 9,99 g) …….. 5 pontos
Nota – A apresentação de valores calculados com arredondamentos incorretos, ou com um número incorreto de algarismos significativos, não implica, por si só, qualquer desvalorização.
6.2. De modo a pesar o sulfato de cobre penta-hidratado necessário para preparar a solução, os alunos colocaram um gobelet sobre o prato de uma balança.
Identifique a peça de material de laboratório que deve ser utilizada para transferir o sulfato de cobre penta-hidratado sólido para o goble.
- Espátula ou colher.
- Espátula …………………. 5 pontos
6.3. Ao prepararem a solução, os alunos deixaram o menisco do líquido ultrapassar o traço de referência do balão volumétrico.
Qual é a atitude correta a tomar numa situação como essa?
(A) Ignorar o facto, uma vez que o colo do balão é estreito.
(B) Adicionar um pouco mais de soluto à solução preparada.
(C) Acertar o menisco pelo traço de referência, retirando líquido.
(D) Preparar uma nova solução, a partir do soluto sólido.
- Opção (D)
⇒ Independentemente da largura do colo do balão, iria conduzir a erro na concentração desejada, pois o volume era superior e era desconhecido.
⇒ Adicionar soluto conduziria a uma alteração da concentração da solução.
⇒ Retirar soluçãoacertaria o volume, mas perder-se-ia soluto existente na parte retirada.
⇒ Não há hipótese de remediar o mal; deve preparar-se nova solução.
- Opção (D) …………. 5 pontos
6.4. Os alunos prepararam, com rigor, a partir da solução de sulfato de cobre (II) inicialmente preparada, uma solução 2,5 vezes mais diluída.
Os alunos dispunham apenas do seguinte material:
• Balão volumétrico de 50 mL (± 0,06 mL)
• Pompete
• Pipeta graduada de 10 mL (± 0,05 mL)
• Pipeta volumétrica de 10 mL (± 0,02 mL)
• Pipeta graduada de 20 mL (± 0,10 mL)
• Pipeta volumétrica de 20 mL (± 0,03 mL)
• Pipeta graduada de 25 mL (± 0,10 mL)
• Pipeta volumétrica de 25 mL (± 0,03 mL)
Determine o volume da solução mais concentrada que os alunos tiveram de medir, de modo a prepararem a solução pretendida.
Selecione, de entre as pipetas referidas, a que permite a medição mais rigorosa do volume da solução mais concentrada.
Apresente todas as etapas de resolução.
- Fator de diluição: f = 2,5
- cinicial (CuSO4 (aq)) = 0,400 mol dm-3
⇒ Para obter uma solução 2,5 vezes mais diluída, ou seja, com fator de diluição igual a 2,5, o volume (V mL) de solução deve ser diluído a 2,5 V mL.
⇒ Normalmente, pipeta-se um dado volume de solução concentrada para um balão volumétrico, acrescentando água até ao traço de referência.
⇒ Das pipetas disponíveis deveríamos utilizar uma pipeta volumétrica (maior precisão).
⇒ Como dispomos de um balão volumétrico de 50 mL ± 0,06 mL), o volume da solução diluída a preparar vai ser de 50,00 mL.
⇒ O volume da solução concentrada será 2,5 vezes menor, ou seja: f = Vdiluído/Vconcentrado, o volume de solução concentrada é:
- Vconcentrado = Vdiluído/f = 50,00 mL/2,5 = 20,00 cm3.
⇒ Usaríamos a pipeta volumétrica de 20 mL (± 0,03 mL) para transferir a solução concentrada para o balão volumétrico, completando o volume a 50 mL ± 0,06 mL com água destilada.
- Etapas de resolução:
A) Cálculo do volume da solução mais concentrada que foi necessário medir (V = 20,00 cm3) …….. 5 pontos
B) Indicação da pipeta que permite a medição mais rigorosa do volume da solução mais concentrada (pipeta volumétrica de 20 mL) …….. 5 pontos
Nota – A apresentação de valores calculados com arredondamentos incorretos, ou com um número incorreto de algarismos significativos, não implica, por si só, qualquer desvalorização.
7. (2015 – 1ªF) Considere uma mistura gasosa constituída por 5,00 x 10-2 mol de F2(g) e 8,00 x 10-2 mol de Cl2(g), nas condições normais de pressão e de temperatura.
7.1. Quantos átomos de flúor existem na mistura gasosa?
Uma molécula de flúor, F2, tem 2 átomos.
O número de moléculas :
- N = n × NA
O número total de átomos é
- 2N = 2 × n × NA = 2 × 5,00 × 10–2 mol × 6,02 × 1023 mol–1 = 6,02 × 1022 átomos F
- 6,02 × 1022 átomos (ou equivalente) ………….. 5 pontos
Notas:
– A omissão da palavra «átomos» não implica, por si só, qualquer desvalorização.
– A apresentação do valor solicitado com um número incorreto de algarismos significativos não implica qualquer desvalorização.
7.2. Determine a densidade da mistura gasosa, nas condições de pressão e de temperatura referidas.
Apresente todas as etapas de resolução.
Massa molares do F2 e do Cl2:
- M(F2) = 19,0 x 2 = 38,0 g/mol
- M(Cl2) = 35,45 x 2 = 70,9 g/mol
⇒ Massa total:
- m = m(F2) + m(Cl2) = 5,00 x 10-2 x 38 + 8,00 x 10-2 x 70,9 = 7,572 g
⇒ Volume dos gases:
- V = V(F2) + V(Cl2) = n x Vm = (5,00 x 10-2 x 38 + 8,00 x 10-2 ) x 22,4 = 2,912 dm3
⇒ Cálculo da massa volúmica:
- ρ = m/V = 7,572 /2,912 = 2,60 g/dm3
- Etapas de resolução:
A) Cálculo da massa da mistura gasosa (m = 7,572 g) …….. 4 pontos
B)Cálculo do volume da mistura gasosa, nas condições de pressão e de temperatura consideradas (V = 2,912 dm3) …….. 3 pontos
C) Cálculo da densidade da mistura gasosa, nas condições de pressão e de temperatura consideradas ( ρ = 2,60 g dm-3 ) …….. 3 pontos
OU
A)Cálculo da densidade do F2 (g), nas condições de pressão e de temperatura consideradas (ρ = 1,696 g dm-3 ) ……..3 pontos
B) Cálculo da densidade do Cl2 (g), nas condições de pressão e de temperatura consideradas (ρ = 3,165 g dm-3 ) ……..3 pontos
C) Cálculo da densidade da mistura gasosa, nas condições de pressão e de temperatura consideradas, a partir da média ponderada das densidades dos gases constituintes da mistura ( ρ = 2,60 g dm-3) ……..4 pontos
8. (2015 – 2ªF) O metano (CH4), o óxido nitroso (N2O) e o dióxido de carbono (CO2) são gases à temperatura ambiente e à pressão normal.
8.1. O teor médio de CH4(g) na troposfera é 1,7 partes por milhão em volume.
Este teor, em percentagem em volume, é
(A) 1,7 x 10-2 %
(B) 1,7 x 10-4 %
(C) 1,7 x 10-6 %
(D) 1,7 x 10-8 %
- Opção (B) …………. 5 pontos
8.2. Considere uma amostra pura de CH4(g) e uma amostra pura de N2O(g), com volumes iguais, nas mesmas condições de pressão e de temperatura.
Quantas vezes é que a amostra de N2O é mais pesada do que a amostra de CH4?
Apresente o resultado arredondado às unidades.
M(CH4) = 1 x 12,01 + 4 x 1,01 = 16,05 g mol-1
M(N2O) = 2 x 14,01 + 1 x 16,00 = 44,02 g mol-1
⇒ Tendo as amostras volumes iguais e estando nas mesmas condições de pressão e temperatura, pode concluir-se que as amostras contêm igual número de moléculas e igual quantidade de matéria.
⇒ A razão entre as massas:
- 3 [vezes] ………….. 5 pontos
8.3. Calcule o número total de átomos que existem em 50,0 dm3 de CO2 (g), nas condições normais de pressão e de temperatura (PTN).
Apresente todas as etapas de resolução.
⇒ Cálculo da quantidade de CO2:
- n CO2 = V/Vm = 50,0 / 22,4 = 2,232 mol
⇒ Cada molécula de CO2 contém 3 átomos, 2 átomos de oxigénio e 1 de carbono.
⇒ Como N = n × NA, o número total de átomos é:
- N = 3 n × NA = 3 × 2,232 mol × 6,02 x 1023 mol–1 = 4,03 × 1024
- Etapas de resolução:
A) Determinação da quantidade de CO2 que existe no volume considerado, nas condições normais de pressão e de temperatura (n = 2,232 mol) …….. 4 pontos
B) Determinação da quantidade total de átomos existentes (n = 6,696 mol)
OU
- Determinação do número de moléculas de CO2 existentes (N = 1,344 × 1024) …….. 3 pontos
C) Determinação do número total de átomos que existem no volume considerado, nas condições normais de pressão e de temperatura (N = 4,03 × 1024) …….. 3 pontos
9. (2015 – EE) O ozono, O3, é um gás que, na troposfera, é um poluente, mas que, na estratosfera, é essencial para a vida na Terra.
A diminuição da concentração deste gás na estratosfera está, em parte, relacionada com a ação indesejável dos clorofluorocarbonetos (CFC).
O valor estabelecido pela União Europeia como teor máximo de ozono na troposfera, à pressão de 1 atm e à temperatura de 20 ºC, é 1,20 x 10-4 gm-3.
Qual das expressões seguintes permite calcular a quantidade máxima de ozono que poderá existir em 50 dm3 de ar, de acordo com o valor estabelecido pela União Europeia?
- Opção (D)…………. 5 pontos
10. (2016 – 1ªF) Num reator com a capacidade de 10,00 L, foi introduzida, à temperatura de 700 °C, uma mistura gasosa inicialmente constituída por 0,300 mol de CO (g) e por 0,300 mol de H2O (g).
10.1. Qual é a quantidade total de átomos existente na mistura gasosa?
(A) 1,50 mol
(B) 1,20 mol
(C) 0,900 mol
(D) 0,600 mol
- Opção (A)
⇒ A quantidade de átomos em 0,300 mol de CO é 2 x 0,300 mol, uma vez que cada molécula de CO tem 2 átomos.
⇒ A quantidade de átomos em 0,300 mol de H2O é 3 x 0,300 mol, uma vez que cada molécula de H2O tem 3 átomos.
- Assim, a quantidade total de átomos na mistura é (2 x 0,300 mol + 3 x 0,300 mol) = 1,50 mol.
- Opção (A) ……………. 5 pontos
10.2. Calcule a densidade da mistura gasosa no reator.
Apresente todas as etapas de resolução.
- Etapas de resolução:
A) Cálculo da massa de CO na mistura gasosa inicial (m = 8,403 g)
ou
- Cálculo da massa de H2O na mistura gasosa inicial (m = 5,406 g) …….. 2 pontos
B) Cálculo da massa da mistura gasosa (m = 13,809 g) …….. 4 pontos
C) Cálculo da densidade da mistura gasosa no reator (ρ = 1,38 g dm-3) …….. 4 pontos
ou
A) Cálculo do volume molar de um gás, nas condições de pressão e de temperatura que se verificam no interior do reator (Vm = 16,67 dm3 mol-1) …….. 4 pontos
B) Cálculo da densidade do monóxido de carbono, CO (g), nas condições de pressão e de temperatura que se verificam no interior do reator (ρ = 1,680 g dm-3)
ou
- Cálculo da densidade do vapor de água, H2O (g), nas condições de pressão e de temperatura que se verificam no interior do reator (ρ = 1,081 g dm-3) …….. 2 pontos
C) Cálculo da densidade da mistura gasosa no reator (ρ = 1,38 g dm-3) …….. 4 pontos
11. (2016 – 2ªF) Um dos procedimentos mais comuns em laboratório é a preparação de soluções aquosas por diluição de soluções mais concentradas, de concentração conhecida, habitualmente designadas por soluções-mãe.
Na preparação rigorosa de uma solução por diluição, é necessário medir com rigor um determinado volume da solução mais concentrada, transferir esse volume de solução para um balão volumétrico (de capacidade igual ao volume de solução pretendido) e completar o volume de solução pretendido com água até ao traço de referência do balão. Durante a preparação da solução, esta deve ser agitada.
Em laboratório, é também possível determinar a densidade (massa volúmica) de soluções utilizando diferentes métodos, um dos quais é a picnometria de líquidos. Este método baseia-se na determinação da massa de solução contida num picnómetro cuja capacidade foi previamente calibrada, a uma mesma temperatura.
11.1. Para «medir com rigor um determinado volume da solução mais concentrada» (terceira e quarta linhas do texto), utiliza-se
(A) uma proveta.
(B) uma pipeta.
(C) um gobelé.
(D) um balão volumétrico.
- Opção (B)
⇒ A proveta e o gobelé não têm precisão suficiente para medições rigorosas de volume de líquidos.
⇒ Um balão volumétrico não se pode utilizar para transferir um volume fixo de líquido pois a precisão (tolerância) de um balão volumétrico reporta-se ao volume contido (“in”) e não ao volume saído (“out”) como nas pipetas e nas buretas.
- Opção (C) ……………. 5 pontos
11.2. Se pretendesse preparar 250,0 cm3 de uma solução cinco vezes mais diluída do que a solução-mãe, que volume da solução-mãe teria de medir?
(A) 5,0 cm3
(B) 10,0 cm3
(C) 50,0 cm3
(D) 200,0 cm3
- Opção (C)
⇒ Se se pretende preparar uma solução cinco vezes mais diluída do que a solução-mãe, ou seja, com um fator de diluição, f, igual a 5, o volume de solução concentrada a usar deve ser cinco vezes menor, pois
- f = cinicial/cfinal = Vfinal/Vinicial
⇒ Como se pretende 250,0 cm3 de solução diluída, ter-se-ia de medir 250,0/5 = 50,00 cm3 de solução-mãe.
- Opção (C) ……………. 5 pontos
11.3. Considere uma solução-mãe de cloreto de potássio, KCl(aq), que contém 2,35 x 10-3 mol de KCl por cada 1,00 g de solução.
A massa volúmica desta solução foi determinada por picnometria, tendo sido obtidos, a uma mesma temperatura, os dados apresentados na tabela seguinte.
Admita que quer preparar, por diluição dessa solução-mãe, uma solução de KCl de concentração 0,27 mol dm-3.
Calcule o fator de diluição a considerar na preparação da solução diluída de KCl.
Apresente todas as etapas de resolução.
Massa de solução-mãe contida no picnómetro:
- m = 1145,09 – 31,552 g = 113,54 g
Como esta solução-mãe de cloreto de potássio contém 2,35 x 10-3 mol de KCl por 1,00 g de solução, a quantidade de KCl existente nesta solução é:
- n = 113,54 g x 2,35 x 10-3 mol g-1 = 2,668 x 10-1 mol
Concentração da solução-mãe de KCl:
- [KCl]0 = n/V = 2,668 x 10-1/ 98,73 x 10-3 = 2,702 mol dm-3
Para obter uma solução de concentração 0,27 mol dm-3 teria de diluir a solução 10 vezes
- fator de diluição = cinicial/cfinal = Vfinal/Vinicial = 2,702 /0,27 = 10
- Etapas de resolução:
A) Cálculo da massa de solução-mãe de KCl contida no picnómetro (m = 113,54 g) (ver nota) …….. 2 pontos
B) Cálculo do volume de 1,00 g da solução-mãe (V = 0,8696 cm3)
OU
- Cálculo da massa de 1,00 cm3 da solução-mãe (m = 1,150 g)
OU
- Cálculo da quantidade de KCl existente em 113,54 g da solução-mãe (n = 0,2668 mol) …….. 5 pontos
C) Cálculo da concentração da solução-mãe de KCl (c = 2,702 mol dm-3) …….. 5 pontos
D) Cálculo do fator de diluição (10) …….. 3 pontos
Nota – O arredondamento do valor da massa de solução-mãe de KCl contida no picnómetro implica a pontuação desta etapa com zero pontos.
12. (2016 – 2ªF) O cloreto de potássio é constituído pelos iões K+ e Cl–.
A amostra considerada contém 2,68 mol de KCl. Quantos iões existem, no total, na amostra?
Apresente o resultado com três algarismos significativos.
KCl → K+ + Cl–
n (KCl) = 2,68 mol; n (iões) = 2 x 2,68 = 5,36 mol de iões
⇒ Como N = n x NA, o número de iões existentes, no total, na amostra será:
- N (iões) = 5,36 mol x 6,02 x 1023 iões mol-1 = 3,23 x 1024 iões
ou
⇒ Dado que cada “agregado” KCl é formado por dois iões, o número total de iões existentes em 2,68 mol de KCl será:
- (1 mol de KCl) / (2×6,02×1023 iões) = (2,68 mol de iões KCl)/(𝑁 (iões))
- N (iões) = 3,227 × 1024 iões
Assim, o resultado com três algarismos significativos será 3,23 × 1024 iões.
Outro processo:
- Determinar o número de entidades KCl.
N(KCl) = n(KCl) × NA ⇔ N(KCl) = 2,68 × 6,02 × 1023 ⇔ N(KCl) =1,613 × 1024
⇒ Determinar o número de iões em 1,613 × 1024 entidades KCl.
- N(iões) = N(KCl) × 2 ⇔ N(iões) = 1,613 × 1024 ×2 ⇔ N(iões) = 3,227 × 1024
⇒ O resultado com três algarismos significativos será 3,23 × 1024 iões.
- 3,23 x 1024 [iões] …….. 5 pontos
13. (2016 – EE) Ao nível do mar, o ar seco é uma mistura gasosa constituída por cerca de:
• 78%, em volume, de nitrogénio, N2(g);
• 21%, em volume, de oxigénio, O2(g);
• 1%, em volume, de outros gases.
Considere uma amostra de ar seco, recolhida ao nível do mar, de volume 5,0 dm3, medido nas condições normais de pressão e de temperatura.
Calcule a massa de O2(g) que deverá existir nessa amostra.
Apresente todas as etapas de resolução.
- Etapas de resolução:
A) Cálculo do volume, nas condições PTN, ocupado pela quantidade de oxigénio existente na amostra (V = 1,05 dm3) …….. 4 pontos
B) Cálculo da quantidade de oxigénio existente na amostra (n = 4,69 x 10-2 mol) …….. 3 pontos
C) Cálculo da massa de oxigénio existente na amostra (m = 1,5 g) …….. 3 pontos
14. (2017 – 1ªF) O ar seco é uma mistura gasosa constituída essencialmente por nitrogénio, N2 (g), e por oxigénio, O2 (g), na qual existem ainda componentes minoritários como o árgon, Ar (g), e o dióxido de carbono, CO2 (g).
Considere que o teor de CO2 (g) no ar seco é, aproximadamente, 0,05 % (m/m).
14.1. O teor de CO2 (g) no ar seco, em ppm, é, aproximadamente,
(A) 5 x 106 ppm
(B) 5 x 104 ppm
(C) 5 x 102 ppm
(D) 5 ppm
- Opção (C) ……………. 5 pontos
14.2. Qual das expressões seguintes permite calcular a quantidade de CO2 que existirá numa amostra de 1 kg de ar seco?
- Opção (A) ……………. 5 pontos
15. (2017 – 1ªF) Considere que em 100 g de ar seco existem 23,14 g de O2 (g) e que, nas condições normais de pressão e de temperatura (PTN), a massa volúmica do ar seco é 1,30 g dm-3.
Determine a percentagem em volume de O2 ( g ) no ar seco.
Apresente todas as etapas de resolução.
- Etapas de resolução:
A) Cálculo do volume ocupado por 23,14 g de O2 , nas condições normais de pressão e de temperatura (V = 16,20 dm3) …….. 4 pontos
B) Cálculo do volume ocupado por 100 g de ar seco, nas condições normais depressão e de temperatura (V = 76,92 dm3) …….. 4 pontos
C) Cálculo da percentagem em volume de O2 ( g ) no ar seco (21,1 % (V/V )) …….. 2 pontos
ou
A) Cálculo da massa de O2 ( g ) em 1 dm3 de ar seco, nas condições normais de pressão e de temperatura (m = 0,3008 g) …….. 4 pontos
B) Cálculo do volume ocupado por 0,3008 g de O2 ( g ), nas condições normais de pressão e de temperatura (V = 0,2106 dm3) …….. 4 pontos
C) Cálculo da percentagem em volume de O2 ( g ) no ar seco (21,1 % (V/V )) …….. 2 pontos
ou
A) Cálculo do volume ocupado por 100 g de ar seco, nas condições normais depressão e de temperatura (V = 76,92 dm3) …….. 4 pontos
B) Cálculo da quantidade de matéria em 76,92 dm3 (100 g) de ar seco (n = 3,434 mol) e da quantidade de O2 ( g ) na mesma massa de ar seco (n = 0,7231 mol) …….. 4 pontos
C) Cálculo da percentagem em quantidade de O2 (g) no ar seco (21,1 %) e identificação dessa percentagem com a percentagem em volume. …….. 2 pontos
ou
A) Cálculo da massa de um determinado volume de ar seco, nas condições normais de pressão e de temperatura …….. 4 pontos
B) Cálculo do volume de O2 (g) na mesma massa de ar seco …….. 4 pontos
C) Cálculo da percentagem em volume de O2 (g) no ar seco (21,1 % (V/V )) …….. 2 pontos