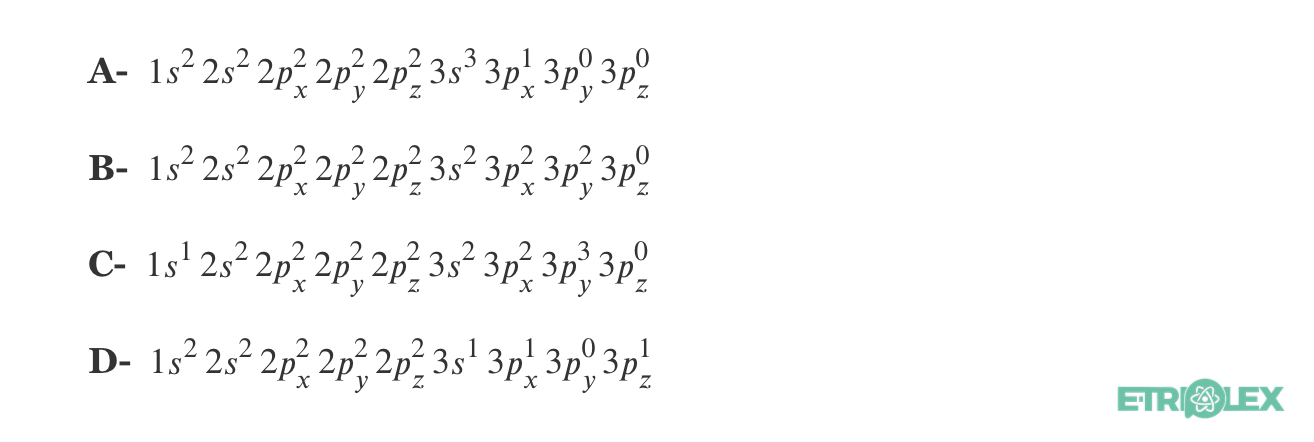Ficha nº9 – Configuração eletrónica de átomos
Voltar a: 10ºAno – Química
1. Considera o elemento químico magnésio, 12Mg, atendendo ao princípio de exclusão de Pauli, explica porque se pode concluir que as orbitais p são degeneradas.
⇒ Segundo o principio de exclusão Pauli, em cada orbital só cabe um máximo de 2 eletrões, pelo que para O referido elemento os seus 12 eletrões encontram-se distribuídos por 6 orbitais.
⇒ No entanto, são apenas 4 os valores de energia de remoção, o que significa que existem orbitais com igual energia.
⇒ Como o pico correspondente às orbitais p mostra que estas comportam seis eletrões, conclui-se que são estas as orbitais degeneradas.
2. O átomo de hidrogénio no estado fundamental apresenta um eletrão na orbital 1s.
Na notação 1s, o número está relacionado com:
(A) a simetria da orbital.
(B) o número de eletrões na orbital.
(C) a energia da orbital.
(D) a orientação espacial da orbital.
- Opção (C)
3. As seguintes configurações eletrónicas referentes a átomos que se encontram no estado fundamental não estão corretas.
3.1 Indica o número atómico de cada elemento químico e por que razão estão erradas.
3.2 Uma das configurações apresentadas poderia ser considerada correta para um átomo num estado excitado. Qual?
3.1
A – Z = 14 – Não obedece ao Principio de exclusão de Pauli.
B – Z = 16 – Não obedece a regra de Hund.
C – Z = 16 – Não obedece a regra de Hund, e ao principio de energia mínimo.
D – Z = 13 – Não obedece ao principio de energia mínimo.
3.2 A configuração D
⇒ Porque não obedece ao princípio da energia mínima – um dos eletrões 3s poderia ter transitado para uma orbital 3p através de absorção de energia, ficando assim num estado excitado.
4. Num átomo constituído por 17 protões deste elemento no estado fundamental existem …
(A) cinco eletrões de valência distribuídos por três orbitais.
(B) cinco eletrões de valência distribuídos por duas orbitais.
(C) sete eletrões de valência distribuídos por duas orbitais.
(D) sete eletrões de valência distribuídos por quatro orbitais.
- Opção (D)
5. A notação:
representa uma orbital:
(A) com quatro lóbulos do nível 3.
(B) de forma esférica do nível 3.
(C) de forma esférica do nível x.
(D) com dois lóbulos do nível 3.
- Opção (D)
6. A figura seguinte mostra o espetro fotoeletrónico de um determinado elemento químico.
6.1 Rotula cada pico no espetro de modo a mostrar que orbital representa.
6.2 A que elemento poderia corresponder o espetro fotoeletrónico?
6.1
⇒ Começando pelo pico 110 MJ/mol ( 1s ; 2s; 2p; 3s) respetivamente.
6.2 A análise do espectro fotoeletrónico permite concluir que os eletrões do átomo se distribuem por 3 níveis de energia, com o segundo nível desdobrado em 2 subníveis.
⇒ Além disso, como a altura do último pico é metade da orbita 1s, a orbital de valência comportará 1 eletrão. A distribuição eletrónica será então: 1s2 2s2 2p6 3s1, pelo que se refere ao átomo de sódio.
7. Escreve as configurações electrónicas das seguintes espécies químicas:
- átomo de sódio, 11Na; ião sódio,11Na+;
- átomo de flúor, 9F; ião flúor, 9F–.
- 11Na: 1s2 2s2 2p6 3s1
⇒ O ião Na+ perde um eletrão e a orbital 3s fica vazia, logo 11Na+: 1s2 2s2 2p6
- 9F: 1s2 2s2 2p5
⇒ O ião F– ganha um eletrão e a orbital 3p fica completa, logo 9F–: 1s2 2s2 2p6
8. Para cada um dos seguintes átomos:
3Li ; 8O ; 12Mg ; 20Ca ; 6C ; 9F ; 15P ; 16S ; 18Ar
8.1 Escreve a configuração eletrónica dos seguintes átomos no estado fundamental
8.2 Indica o número de eletrões de valência
9. Seleciona a opção que apresenta uma configuração eletrónica possível do átomo de enxofre num estado excitado.
- Opção (C)
10. Um átomo cuja configuração eletrónica é [Ne] 3s2 tem como número atómico:
(A) 2
(B) 12
(C) 18
(D) 20
- Opção (B)
11. Qual a configuração eletrónica do elemento ferro (26Fe).
- 26Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
12. A configuração eletrónica de um átomo é: 1s22s22p63s13p2.
Das afirmações, qual a que não dispões de dados para responder.
(A) Esta configuração não é possível, pois não obedece à regra de Aufbau.
(B) Esta configuração não obedece à regra de Hund.
(C) Este átomo não pode ser identificado pela sua configuração eletrónica.
(D) O átomo está num estado excitado.
- Opção (B)
13. A orbital 3s2 é do tipo ____, enquanto que a orbital 3px é _____. Podemos dizer que a energia dos eletrões da orbital 3s é _____ à energia dos eletrões 3px·
(A) … esférica … esférica … inferior
(B) … lobular … esférica … superior
(C) … esférica … lobular … inferior
(D) … esférica … lobular … igual
- Opção (C)
14. Sendo o subnível 4s, o último que figura na configuração eletrónica de um átomo no estado fundamental, pode afirmar-se que …
(A) … o seu cerne possui 10 eletrões.”
(B) … possui alguns eletrões em orbitais 3d.”
(C) … a sua configuração eletrónica pode ser 1s22s22p63s23p64s1.”
(D) … o número total de eletrões deste átomo é 20.”
- Opção (C)
15*. Átomos representados por 3919K e4020Ca, no estado de energia mínima, têm o mesmo número de …
(A) orbitais completamente preenchidas.
(B) protões nos respetivos núcleos.
(C) neutrões nos respetivos núcleos.
(D) eletrões em orbitais s.
- Opção (C)
16. Quantos valores diferenciados de energia tem os eletrões de valência de um átomo de Fluor (9F) no estado fundamental?
(A) Quatro.
(B) Seis.
(C) Três.
(D) Dois.
- Opção (D)