Ficha nº4 : Exames e TI (2015 – 2018)
Voltar a: 10ºAno – Química
Ficha nº4
Exercícios de exames e testes intermédios (2015 – 2018)
10ºano – Química – Domínio 2 – Subdomínio 1 (Ligação química)
1. (2015 – 1ªF) Quantos eletrões de valência existem, no total, na molécula de HCl?
- Oito
⇒ O átomo de cloro, Cl, sendo do grupo 17 tem 7 eletrões de valência, e o de hidrogénio, H, do grupo 1, tem 1.
⇒ A molécula de HCl terá 8 eletrões de valência.
- Oito [eletrões] ou quatro pares [de eletrões] …………. 5 pontos
2. (2015 – 2ªF) A molécula de CO2 é
(A) linear, e o átomo central apresenta eletrões de valência não ligantes.
(B) angular, e o átomo central apresenta eletrões de valência não ligantes.
(C) linear, e o átomo central não apresenta eletrões de valência não ligantes.
(D) angular, e o átomo central não apresenta eletrões de valência não ligantes.
- Opção (C)
A configuração eletrónica do carbono no estado fundamental é 1s2 2s2 2p2
A configuração eletrónica do oxigénio no estado fundamental é 1s2 2s2 2p4
⇒ A molécula de CO2 possui 16 eletrões de valência que se devem distribuir na molécula de acordo com a regra do octeto (cada átomo de ficar rodeado por 8 eletrões).
⇒ É uma molécula onde os átomos de oxigénio (O) se encontram ligados a um átomo central de carbono (C).
⇒ A estrutura de Lewis desta molécula é
⇒ O átomo central não tem dupletos não ligantes. Para que os pares de eletrões ligantes estejam o mais afastados possível é necessário que a molécula assuma geometria linear, ou seja, o ângulo de ligação será de 180°.
- Opção (C) …………. 5 pontos
3. (2015 – 2ªF) A variação de energia associada à formação de 2 mol de amoníaco, a partir da reação de síntese considerada, é -92 kJ.
A energia (média) da ligação N – H é 393 kJ mol-1.
Determine a energia total que é absorvida na rutura de 1 mol de ligações N ≡ N e de 3 mol de ligações H – H.
Apresente todas as etapas de resolução.
⇒ Na formação de 2 mol de NH3 estabelecem-se 2 × 3 mol ligações N – H, dado existirem 3 ligações N – H em cada molécula.
⇒ A energia libertada na formação das ligações em 2 mol de NH3 :
- (393 kJ mol–1 × 3) × 2 mol = 2358 kJ
⇒ A variação de energia associada à formação de 2 mol de NH3 resulta do balanço da energia absorvida e da libertada:
- ΔE = Eabsorvida – Elibertada ⇒ –92 kJ = Eabsorvida – 2358 kJ ⇔ Eabsorvida = 2266 kJ
- Etapas de resolução:
A) Determinação da energia libertada na formação de 6 mol de ligações N – H (E = 2358 kJ) …….. 5 pontos
B) Determinação da energia total absorvida na rotura de 1 mol de ligações N ≡ N e de 3 mol de ligações H – H (E = 2266 kJ) …….. 5 pontos
4. (2015 – EE) A combustão do etino pode ser traduzida por
2 C2H2 (g) + 5 O2 (g) → 4 CO2 (g) + 2 H2O (l )
A variação de entalpia associada a esta reação é -2,60 x 103 kJ por mole de reação.
A combustão de 1 mol de etino envolverá a
(A) libertação de 2,60 x 103 kJ.
(B) absorção de 2,60 x 103 kJ.
(C) libertação de 1,30 x 103 kJ.
(D) absorção de 1,30 x 103 kJ.
- Opção (C)
- ΔHreação = – 2,60 x 103 kJ mol-1
⇒Como ΔHreação < 0, a combustão do etino envolve libertação de energia.
⇒ A equação química representada indica que a combustão de duas moles de etino envolve a libertação de 2,60 x 103 kJ.
⇒A combustão de 1 mol de etino envolverá a libertação de 1,30 x 103 kJ
- Opção (C)…………. 5 pontos
5. (2015 – EE) Na molécula de etino, C2H2, a ligação entre os átomos de carbono é covalente tripla. Na molécula de eteno, C2H4, a ligação entre os átomos de carbono é covalente dupla.
Comparando aquelas ligações entre os átomos de carbono, verifica-se que a ligação na molécula de eteno tem ____ energia e ____ comprimento.
(A) menor … menor
(B) menor … maior
(C) maior … maior
(D) maior … menor
- Opção (B)
⇒ A ligação tripla carbono-carbono é mais forte e mais curta que a ligação dupla carbono-carbono.
⇒ A ligação dupla de eteno tem menor energia e maior comprimento do que a ligação tripla de etino.
- Opção (B)…………. 5 pontos
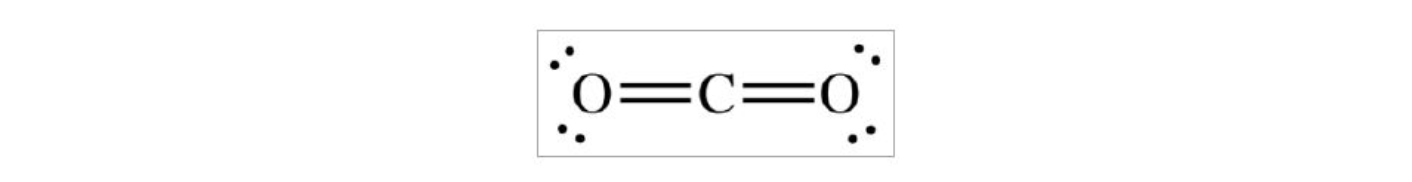
6. (2016 – 1ªF) Em qual das opções seguintes está representada na notação de Lewis a molécula de dióxido de carbono?
- Opção (D)
⇒ Na molécula de dióxido de carbono existem 4 pares de eletrões ligantes (2 pares por cada ligação entre o carbono e cada um dos átomos de oxigénio) e 4 pares de eletrões não ligantes nos átomos de oxigénio (2 pares em cada um dos átomos de oxigénio).
- Opção (D) ……………. 5 pontos
7. (2016 – 1ªF) Qual é o ângulo de ligação, em graus, na molécula de CO2?
- O ângulo de ligação na molécula de CO2 é 180º .
⇒ Na molécula de dióxido de carbono, CO2, não existem eletrões não ligantes no átomo central, o de carbono, que está ligado a dois átomos, os de oxigénio.
⇒ Com base no modelo de repulsão de pares de eletrões de valência, podemos deduzir que a energia da molécula é minimizada quando existir um afastamento máximo dos eletrões ligantes, da ligação do carbono com cada um dos dois átomos de oxigénio, ou seja, quando a amplitude do ângulo da ligação O-C-O for de 180º.
- 180º …………. 5 pontos
8. (2016 – EE) Considere a representação da molécula de O2 na notação de Lewis.
Quantos eletrões não compartilhados devem ser representados em cada um dos átomos de oxigénio?
(A) Dois.
(B) Quatro.
(C) Seis.
(D) Oito.
- Opção (B) ……………. 5 pontos
9. (2016 – EE) Os átomos de flúor, de cloro e de bromo podem ligar-se a átomos de hidrogénio, originando as moléculas HF, HCl e HBr, respetivamente.
Ordene as ligações H-F, H-Cl e H-Br por ordem decrescente do comprimento de ligação.
- H – Br > H – Cl > H – F
⇒ Os elementos flúor, cloro e bromo localizam-se no mesmo grupo da Tabela Periódica, grupo 17, e nos períodos 2, 3 e 4, respetivamente, ou seja, o flúor antecede o cloro e o cloro antecede o bromo no mesmo grupo da T. P.
⇒ Como o raio atómico aumenta ao longo do grupo, o raio atómico do bromo é superior ao raio atómico do cloro e o raio atómico do cloro é superior ao raio atómico do flúor.
⇒ Como estes átomos se ligam todos ao mesmo átomo 1átomo de hidrogénio2, o comprimento de ligação H – Br é maior do que o comprimento de ligação H – Cl e o comprimento de ligação H – Cl é maior do que o comprimento de ligação H – F.
- H-Br ; H-Cl ; H-F …….. 5 pontos
10. (2017 – 1ªF) A molécula de CO2 apresenta geometria linear, porque
(A) é uma molécula triatómica.
(B) é uma molécula simétrica.
(C) não existem eletrões de valência não ligantes no átomo de carbono.
(D) existem eletrões de valência não ligantes nos átomos de oxigénio.
- Opção (C)
⇒ A molécula de dióxido de carbono, CO2 , apresenta 4 pares de eletrões ligantes (2 pares de eletrões ligantes para cada ligação entre o carbono e cada um dos átomos de oxigénio).
⇒ Apresenta 4 pares de eletrões não ligantes (2 pares de eletrões em cada um dos átomos de oxigénio), mas nenhum deles no átomo de carbono.
- A geometria molecular do CO2 é linear.
- Opção (C) ……………. 5 pontos
11. (2017 – 1ªF) O ácido metanoico, HCOOH (M = 46,03 g mol-1), também conhecido por ácido fórmico, é um ácido monoprótico fraco (a sua constante de acidez é 1,7 x 10-4, a 25 ºC) cuja ionização em água pode ser traduzida por
HCOOH (aq) + H2O (l) ⇋ HCOO− (aq) + H3O+ (aq)
Quantos eletrões de valência existem, no total, na molécula de ácido metanoico?
⇒ A molécula de ácido metanoico, HCOOH, tem 2 átomos de hidrogénio, 2 de oxigénio e 1 de carbono.
⇒ Estes elementos pertencem aos grupos 1, 16 e 14, respetivamente, e apresentam 1 eletrão de valência o H, 6 o O e 4 o C.
⇒ Nesta molécula existem (2 x 1 + 2 x 6 + 4) = 18 eletrões de valência (a título de exemplo, apresenta-se a estrutura de Lewis desta molécula, onde se pode verificar a existência de 9 pares de eletrões de valência, 5 ligantes e 4 não ligantes).
- 18 eletrões ……………. 5 pontos
12. (2017 – 2ªF) Na representação da molécula de N2 na notação de Lewis, quantos eletrões, no total, devem estar representados?
- 10 eletrões
⇒ O nitrogénio, Z = 7, com configuração eletrónica no estado fundamental 1s2 2s2 2p3, tem 5 eletrões de valência.
⇒ Na notação de Lewis representam-se os eletrões dos dois átomos.
⇒ Um traço representa um par de eletrões partilhados e cada ponto representa um dos eletrões de valência não partilhados.
- 10 [eletrões.] …………. 5 pontos
13. (2017 – EE) Numa molécula de metano, há no total, ___ eletrões de valência, ___ eletrões de valência não ligantes.
(A) oito … existindo
(B) oito … não existindo
(C) quatro … existindo
(D) quatro … não existindo
- Opção (B)
⇒ A molécula de metano tem um átomo de carbono (grupo 14) com quatro eletrões de valência e quatro átomos de hidrogénio (grupo 1) cada um com um eletrão de valência.
- 4 + 4 = 8 eletrões de valência.
⇒ Nessa molécula há, assim, quatro ligações covalentes simples C–H (figura ao lado), isto é, a distribuição dos oito eletrões de valência mostra que, neste caso, todos são ligantes.
- Na molécula de metano, há no total oito eletrões de valência não existindo eletrões de valência não ligantes.
- Opção (B) ……………. 5 pontos
14. (2017 – EE) Qual é a geometria da molécula de metano?
- Geometria tetraédrica.
⇒ Na molécula de metano, há no total oito eletrões de valência, formando quatro ligações covalentes simples C–H.
⇒ De acordo com a teoria de repulsão dos pares eletrónicos de valência, a disposição espacial dos átomos em torno de um átomo central é a que conduz à máxima estabilidade da molécula.
- O máximo afastamento possível dos quatro pares eletrónicos na molécula de metano corresponde a uma distribuição segundo uma geometria tetraédrica.
- [Geometria] tetraédrica …………. 5 pontos
15. (2018 – PM) O flúor e o oxigénio são dois elementos pertencentes ao mesmo período da Tabela Periódica.
O difluoreto de oxigénio, OF2 é um composto químico formado por estes dois elementos que possui uma geometria muito semelhante à da molécula de água, H2O.
15.1. A geometria da molécula de água é ____, e o seu ângulo de ligação tem um valor de, aproximadamente, _____.
(A) angular … 107º
(B) tetraédrica … 104,5º
(C) tetraédrica … 107º
(D) angular … 104,5º
- Opção (D) ……………. 5 pontos
15.2. Tendo em conta a sua geometria molecular, quantos eletrões desemparelhados devem estar representados na fórmula de estrutura da molécula de difluoreto de oxigénio, OF2?
- 16 (eletrões) ……………. 5 pontos