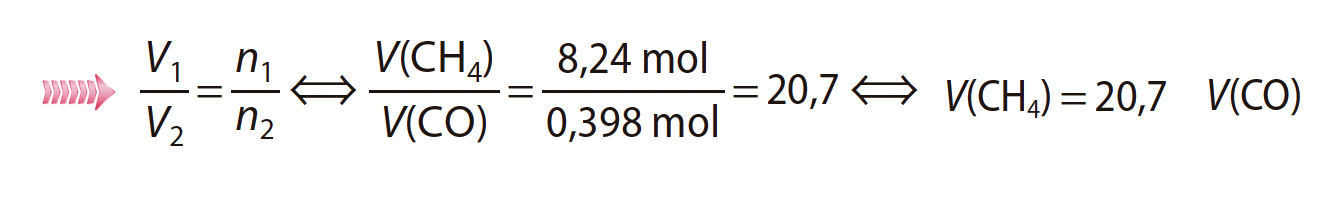Ficha nº3 : Exames e TI (2010 – 2012)
Voltar a: 10ºAno – Química
Ficha nº3
Exercícios de exames e testes intermédios (2010 – 2012)
10ºano – Química – Domínio 2 – Subdomínio 2 (Gases e dispersões)
1. (2010 – EE) Considere várias amostras de CO2 (g), contidas em recipientes fechados, sob as mesmas condições de pressão e de temperatura.
Selecione a única opção que apresenta um esboço do gráfico que pode traduzir a relação entre a densidade das amostras de CO2 (g) e o número de moléculas desse gás existentes nessas amostras.
- Opção (C)
⇒ Nas mesmas condições de pressão e temperatura, a densidade de um gás é independente do número de moléculas.
⇒ A densidade de um gás, ρ, é a razão entre a sua massa, m, e o respetivo volume, V:
- ρ = m /V
⇒ Considerando n mol de um gás, a densidade será:
⇒ (independente do número de moléculas).
- Opção (C)…………. 5 pontos
2. (2010 – EE) Leia o seguinte texto.
Chuva ácida é a designação dada à água da chuva cuja acidez seja superior à resultante da dissolução do dióxido de carbono atmosférico em água. Esta dissolução determina, só por si, um pH de cerca de 5,6.
A principal causa deste aumento de acidez é a emissão para a atmosfera, em quantidades significativas, de compostos gasosos contendo enxofre e azoto, que originam ácidos fortes em meio aquoso.
Os efeitos ambientais da chuva ácida levaram à adoção, pela generalidade dos países, de medidas restritivas da queima de combustíveis fósseis.
Identifique a principal causa de origem antropogénica, referida no texto, responsável pela emissão para a atmosfera de compostos gasosos contendo enxofre e azoto.
⇒ Queima de combustíveis fósseis.
- Queima de combustíveis fósseis …………. 5 pontos
3. (2010 – EE) A percentagem, em volume, de dióxido de carbono, CO2, na atmosfera terrestre atual é 0,39%.
Determine o número de moléculas de dióxido de carbono presentes numa amostra de 10 dm3 de ar, nas condições PTN.
Apresente todas as etapas de resolução.
⇒ % V/V(CO2) = 0,39%
⇒ V(CO2)/V(ar) = 0,39/100
- V(CO2) = V(ar) x 0,39/100 ⇔ V(CO2) = (10,0 dm3) x (0,39 x 10-2) = 3,9 x 10-2 dm3
⇒ Sendo o volume molar, em condições PTN, igual a 22,4 dm3 mol-1 e o número de moléculas por mol igual a 6,022 x 1023, (NA), a quantidade (n) de CO2 que existe nesta amostra de ar será:
⇒ Número de moléculas (N) é:
- N = n x NA = 1,74 x 10-3 x 6,022 x 1023 = 1,0 x 1021 moléculas
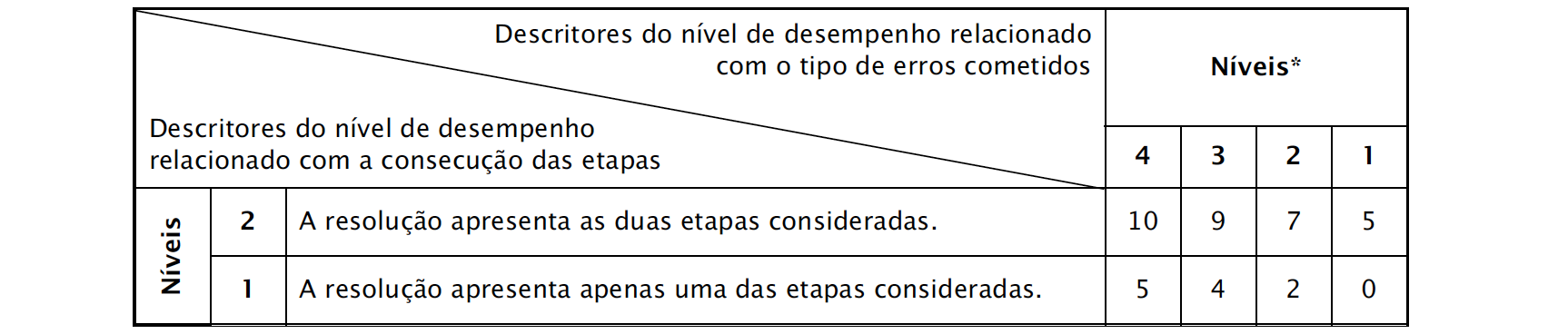
- A resolução deve apresentar, no mínimo, as seguintes etapas:
⇒ Calcula o volume de CO2 existente em 10 dm3 de ar (V = 3,9 x 10−2 dm3).
⇒ Calcula o número de moléculas de CO2 existentes nesse volume de ar, em condições PTN (N = 1,0 x 1021 ).
A classificação da resposta a este item é feita em função do enquadramento da mesma num dos níveis de desempenho, de acordo com a tabela seguinte.
4. (TI – 03/03/2011) O dióxido de carbono, CO2 , desempenha um papel importante na regulação da temperatura superficial da Terra.
O teor médio de CO2 na troposfera tem aumentado de forma continuada nos últimos 150 anos, apresentando atualmente um valor de cerca de 3,9 x 10-2 %, em volume.
O teor de CO2 na troposfera, expresso em partes por milhão, em volume (ppmV), pode ser determinada a partir da expressão
- Opção (B)
⇒ Por definição:
- % V/V = VCO2/Var x 100
- ppmV = VCO2/Var x 106
⇒ Comparando as duas definições, vem:
- ppmV= % V/V x 104
- Opção (B)…………. 8 pontos
5. (TI – 03/03/2011) Refira dois fatores, de natureza antropogénica, que possam justificar o aumento do teor médio de CO2 na troposfera.
⇒ Uso de combustíveis fósseis e incêndios florestais provocados pelo Homem.
A resposta deve apresentar dois dos seguintes tópicos:
A) Aumento da queima dos combustíveis fósseis.
OU
Outro fator relacionado (aumento da circulação automóvel, etc.).
B) Aumento da desflorestação.
OU
Outro fator relacionado (aumento da limpeza e da queima de terrenos florestais, etc.).
C) Atividade das indústrias transformadoras.
A classificação da resposta a este item é feita em função do enquadramento da mesma num dos níveis de desempenho, de acordo com a tabela seguinte.
6. (TI – 03/03/2011) Calcule o número de moléculas de CO2 que existem numa amostra de 10,0 dm3 de ar troposférico, em condições PTN.
Apresente todas as etapas de resolução.
⇒ Como o teor médio de CO2 na troposfera apresenta atualmente um valor de:
- 3,9 x 10-2 % em 10 dm3 de ar teremos:
⇒ % V/V = VCO2/Var x 100 ⇔ VCO2 = 10 x 3,9 x 10-4 dm3
⇒ Sendo o volume molar igual a 22,4 dm3 mol-1 (NA), a quantidade (n) de CO2 e o número de moléculas por mol igual a 6,022 x 1023, que existe nesta amostra de ar será:
⇒ Número de moléculas (N) é:
- N = n x NA ⇔ N = (1,74 x 10-4 mol) x (6,022 x 1023 mol-1) = 1,0 x 1020 moléculas
- A resolução deve apresentar as seguintes etapas:
A) Determinação do volume de CO2 na amostra de ar troposférico (V = 3,90 x 10-3 dm3).
B) Determinação da quantidade de CO2 que existe na amostra de ar troposférico, em condições PTN (n = 1,74 x 10-4 mol).
C) Determinação do número de moléculas de CO2 que existem na referida amostra (N = 1,0 x 1020 moléculas).
A resposta a este item deve ser enquadrada num dos níveis de desempenho relacionados com a consecução das etapas, de acordo com a tabela seguinte.
A classificação a atribuir à resposta resulta da pontuação decorrente do enquadramento num dos níveis de desempenho atrás descritos, à qual podem ser subtraídos pontos, de acordo com o enquadramento nos níveis de desempenho relacionados com o tipo de erros cometidos.
7. (TI – 03/03/2011) Qual é a percentagem, em massa, de carbono em 1 mole de moléculas de CO2?
- 27,29 % —————————– 8 pontos
Nota – O resultado pode ser apresentado com um n mero diferente de algarismos significativos.
8. (TI – 03/03/2011) Em seguida, foi pedido ao aluno que preparasse, com rigor, 50,0 cm3 de uma solução aquosa de cloreto de sódio de concentração 0,23 mol dm-3, a partir da solução inicialmente preparada de concentração 5,71 × 10-1 mol dm-3.
8.1. Calcule o volume de solução inicial necessário para preparar o volume referido de solução diluída de cloreto de sódio.
Apresente todas as etapas de resolução.
⇒ Solução diluída:
- cd = 0,23 mol dm-3
- Vd = 50,0 cm3
Numa diluição, a quantidade, n, de soluto, NaCl, mantém-se.
⇒ Assim, a quantidade de NaCl necessária para a preparação da solução diluída é:
- nd = cd x Vd = 50,0 x 0,23 x 10-3 mol = 1,15 x 10-2 mol
⇒ Solução concentrada:
- cc = 5,71 x 10-1 mol = 1,15 x 10-2 mol dm-3
⇒ Devemos diluir a 50,0 cm3 um volume V desta solução que contenha 1,15 x 10-2 mol de NaCl:
- Vc x (5,71 x 10-1 mol dm-3) = 1,15 x 10-2 mol
- A resolução deve apresentar as seguintes etapas:
A) Determinação da quantidade de cloreto de sódio necessária à preparação da solução diluída (n = 1,15 x 10-2 mol).
B) Determinação do volume de solução inicial de cloreto de sódio que contém aquela quantidade (V = 20 cm3).
A resposta a este item deve ser enquadrada num dos níveis de desempenho relacionados com a consecução das etapas, de acordo com a tabela seguinte.
A classificação a atribuir à resposta resulta da pontuação decorrente do enquadramento num dos níveis de desempenho atrás descritos, à qual podem ser subtraídos pontos, de acordo com o enquadramento nos níveis de desempenho relacionados com o tipo de erros cometidos.
8.2. Descreva o procedimento experimental seguido na preparação da solução diluída de cloreto de sódio, referindo, sequencialmente, as três principais etapas envolvidas nesse procedimento.
⇒ Com pipeta volumétrica transferia 20 cm3 de solução de NaCl de concentração 5,71 x 10-1 mol dm-3 para um balão volumétrico de 50,0 cm3 e adicionava seguidamente água destilada completando o volume até ao traço de referência (leitura pelo menisco inferior, evitando erros de paralaxe).
- A resposta deve apresentar dois dos seguintes tópicos:
A) A primeira etapa é a medição do volume (OU de 20 cm3) de solução inicial de cloreto de sódio, utilizando uma pipeta (graduada ou volumétrica).
B) A segunda etapa é a transferência desse volume de solução para um balão volumétrico de 50,0 mL.
C) A terceira etapa é perfazer o volume de 50,0 cm3 com água destilada (adicionando água destilada até ao traço de referência do balão volumétrico).
A classificação da resposta a este item é feita em função do enquadramento da mesma num dos níveis de desempenho, de acordo com a tabela seguinte.
9. (TI – 05/05/2011) Em determinadas condições de pressão e de temperatura, 0,5 mol de N2 (g) ocupa o volume V1.
Nas mesmas condições de pressão e de temperatura, 0,5 mol de NO2 (g) ocupa o volume
(A) 2/3 V1
(B) V1
(C) 3/2 V1
(D) 2 V1
- Opção (B)
⇒ Em 0,5 mol de N2 (g) existe o mesmo número de partículas que em 0,5 mol de NO2 (g), logo, pela lei de Avogadro, os volumes deste gases são iguais pois volumes iguais de gases diferentes, nas mesmas condições de pressão e temperatura, contêm o mesmo número de partículas,
- Opção (B)…………. 8 pontos
10. (2011 – 1ªF) Considere uma amostra de 8,24 mol de CH4 (g) e uma amostra de 0,398 mol de CO (g), nas mesmas condições de pressão e de temperatura.
Quantas vezes é que o volume ocupado pela amostra de metano é maior do que o volume ocupado pela amostra de monóxido de carbono?
Apresente o resultado com três algarismos significativos.
⇒ Avogadro estabeleceu que, nas mesmas condições de pressão e temperatura, tratando-se de gases ideais (ou gases reais a pressões e temperaturas em que apresentem comportamento de gases ideais), volumes iguais contêm o mesmo número de partículas.
⇒ Nas mesmas condições de pressão e temperatura o volume é diretamente proporcional à quantidade química:
- 20,7 vezes …………. 5 pontos
Nota – O resultado pode ser apresentado com três algarismos significativos numa forma matemática equivalente.
11. (2011 – 1ªF) O gás natural, muito utilizado como combustível, é uma mistura cujo principal constituinte é o metano.
Um dos componentes minoritários que pode existir no gás natural é o azoto, N2 (g).
A composição em N2 (g), expressa em partes por milhão em volume, de uma amostra de gás natural que contém 1,3%, em volume, de azoto, pode ser determinada a partir da expressão
- Opção (A)…………. 5 pontos
12. (2011 – 2ªF) A tabela seguinte apresenta a composição de uma amostra de ar.
Qual das expressões seguintes permite calcular a fração molar de O2 (g), xO2, nessa amostra?
- Opção (B)…………. 5 pontos
13. (2011 – EE) A troposfera é a camada da atmosfera mais próxima da superfície da Terra.
Dos gases presentes na troposfera, são determinantes para a regulação da temperatura na vizinhança da superfície da Terra
(A) os gases que existem em maior percentagem.
(B) o ozono e o oxigénio.
(C) o ozono e o azoto.
(D) os gases com efeito de estufa.
- Opção (D)
⇒ Dos gases minoritários presentes na troposfera responsáveis pela regulação da temperatura são os que contribuem para o efeito de estufa, pelo que a opção correta é a (D), uma vez que quer o oxigénio quer o azoto são maioritários.
- Opção (D)…………. 5 pontos
14. (2011 – EE) Em condições normais de pressão e de temperatura (PTN), o volume ocupado por 13 g de ozono é
- Opção (B)…………. 5 pontos
15. (TI – 27/04/2012) A atmosfera terrestre é uma faixa gasosa que cobre a superfície da Terra, sendo retida pela atração gravítica exercida pelo planeta.
Na atmosfera, a densidade e a pressão decrescem exponencialmente com a altitude. A temperatura apresenta, no entanto, uma variação mais complexa, decrescendo com o aumento da altitude em algumas camadas da atmosfera e aumentando noutras.
O ar que constitui a camada mais baixa da atmosfera, a troposfera, é uma mistura de gases composta essencialmente por cerca de 78%, em volume, de azoto e 21%, em volume, de oxigénio. Os restantes gases – árgon, vapor de água, dióxido de carbono, néon, etc. – existem em percentagens relativamente baixas, embora alguns deles sejam muito importantes para a vida na Terra.
F. Duarte Santos, Que Futuro? Ciência, Tecnologia,
Desenvolvimento e Ambiente, Gradiva, 2007 (adaptado)
O número de moléculas de oxigénio que existem em 100 dm3 de ar, na troposfera, em condições normais de pressão e de temperatura, pode ser calculado através da expressão
- Opção (D)
⇒ De acordo com o 3.º parágrafo do texto, o ar, na troposfera, contém cerca de 21% em volume de dioxigénio.
Assim, o volume de O2 existente em 100 dm3 de ar é 0,21 x 100 dm3.
⇒ Como n = V/Vm e o volume molar (Vm) de um gás nas condições PTN = 22,4 dm3 mol-1, a quantidade de O2 existente em 100 dm3 de ar (nas condições PTN) será:
⇒ Como N = n x NA, o n mero de moléculas de O2 existente em 100 dm3 de ar é:
- Opção (D)…………. 8 pontos