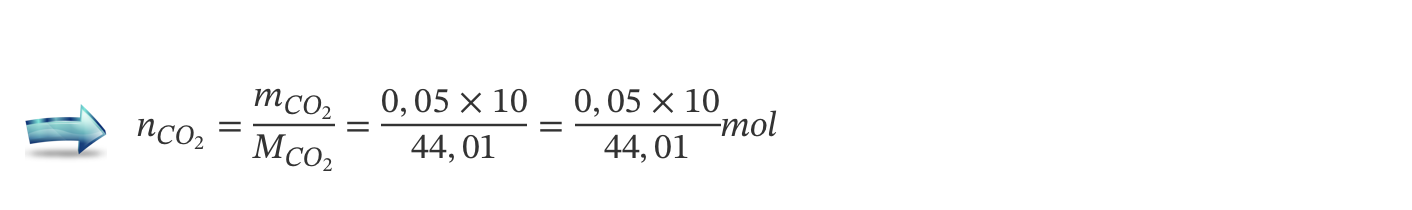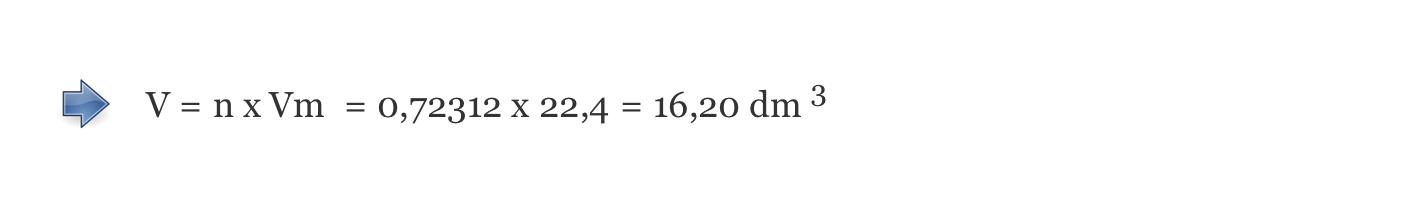2017 – 1ª Fase – Prova Escrita de Física e Química A
Voltar a: Física e Química
- Prova Escrita de Física e Química A – versão 1
- Prova 715: 1.ª Fase – 2017
GRUPO I
O ar seco é uma mistura gasosa constituída essencialmente por nitrogénio, N2 (g), e por oxigénio, O2 (g), na qual existem ainda componentes minoritários como o árgon, Ar (g), e o dióxido de carbono, CO2 (g).
1. Considere que o teor de CO2 (g) no ar seco é, aproximadamente, 0,05 % (m/m).
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
1.1. O teor de CO2 (g) no ar seco, em ppm, é, aproximadamente,
(A) 5 x 106 ppm
(B) 5 x 104 ppm
(C) 5 x 102 ppm
(D) 5 ppm
- Opção (C) ……………. 5 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
1.2. Qual das expressões seguintes permite calcular a quantidade de CO2 que existirá numa amostra de 1 kg de ar seco?

- Opção (A) ……………. 5 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
2. Considere que em 100 g de ar seco existem 23,14 g de O2 (g) e que, nas condições normais de pressão e de temperatura (PTN), a massa volúmica do ar seco é 1,30 g dm-3.
Determine a percentagem em volume de O2 ( g ) no ar seco.
Apresente todas as etapas de resolução.
- Etapas de resolução:
A) Cálculo do volume ocupado por 23,14 g de O2 , nas condições normais de pressão e de temperatura (V = 16,20 dm3) …….. 4 pontos
B) Cálculo do volume ocupado por 100 g de ar seco, nas condições normais depressão e de temperatura (V = 76,92 dm3) …….. 4 pontos
C) Cálculo da percentagem em volume de O2 ( g ) no ar seco (21,1 % (V/V )) …….. 2 pontos
ou
A) Cálculo da massa de O2 ( g ) em 1 dm3 de ar seco, nas condições normais de pressão e de temperatura (m = 0,3008 g) …….. 4 pontos
B) Cálculo do volume ocupado por 0,3008 g de O2 ( g ), nas condições normais de pressão e de temperatura (V = 0,2106 dm3) …….. 4 pontos
C) Cálculo da percentagem em volume de O2 ( g ) no ar seco (21,1 % (V/V )) …….. 2 pontos
ou
A) Cálculo do volume ocupado por 100 g de ar seco, nas condições normais depressão e de temperatura (V = 76,92 dm3) …….. 4 pontos
B) Cálculo da quantidade de matéria em 76,92 dm3 (100 g) de ar seco (n = 3,434 mol) e da quantidade de O2 ( g ) na mesma massa de ar seco (n = 0,7231 mol) …….. 4 pontos
C) Cálculo da percentagem em quantidade de O2 (g) no ar seco (21,1 %) e identificação dessa percentagem com a percentagem em volume. …….. 2 pontos
ou
A) Cálculo da massa de um determinado volume de ar seco, nas condições normais de pressão e de temperatura …….. 4 pontos
B) Cálculo do volume de O2 (g) na mesma massa de ar seco …….. 4 pontos
C) Cálculo da percentagem em volume de O2 (g) no ar seco (21,1 % (V/V )) …….. 2 pontos
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
3. A molécula de CO2 apresenta geometria linear, porque
(A) é uma molécula triatómica.
(B) é uma molécula simétrica.
(C) não existem eletrões de valência não ligantes no átomo de carbono.
(D) existem eletrões de valência não ligantes nos átomos de oxigénio.
- Opção (C)
⇒ A molécula de dióxido de carbono, CO2 , apresenta 4 pares de eletrões ligantes (2 pares de eletrões ligantes para cada ligação entre o carbono e cada um dos átomos de oxigénio).
⇒ Apresenta 4 pares de eletrões não ligantes (2 pares de eletrões em cada um dos átomos de oxigénio), mas nenhum deles no átomo de carbono.
- A geometria molecular do CO2 é linear.
- Opção (C) ……………. 5 pontos
- 10ºano – Química – Domínio 1 – subdomínio 3 (Tabela periódica)
4. Explique, com base nas configurações eletrónicas dos átomos de carbono e de oxigénio no estado fundamental, porque é que o raio atómico do carbono é maior do que o raio atómico do oxigénio.
Apresente num texto a explicação solicitada.
- 6C – 1s2 2s2 2p2
- 8O – 1s2 2s2 2p4
⇒ O raio atómico é tanto menor quanto maior a carga elétrica nuclear e menor a blindagem nuclear por eletrões interiores.
⇒ No caso presente os eletrões de valência dos dois átomos estão no mesmo nível (n = 2) e, portanto, há o mesmo número de eletrões interiores ( na orbital 1s) .
⇒ Como a carga nuclear do átomo O (8+) é maior do que a do átomo C (6+) , a força atrativa núcleo-eletrões no tomo de O é maior do que a exercida no átomo de C , pelo que o raio atómico do oxigénio é menor do que o do carbono.
- A resposta integra os tópicos de referência seguintes ou outros de conteúdo equivalente:
A) Os eletrões de valência dos átomos de carbono e de oxigénio [no estado fundamental] encontram-se no mesmo nível de energia [(n = 2)].
B) Sendo a carga nuclear do átomo de carbono inferior à do átomo de oxigénio, a força [atrativa] exercida pelo núcleo do átomo de carbono sobre os eletrões [de valência] é menor [do que a força atrativa exercida pelo núcleo do átomo de oxigénio sobre os eletrões de valência, pelo que o raio atómico do carbono é maior do que o raio atómico do oxigénio].
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
5. Um dos iões mais abundantes na ionosfera é o ião O+ (g).
A configuração eletrónica de valência do ião O+ (g) no estado fundamental apresenta, no total,
(A) dois eletrões desemparelhados.
(B) três eletrões desemparelhados.
(C) duas orbitais completamente preenchidas.
(D) três orbitais completamente preenchidas.
- Opção (B)
- 8O+ – 1s2 2s2 2px1 2py1 2pz1
⇒ O ião O+ apresenta uma configuração eletrónica de valência com 4 orbitais, 1 orbital completamente preenchida e 3 orbitais semipreenchidas.
⇒ Assim, 2 eletrões de valência estão emparelhados na orbital 2s e 3 eletrões de valência estão desemparelhados nas orbitais 2px , 2py e 2pz (de acordo com a Regra de Hund, maximizando o número de eletrões desemparelhados em orbitais degeneradas).
- Opção (B) ……………. 5 pontos
GRUPO II
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
1. À pressão constante de 1 atm, a capacidade térmica mássica do ar é cerca de 1/4 da capacidade térmica mássica da água.
Considere uma amostra de ar e uma amostra pura de água, de massas mar e 2mar , respetivamente, às quais foi fornecida a mesma energia, como calor, à pressão constante de 1 atm.
A variação da temperatura da amostra de ar, comparada com a variação da temperatura da amostra de água, será, aproximadamente,
(A) duas vezes menor.
(B) duas vezes maior.
(C) oito vezes menor.
(D) oito vezes maior.
- Opção (D)
⇒ A capacidade térmica mássica, 𝑐, de um material é energia, 𝐸, por unidade de massa, 𝑚, e por unidade de variação de temperatura, Δ𝑇:
 ⇒ A variação de temperatura do ar é:
⇒ A variação de temperatura do ar é:

⇒ (para a mesma energia, a variação de temperatura do ar é 8 vezes maior do que a da água, pois a massa de ar é 2 vezes menor e a sua capacidade térmica mássica é 4 vezes menor).
- Opção (D) ……………. 5 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
2. Quando se liga um aquecedor, estabelecem-se correntes de convecção no ar.
Nestas correntes,
(A) o ar quente, menos denso, sobe e o ar frio, mais denso, desce.
(B) o ar quente, mais denso, desce e o ar frio, menos denso, sobe.
(C) o ar quente, menos denso, desce e o ar frio, mais denso, sobe.
(D) o ar quente, mais denso, sobe e o ar frio, menos denso, desce.
- Opção (A)
⇒ O ar que se encontra mais próximo do aquecedor aquece, tornando-se menos denso, o que dá origem a uma corrente quente ascendente.
⇒ O ar, ao subir, arrefece, tornando-se mais denso, o que dá origem a uma corrente fria descendente.
- Opção (A) ……………. 5 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
3. Foi realizado um trabalho de 240 J sobre uma amostra de ar, tendo a energia interna da amostra diminuído 500 J.
No processo termodinâmico considerado, a amostra
(A) cedeu 260 J, como calor.
(B) recebeu 260 J, como calor.
(C) cedeu 740 J, como calor.
(D) recebeu 740 J, como calor.
- Opção (C)
⇒ Trabalho fornecido à amostra: W = 240 J
⇒ Diminuição da energia interna da amostra: ΔU = – 500 J
⇒ Para determinar a energia transferida como calor, Q , recorre-se à 1.ª Lei da Termodinâmica.
- ΔU = W + Q ⇒ – 500 = 240 + Q ⇔ Q = – 500 – 240 = – 740 J
⇒ Como o valor de Q é negativo, significa que a amostra de ar cedeu às vizinhanças 740 J
- Opção (C) ……………. 5 pontos
GRUPO III
1. Quando um sinal sonoro se propaga no ar, há variações da pressão em cada ponto.
O gráfico da Figura 1 representa a variação da pressão do ar, Δp, em relação à pressão de equilíbrio, em função do tempo, t, num ponto em que um som é detetado.

- 11ºano – Física – Domínio 2 – subdomínio 1 (Sinais e ondas)
1.1. Qual é a frequência angular do sinal sonoro?
(A) 6,7 x 102 rad s-1
(B) 3,3 x 102 rad s-1
(C) 4,2 x 103 rad s-1
(D) 2,1 x 103 rad s-1
- Opção (D) ……………. 5 pontos
- 11ºano – Física – Domínio 2 – subdomínio 1 (Sinais e ondas)
1.2. O gráfico mostra que, no intervalo de tempo [0,0 ; 7,5] ms,
(A) a onda sonora é transversal.
(B) a onda sonora é complexa.
(C) a amplitude da variação da pressão no ponto considerado é constante.
(D) a velocidade de propagação do sinal sonoro é constante.
- Opção (C)
⇒ A amplitude da variação de pressão é igual ao valor máximo da função representada, o qual permanece constante.
⇒ No gráfico apenas se representa uma determinada propriedade num certo ponto do espaço em função do tempo, não existindo qualquer informação sobre o facto de a onda ser transversal ou longitudinal.
⇒ O sinal apresentado corresponde a uma onda harmónica (um sinal complexo não tem um padrão sinusoidal).
⇒ Este gráfico traduz a periodicidade no tempo e não nos dá informação nem sobre a periodicidade no espaço nem sobre a velocidade de propagação.
- Opção (C) ……………. 5 pontos
- 11ºano – Física – Domínio 2 – subdomínio 1 (Sinais e ondas)
2. Um som emitido à superfície de um lago é detetado por um sensor, colocado dentro de água, e por um outro sensor, colocado no ar.
Os dois sensores estão à mesma distância do local onde o som é emitido, mas o sensor que se encontra dentro de água deteta o som 1,14 s antes do sensor que se encontra no ar.
Considere que a velocidade de propagação do som na água do lago é 1,5 x 103 m s-1, que a velocidade de propagação do som no ar é 3,4 x 102 m s-1 e que tágua e tar representam o tempo decorrido desde a emissão do som até à sua deteção pelo sensor que se encontra dentro de água e pelo sensor que se encontra no ar, respetivamente.
Qual dos sistemas de equações seguintes pode traduzir a situação física descrita?

- Opção (A)
⇒ O som demora mais 1,14 s a propagar-se no ar do que na água, pelo que:
- tar = tágua + 1,14 s ⇔ tar − tágua = 1,14 s
⇒ Os dois sensores estão à mesma distância do local onde o som é emitido, pelo que:
- Δxágua = Δxar ⇔ vágua x tágua = var x tar ⇔ 1,5 x 103 x tágua = 3,4 x 102 x tar
- Opção (A) ……………. 5 pontos
GRUPO IV
1. A Figura 2 representa parte da trajetória de um balão meteorológico que sobe na atmosfera, com velocidade de módulo praticamente constante.
Considere que o balão pode ser representado pelo seu centro de massa (modelo da partícula material) e que a variação do módulo da aceleração gravítica com a altura em relação ao solo é desprezável.

- 10ºano – Física – subdomínio 1 (Energia e movimentos)
1.1. O trabalho realizado pelo peso do balão entre as posições C e D
(A) é superior ao trabalho realizado pelo peso do balão entre as posições A e B.
(B) é igual ao trabalho realizado pelo peso do balão entre as posições A e B.
(C) é independente da massa do balão.
(D) depende apenas da massa do balão.
- Opção (B)
⇒ O trabalho realizado pelo peso do balão entre quaisquer duas posições é simétrico da variação da energia potencial gravítica do sistema balão + Terra entre as mesmas posições:
- WP = – ΔEp ⇔ WP = – m g Δh
Desta relação verifica-se que o trabalho realizado pelo peso depende da massa, m , da aceleração da gravidade, g , e da diferença de altura, Δh.
⇒ Da Figura 2 do enunciado, a diferença de altura entre as posições A e B é igual à diferença de altura entre as posições C e D (2 unidades), e considerando g praticamente constante durante toda a trajetória, conclui-se que os trabalhos realizados pelo peso do balão entre as posições referidas apresentam o mesmo valor.
- Opção (B) ……………. 5 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
1.2. Qual dos esboços de gráfico seguintes pode representar a energia mecânica, Em , do sistema balão + Terra, em função da altura, h, do balão em relação ao solo, entre as posições A e D?

- Opção (B)
⇒ A energia mecânica do sistema [balão + Terra] é a soma das energias cinética e potencial gravítica.
⇒ A energia cinética do balão meteorológico mantém-se constante [entre as posições A e D], uma vez que o módulo da velocidade do balão meteorológico é constante.
⇒ A energia potencial gravítica do sistema [balão + Terra] aumenta [entre as posições A e D], uma vez que o balão meteorológico está a subir.
⇒ Como a energia potencial gravítica do sistema [balão + Terra] varia linearmente com a altura [ Ep = m g h ], conclui-se que a energia mecânica do sistema [balão + Terra] também varia linearmente com a altura.
⇒ A função que retrata a energia mecânica do sistema [balão + Terra] em função da altura é Em = Ec + m g h em que m g representa do declive e Ec a ordenada na origem.
- Opção (B) ……………. 5 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
1.3. De acordo com o teorema da energia cinética, o trabalho que seria realizado pela resultante das forças que atuam no balão é igual à variação da energia cinética do balão.
Conclua, com base neste teorema, qual é a intensidade da resultante das forças que atuam no balão, no deslocamento entre as posições A e B.
Apresente num texto a fundamentação da conclusão solicitada.
⇒ Como o balão se move com velocidade constante, a sua energia cinética é, também, constante, ou seja, a variação de energia cinética entre A e B é nula, logo, de acordo com o teorema da energia cinética, também, é nulo o trabalho realizado pela resultante das forças.
⇒ Como o movimento é retilíneo, a resultante das forças só pode ser segundo a direção do movimento.
⇒ Sendo o deslocamento não nulo e o trabalho nulo, conclui-se que a resultante das forças deve ser nula.
ou
⇒ Havendo deslocamento, o trabalho da resultante das forças é nulo se for nula a resultante das forças ou se o deslocamento e a resultante das forças forem perpendiculares.
⇒ Como num movimento retilíneo a resultante das forças não é perpendicular ao deslocamento, conclui-se que terá de ser nula a resultante das forças.
- A resposta integra os tópicos de referência seguintes ou outros de conteúdo equivalente:
A) Como o balão sobe com velocidade [de módulo] constante, a energia cinética do balão mantém-se constante (ou a variação da energia cinética do balão é nula).
B) [Assim, com base no teorema da energia cinética,] o trabalho que seria realizado pela resultante das forças que atuam no balão é igual a zero [, no deslocamento considerado].
C) Não sendo o deslocamento nulo, [entre as posições A e B,] nem sendo a resultante das forças que atuam no balão perpendicular ao deslocamento, conclui-se que a intensidade da resultante das forças que atuam no balão [, naquele deslocamento,]é nula.

- 10ºano – Física – subdomínio 1 (Energia e movimentos)
1.4. Admita que o balão, de massa 600 g , movendo-se com uma velocidade de módulo 5,8 m s-1, demora 45 s a deslocar-se da posição A até à posição B.
Calcule a soma dos trabalhos realizados pelas forças não conservativas que atuam no balão entre as posições A e B.
Apresente todas as etapas de resolução.
⇒ A soma dos trabalhos realizados pelas for as não conservativas que atuam no balão é igual à variação da energia mecânica ( WFNC = ΔEm ).
⇒ A variação da energia mecânica do sistema [balão + Terra] é a soma das variações de energias cinética e potencial gravítica.
⇒ A energia cinética do balão meteorológico mantém-se constante [entre as posições A e D], uma vez que o módulo da velocidade do balão meteorológico é constante.
⇒ A variação da energia potencial gravítica do sistema [balão + Terra] é igual à variação da energia mecânica do sistema [balão + Terra].
⇒ Como o desnível entre a posição A e a posição B, é igual ao deslocamento do balão entre as posições A e B:
- Δy = v x Δt = 5,8 x 45 = 261 m
⇒ A variação da energia potencial gravítica do sistema [balão + Terra]
- ΔEp = m g Δh = 0,600 x 10 x 261 = 1,6 x 103 J
⇒ A soma dos trabalhos realizados pelas forças não conservativas que atuam no balão, no deslocamento considerado é 1,6 x 103 J .
- Etapas de resolução:
A) Determinação do desnível entre a posição A e a posição B (Δh = 261 m) …….. 5 pontos
B) Determinação da soma dos trabalhos realizados pelas forças não conservativas que atuam no balão, no deslocamento considerado (W = 1,6 x 103 J) …….. 5 pontos
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
2. Geralmente, os balões meteorológicos transportam uma radiossonda que emite um sinal eletromagnético de determinada frequência.
Se a frequência desse sinal for 1680 MHz, o comprimento de onda, no ar, da radiação considerada será
(A) 0,560 m
(B) 5,60 m
(C) 179 m
(D) 0,179 m
- Opção (D) ……………. 5 pontos
3. O hidrogénio utilizado nos balões meteorológicos pode ser produzido a partir da reação entre o hidreto de cálcio sólido, CaH2 (s), e a água líquida, formando-se hidróxido de cálcio sólido, Ca(OH)2 (s), e hidrogénio gasoso, H2 (g).
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
3.1. Escreva a equação química que traduz a reação acima descrita.
- CaH2 (s) + 2 H2O (l) → Ca(OH)2 (s) + 2 H2 (g)
- CaH2 (s) + 2 H2O (l) → Ca(OH)2 (s) + 2 H2 (g) (ou equivalente) …………. 5 pontos
Notas:
– A ausência de indicação ou a indicação incorreta dos estados físicos das substâncias envolvidas na reação não implicam qualquer desvalorização.
– A apresentação de ⇋ (em vez de →) não implica qualquer desvalorização.
- 11ºano – Química – Domínio 2 – subdomínio 2 (Reações de oxidação redução)
3.2. O número de oxidação do cálcio no hidreto de cálcio é
(A) +2
(B) +1
(C) -2
(D) -1
- Opção (A)
⇒ O número de oxidação do hidrogénio nos hidretos é −1.
⇒ Designando por 𝑥 o número de oxidação do cálcio pode escrever-se 𝑥 + 2 x (−1) = 0, obtendo-se 𝑥 = +2.
- Opção (A) ……………. 5 pontos
GRUPO V
A Figura 3 representa uma montagem que foi utilizada na determinação experimental do módulo da aceleração gravítica.

Nos vários ensaios realizados, abandonou-se uma esfera sempre da mesma posição inicial, imediatamente acima da célula fotoelétrica A.
1. Numa primeira experiência, mantendo as células fotoelétricas à mesma distância uma da outra, mediu-se o tempo que a esfera demorou a percorrer a distância entre as células A e B, tA→B, e o tempo que a esfera demorou a passar em frente da célula B, tB.
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
- 11ºano – Física – A.l. – 1.1 – Queda livre força gravítica
1.1. Num conjunto de ensaios, realizados nas mesmas condições, obtiveram-se os valores de tB apresentados na tabela seguinte.

Qual é, para esse conjunto de ensaios, o resultado da medição de tB?
(A) tB = (8,80 ± 0,01) ms
(B) tB = (8,80 ± 0,06) ms
(C) tB = (8,80 ± 0,05) ms
(D) tB = (8,80 ± 0,04) ms
- Opção (D)
⇒ O valor mais provável do tempo de passagem em B é:
⇒ Os desvios de cada uma das leituras são:
⇒ A incerteza absoluta é igual ao módulo do desvio máximo, desde que superior à incerteza de leitura do cronómetro digital ( 0,01 ms) , ou seja, igual a 0,04 ms
- O resultado da medição é tB = ( 8,80 ± 0,04) ms
- Opção (D) ……………. 5 pontos
1.2. Dividindo o diâmetro da esfera por tB , determina-se um valor aproximado do módulo da velocidade da esfera no instante em que esta se encontra em frente da célula fotoelétrica B, vB.
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
- 11ºano – Física – A.l. – 1.1 – Queda livre força gravítica
1.2.1. Ao determinar vB por este método, que aproximação se faz?
⇒ Considera-se que a velocidade da esfera no intervalo de tempo 𝑡B aproximadamente constante (despreza-se a variação de velocidade, porque o intervalo de tempo 𝑡B é muito pequeno).
ou
⇒ Considera-se que a velocidade no instante em que a esfera se encontra em frente da célula é aproximadamente igual à velocidade média no intervalo de tempo 𝑡B.
⇒ [Considera-se que] vB é igual ao módulo da velocidade média da esfera [, no tempo que esta demora a passar em frente da célula B] (ou equivalente). …………. 5 pontos
ou
- [Considera-se que] a velocidade (ou o módulo da velocidade) da esfera é constante [, no tempo que esta demora a passar em frente da célula B].
ou
- [Considera-se que] o movimento da esfera é [retilíneo e] uniforme [, no tempo que esta demora a passar em frente da célula B].
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
- 11ºano – Física – A.l. – 1.1 – Queda livre força gravítica
1.2.2. O cálculo de vB pressupõe que a esfera interrompe o feixe luminoso da célula B pelo seu diâmetro.
No entanto, um erro experimental frequente decorre de a esfera interromper, de facto, o feixe luminoso por uma dimensão inferior ao seu diâmetro.
Quando este erro ocorre, o valor de vB calculado é ______ ao verdadeiro, o que determina um erro por ______ no valor experimental do módulo da aceleração gravítica.
(A) superior … excesso
(B) superior … defeito
(C) inferior … excesso
(D) inferior … defeito
- Opção (A)
⇒ Se o cálculo do valor de vB for feito com o valor do diâmetro da esfera, mas com um valor medido de tB inferior ao valor verdadeiro, fará com que o valor de vB calculado seja superior ao valor verdadeiro.
⇒ O valor experimental do módulo da aceleração gravítica,

- será maior do que o valor verdadeiro, o que determina um erro por excesso.
- Opção (A) ……………. 5 pontos
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
- 11ºano – Física – A.l. – 1.1 – Queda livre força gravítica
1.3. No cálculo do módulo da aceleração gravítica, que valor deverá ser considerado para o módulo da velocidade da esfera no instante em que esta se encontra em frente da célula fotoelétrica A?
⇒ Dado que a esfera é abandonada imediatamente acima da célula A e que o módulo da velocidade com que está à frente desta é desprezável em relação ao calculado em B, deve considerar-se esse valor igual a 0 m s–1 .
- 0 (m s-1) ……………. 5 pontos
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
- 11ºano – Física – A.l. – 1.1 – Queda livre força gravítica
2. Numa segunda experiência, variando a distância entre as células A e B, foi possível determinar o módulo da aceleração gravítica a partir do gráfico do quadrado do tempo que a esfera demorou a percorrer a distância entre as células, t2A→B, em função da distância percorrida, Δy.
A partir dos valores obtidos, determinou-se a equação da reta que melhor se ajusta ao conjunto de pontos do gráfico:
t2A→B = 0,198Δy − 0,001 (SI)
Determine o erro percentual (erro relativo, em percentagem) do módulo da aceleração gravítica obtido nesta experiência, tomando como referência o valor 9,8 m s-2.
Apresente todas as etapas de resolução.
- Etapas de resolução:
A) Determinação do módulo da aceleração gravítica obtido na experiência (g = 10,1 m s-2) …….. 5 pontos
B) Determinação do erro percentual do módulo da aceleração gravítica obtido na experiência (3,1%) …….. 5 pontos
GRUPO VI
Considere uma reação química em fase gasosa traduzida pelo esquemaa A (g) + b B (g) ⇋ c C (g)
em que a, b e c são os coeficientes estequiométricos das substâncias A, B e C, respetivamente.1. Admita que, num reator com a capacidade de 1,00 L, se introduziram, à temperatura T, 0,400 mol de A (g) e 0,400 mol de B (g).
- 10ºano – Química – Domínio 1 – subdomínio 1 (Massa e tamanho dos átomos)
1.1. Considere que A e B são substâncias moleculares.
Quantas moléculas foram, no total, inicialmente introduzidas no reator?
(A) 2,41 x 1023
(B) 4,82 x 1023
(C) 1,93 x 1024
(D) 9,63 x 1023
- Opção (B)
⇒ A quantidade de matéria inicialmente introduzidas no reator é de (0,400 + 0,400) = 0,800 mol de moléculas.
⇒ Assim, no reator foram introduzidas:
- N = n x N A = 0,800 x 6,02 x 10 23 = 4,82 x 1023 moléculas
- Opção (B) ……………. 5 pontos
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
1.2. No quadro seguinte, estão registadas as quantidades das substâncias A, B e C que existem no reator, num mesmo estado de equilíbrio do sistema, à temperatura T.
Calcule a constante de equilíbrio, Kc , da reação considerada, à temperatura T.

Comece por determinar os coeficientes estequiométricos a, b e c.
Apresente todas as etapas de resolução.
⇒ Na tabela apresentam-se as quantidades iniciais e finais de A, de B e de C, e as correspondentes variações.

⇒ A proporção das quantidades de A e de B que reagem e a de C que se forma é A : B : C
- 1 ∶ 3 ∶ 2, ou seja, 1 mol de A é estequiometricamente equivalente a 3 mol de B e a 2 mol de C.
⇒ Portanto, a reação pode ser traduzida por:
- A(g) + 3 B(g) ⇌ 2 C(g)
⇒ A constante de equilíbrio desta reação, à temperatura 𝑇, é:

- Etapas de resolução:
A) Cálculo da quantidade de A que reagiu (n = 0,056 mol) …….. 1 pontos
B) Cálculo da quantidade de B que reagiu (n = 0,168 mol) …….. 1 pontos
C) Determinação dos coeficientes estequiométricos (a = 1; b = 3; c = 2 ou equivalente) …….. 4 pontos
D) Cálculo da constante de equilíbrio da reação, à temperatura T …….. 4 pontos
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
2. Admita que a reação considerada ocorre em sistema fechado, sendo a variação de entalpia do sistema negativa.
Conclua, com base no princípio de Le Châtelier, como variará a constante de equilíbrio, Kc , da reação se a temperatura aumentar.
Apresente num texto a fundamentação da conclusão solicitada.
⇒ Um aumento de temperatura desloca o equilíbrio no sentido de contrariar esse aumento, de acordo com o Princípio de Le Châtelier, ou seja, no sentido da reação endotérmica.
⇒ A variação de entalpia associada a esta reação, Δr𝐻, é negativa, o que significa que é exotérmica no sentido direto, o da formação do produto (C):
A(g) + 3 B(g) ⇌ 2 C(g)
⇒ O aumento de temperatura desloca o equilíbrio no sentido da reação inversa, o do consumo de C, diminuindo a concentração de C e aumentando as concentrações de A e de B, no novo estado de equilíbrio a maior temperatura.
⇒ A constante de equilíbrio, 𝐾c, diminui com o aumento da temperatura.
- A resposta integra os tópicos de referência seguintes ou outros de conteúdo equivalente:
A) [De acordo com o princípio de Le Châtelier,] um aumento de temperatura favorece a reação endotérmica.
B) [Uma vez que a variação de entalpia do sistema é negativa,] a reação [direta] é uma reação exotérmica (OU a reação inversa é uma reação endotérmica).
C) Deste modo, se a temperatura aumentar, as concentrações de A e de B aumentarão e a concentração de C diminuirá, pelo que a constante de equilíbrio, Kc , da reação considerada diminuirá.

GRUPO VII
O ácido metanoico, HCOOH (M = 46,03 g mol-1), também conhecido por ácido fórmico, é um ácido monoprótico fraco (a sua constante de acidez é 1,7 x 10-4, a 25 ºC) cuja ionização em água pode ser traduzida por
HCOOH (aq) + H2O (l) ⇋ HCOO− (aq) + H3O+ (aq)
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
1. Quantos eletrões de valência existem, no total, na molécula de ácido metanoico?
⇒ A molécula de ácido metanoico, HCOOH, tem 2 átomos de hidrogénio, 2 de oxigénio e 1 de carbono.
⇒ Estes elementos pertencem aos grupos 1, 16 e 14, respetivamente, e apresentam 1 eletrão de valência o H, 6 o O e 4 o C.
⇒ Nesta molécula existem (2 x 1 + 2 x 6 + 4) = 18 eletrões de valência (a título de exemplo, apresenta-se a estrutura de Lewis desta molécula, onde se pode verificar a existência de 9 pares de eletrões de valência, 5 ligantes e 4 não ligantes).

- 18 eletrões ……………. 5 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
2. Naquela reação, estão envolvidos dois pares conjugados ácido-base, segundo Brönsted-Lowry.
Segundo Brönsted-Lowry, o que é um par conjugado ácido-base?
⇒ Um par conjugado ácido-base são duas espécies que diferem entre si de um protão (ião H+).
ou
⇒ Um par conjugado ácido-base são duas espécies em que uma resulta da outra por perda (ganho) de um protão (ião H+).
- São duas espécies que se convertem uma na outra por perda ou ganho de um protão. …….. 5 pontos
Nota – A resposta «São duas espécies que diferem uma da outra num protão (ou num ião H+)» não implica qualquer desvalorização.
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
3. Admita que quer preparar 250,0 cm3 de uma solução aquosa de ácido metanoico cujo pH, a 25 ºC, deverá ser 3,20.
Calcule a massa de ácido metanoico que terá de ser utilizada para preparar aquela solução.
Apresente todas as etapas de resolução.
⇒ Pela estequiometria da reação e desprezando a contribuição de ião hidrónio proveniente da autoionização da água:
- [HCOO–]e = [ H3O+]e = 10−pH = 10−3,20 = 6,31 x 10−4 mol dm−3
⇒ Através da constante de acidez do ácido metanoico, é possível determinar a concentração de ácido metanoico não ionizado:

⇒ A concentração total (inicial) de ácido metanoico na solução considerada é:

⇒ Num volume de 250,0 cm3 de solução, existe uma quantidade total (inicial) de ácido metanoico:
- n = c x V = 2,97 x 10−3 x 0,2500 = 7,43 x 10−4 mol
⇒ A massa de ácido metanoico que terá de ser utilizada para preparar 250,0 cm3 da solução considerada é:
- m = n x M = 7,43 x 10−4 x 46,03 = 3,4 x 10−2 g
- Etapas de resolução:
A) Cálculo da concentração de ácido ionizado na solução de ácido metanoico (c = 6,31 x 10-4 mol dm-3) …….. 3 pontos
B) Cálculo da concentração de ácido não ionizado na solução de ácido metanoico (c = 2,34 x 10-3 mol dm-3) …….. 4 pontos
C) Cálculo da concentração total de ácido metanoico na solução considerada (c = 2,97 x 10-3 mol dm-3) …….. 4 pontos
D) Cálculo da quantidade total de ácido metanoico que existe em 250,0 cm3 de solução (n = 7,43 x 10-4 mol )
ou
- Cálculo da massa de ácido metanoico que terá de ser utilizada para preparar 1,0 dm3 da solução considerada (m = 1,37 x 10-1 g) …….. 2 pontos
E) Cálculo da massa de ácido metanoico que terá de ser utilizada para preparar 250,0 cm3 da solução considerada (m = 3,4 x 10-2 g) …….. 2 pontos
ou
A) Cálculo da concentração de ácido ionizado na solução de ácido metanoico (c = 6,31 x 10-4 mol dm-3) …….. 3 pontos
B) Cálculo da concentração de ácido não ionizado na solução de ácido metanoico (c = 2,34 x 10-3 mol dm-3) …….. 4 pontos
C) Cálculo da quantidade de ácido ionizado que existe em 250,0 cm3 de solução (n = 1,58 x 10-4 mol) e cálculo da quantidade de ácido não ionizado que existe em 250,0 cm3 de solução (n = 5,85 x 10-4 mol ) …….. 2 pontos
D) Cálculo da quantidade total de ácido metanoico que existe em 250,0 cm3 de solução (n = 7,43 x 10-4 mol ) ……… 4 pontos
E) Cálculo da massa de ácido metanoico que terá de ser utilizada para preparar 250,0 cm3 da solução considerada (n = 3,4 x 10-2 g) …….. 2 pontos
FIM