2018 – 1ª Fase – Prova Escrita de FQ A
Voltar a: Física e Química
- Prova Escrita de Física e Química A – versão 1
- Prova 715: 1.ª Fase – 2018
GRUPO I
Em cada local da Terra, a energia solar disponível depende, entre outros fatores, da estação do ano e das condições meteorológicas.
1. A Figura 1 representa um sistema de aquecimento de água, constituído por um depósito, um coletor solar plano com cobertura de vidro e um fluido que circula num circuito fechado, por convecção natural.

Este fluido transfere energia, como calor, para a água contida no depósito.
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
1.1. Considere que existe uma diferença significativa entre a temperatura da água que se encontra na parte inferior do depósito e a temperatura da água que se encontra na parte superior.
Compare a massa volúmica da água que se encontra na parte inferior do depósito com a massa volúmica da água que se encontra na parte superior.
⇒ A massa volúmica da água que se encontra na parte inferior do depósito é maior do que a massa volúmica da água na parte superior.
⇒ A água fria entra na parte inferior do depósito e recebe energia do fluido que circula no tubo ligado ao coletor solar; à medida que a água aquece torna-se menos densa e forma uma corrente ascendente.
⇒ Devido a este mecanismo, na parte superior do depósito a água encontra-se a uma temperatura mais elevada e, por isso, tem uma massa volúmica menor do que na parte inferior.
⇒ A massa volúmica da água na parte inferior do depósito é maior do que a massa volúmica da água na parte superior. …………. 6 pontos
1.2. A cobertura de vidro do coletor solar é _____ à radiação visível incidente e ____ à maior parte da radiação infravermelha emitida no interior do coletor, o que contribui para o aumento da temperatura no interior do coletor.
(A) transparente … opaca
(B) opaca … transparente
(C) transparente … transparente
(D) opaca … opaca
*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
- Opção (A)
⇒ Pretende-se que a cobertura do coletor solar seja totalmente transparente à radiação visível, para se deixar atravessar na totalidade por este tipo e radiação, e opaca à radiação infravermelha, para que este tipo de radiação permaneça no interior do coletor para provocar um maior aumento de temperatura no interior do coletor.
- Opção (A) ……………. 6 pontos
2. Um depósito com 120 kg de água está ligado a um coletor plano de área 4,0 m2, que está exposto à radiação solar, em média, durante 8,0 h por dia.
Nas condições de exposição, a potência média da radiação solar incidente por unidade de área é 5,1 x 102 W m-2 .
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
2.1. A grandeza potência por unidade de área pode também ser expressa em
(A) kW h m-2
(B) kJ s-1 m-2
(C) kJ s m-2
(D) kW h-1 m-2
- Opção (B) ……………. 6 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
2.2. A temperatura da água contida no depósito aumenta, em média, 35 ºC, ao fim das 8,0 h diárias de exposição do coletor à radiação solar.
Determine o rendimento médio do processo de aquecimento considerado.
Apresente todas as etapas de resolução.
⇒ A potência média da radiação solar incidente no coletor obtém-se multiplicando a potência média por unidade de área pela área do coletor:
- P = 5,1 x 102 x 4,0 = 2,04 x 103 W
⇒ Durante as 8,0 h diárias de exposição solar, a energia da radiação solar que, em média, incide no coletor é dada por
- Eincidente = P x Δt = 2,04 x 103 x 8,0 x 3600 = 5,88 x 107 J
⇒ Neste mesmo intervalo de tempo, a temperatura da água contida no depósito aumenta em média, ΔT = 35ºC = 35 K, logo, essa agua absorve, em média, a energia
- Eabsorvida = m c ΔT = 120 x 4,18 x 103 x 35 = 1,76 x 107 J
⇒ O rendimento do processo de aquecimento, η, é dado por

- Etapas de resolução:
⇒ Cálculo da potência média da radiação solar incidente no coletor (P = 2,04 x 103 W) …….. 2 pontos
⇒ Cálculo da energia da radiação solar que, em média, incide no coletor em 8,0 h diárias de exposição solar (E = 5,88 x 107 J) …….. 2 pontos
⇒ Cálculo da energia que, em média, é absorvida pela água em 8,0 h diárias de exposição solar (E = 1,76 x 107 J) …….. 3 pontos
⇒ Cálculo do rendimento médio do processo de aquecimento considerado (h = 30%) …….. 3 pontos
ou
⇒ Cálculo da potência média da radiação solar incidente no coletor (P = 2,04 x 103 W) …….. 2 pontos
⇒ Cálculo da energia que, em média, é absorvida pela água em 8,0 h diárias de exposição solar (E = 1,76 x 107 J) …….. 3 pontos
⇒ Cálculo da potência média absorvida pela água (P = 6,11 x 102 W) …….. 2 pontos
⇒ Cálculo do rendimento médio do processo de aquecimento considerado (h = 30%) …….. 3 pontos
GRUPO II
1. Uma esfera, largada de uma certa altura, cai verticalmente até atingir o solo.
Na Figura 2, apresenta-se um esboço do gráfico do módulo da velocidade, v, dessa esfera, em função do tempo, t, desde o instante em que a esfera é largada até atingir o solo.

Considere que a esfera pode ser representada pelo seu centro de massa (modelo da partícula material).
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
1.1. Qual das opções pode representar a velocidade, v , e a aceleração, a, da esfera, num dado instante, durante a queda?

- Opção (D)
⇒ A velocidade da esfera tem a direção e sentido do movimento, vertical de cima para baixo.
⇒ O módulo da velocidade aumenta com o tempo, a aceleração tem a mesma direção e sentido da velocidade.
- Opção (D) ……………. 6 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
1.2. Conclua se a variação de energia cinética da esfera entre a posição em que é largada e o solo é maior, menor ou igual ao trabalho realizado pela força gravítica que nela atua, nesse deslocamento.
Apresente, num texto estruturado e com linguagem científica adequada, a fundamentação da conclusão solicitada.
A Figura 2 mostra que a variação do módulo da velocidade da esfera por unidade de tempo não é constante: mantém-se sempre positiva, mas vai sendo cada vez menor.
Isto significa que o módulo da aceleração da esfera, a, é inferior ao módulo da aceleração gravítica, g, ou seja, a força de resistência do ar, Rar, tem um efeito que não é desprezável.
A variação da energia cinética da esfera no deslocamento considerado e igual à soma do trabalhos realizados pela força gravítica, WFg, e pela força de resistência do ar. WRar, que atuam na esfera:
- ΔEc = WFg + WRar
Como o trabalho realizado pela força de resistência do ar é negativo, conclui-se que a variação da energia cinética da esfera entre a posição em que é largada e o solo é menor do que o trabalho realizado pela força gravítica que atua sobre ela nesse deslocamento.
ou
(A) O módulo da velocidade da esfera não varia linearmente com o tempo (ou equivalente), o que permite concluir que a força de resistência do ar não é desprezável.
(B) No deslocamento considerado, a soma dos trabalhos realizados pela força gravítica e pela força de resistência do ar, que atuam na esfera é menor do que o trabalho realizado pela força gravítica, uma vez que o trabalho realizado pela força de resistência do ar é negativo.
(C) Como a soma dos trabalhos realizados pelas forças que atuam na esfera é igual a variação de energia cinética da esfera, conclui-se que, nesse deslocamento, a variação de energia cinética da esfera é menor do que O trabalho realizado pela força gravítica que nela atua.
ou
(A) O módulo da velocidade da esfera não varia linearmente com o tempo (ou equivalente), o que concluir que a força de resistência do ar não é desprezável.
(B) A força de resistência do ar e força gravítica que atuam na esfera têm sentidos opostos, pelo que a resultante das forças que atuam na esfera terá uma intensidade menor do que a intensidade da força gravítica.
(C) Como o trabalho que seria realizado pela resultante das forças que atuam na esfera é igual à variação de energia cinética da esfera, conclui-se que, nesse deslocamento, a variação de energia cinética da esfera é menor do que o trabalho realizado pela força gravítica que nela atua.
ou
(A) No deslocamento considerado, o aumento do módulo da velocidade da esfera é inferior ao que ocorreria se houvesse conservação da energia mecânica do sistema esfera+ Terra.
(B) No deslocamento considerado, o aumento da energia cinética da esfera é inferior à diminuição da energia potencial gravítica do sistema esfera + Terra.
(C) Como a variação da energia potencial gravítica do sistema é simétrica do trabalho realizado pela força gravítica que atua na esfera, conclui-se que, nesse deslocamento, a variação de energia cinética da esfera é menor do que o trabalho realizado pela força gravítica que nela atua.
- Tópicos de resposta:
A) O módulo da velocidade da esfera não varia linearmente com o tempo (ou equivalente), o que permite concluir que a força de resistência do ar não é desprezável.
B) No deslocamento considerado, a soma dos trabalhos realizados pela força gravítica e pela força de resistência do ar, que atuam na esfera, é menor do que o trabalho realizado pela força gravítica, uma vez que o trabalho realizado pela força de resistência do ar é negativo.
C) Como a soma dos trabalhos realizados pelas forças que atuam na esfera é igual à variação de energia cinética da esfera, conclui-se que, nesse deslocamento, a variação de energia cinética da esfera é menor do que o trabalho realizado pela força gravítica que nela atua.
ou
A) O módulo da velocidade da esfera não varia linearmente com o tempo (ou equivalente), o que permite concluir que a força de resistência do ar não é desprezável.
B) A força de resistência do ar e a força gravítica que atuam na esfera têm sentidos opostos, pelo que a resultante das forças que atuam na esfera terá uma intensidade menor do que a intensidade da força gravítica.
C) Como o trabalho que seria realizado pela resultante das forças que atuam na esfera é igual à variação de energia cinética da esfera, conclui-se que, nesse deslocamento, a variação de energia cinética da esfera é menor do que o trabalho realizado pela força gravítica que nela atua.
ou
A) O módulo da velocidade da esfera não varia linearmente com o tempo (ou equivalente), o que permite concluir que a força de resistência do ar não é desprezável. No deslocamento considerado, o aumento do módulo da velocidade da esfera é inferior ao que ocorreria se houvesse conservação da energia mecânica do sistema esfera + Terra.
B) No deslocamento considerado, o aumento da energia cinética da esfera é inferior à diminuição da energia potencial gravítica do sistema esfera + Terra.
C) Como a variação da energia potencial gravítica do sistema é simétrica do trabalho realizado pela força gravítica que atua na esfera, conclui-se que, nesse deslocamento, a variação de energia cinética da esfera é menor do que o trabalho realizado pela força gravítica que nela atua.
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
1.3. Considere o solo como nível de referência da energia potencial gravítica.
Qual das opções pode representar um esboço dos gráficos da energia cinética, Ec , da esfera e da energia potencial gravítica, Epg , do sistema esfera + Terra, em função da altura, h, a que a esfera se encontra do solo?

- Opção (A)
⇒ Como se trata de um sistema não conservativo, a variação da energia cinética e a variação da energia potencial gravítica não são simétricas.
⇒ A resistência do ar não é desprezável, por isso, a variação da energia cinética vai ser menor que a variação da energia potencial gravítica, uma vez que esta é uma força dissipativa.
ou
⇒ A energia cinética da esfera, dada por Ec = ½ m v2, é nula no ponto de onde a esfera é largada e tem um valor diferente de zero quando a esfera chega ao solo.
⇒ A energia potencial gravítica, Epg, do sistema esfera + Terra varia linearmente com a altura h em relação ao solo, Epg = m g h.
⇒ Não existe conservação da energia mecânica devido ao efeito da resistência do ar, a energia final (em h = 0) é inferior à energia potencial inicial (no ponto de queda).
- Opção (A) ……………. 6 pontos
2. Uma outra esfera é largada de uma altura de 50 m.
Considere que a esfera pode ser representada pelo seu centro de massa (modelo da partícula material) e considere o solo como nível de referência da energia potencial gravítica.
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
2.1. Se a força de resistência do ar que atua na esfera durante a queda for desprezável, qual é, em cada segundo, o aumento do módulo da velocidade da esfera?
- O aumento do módulo da velocidade da esfera, em cada segundo, é 10 ms-1.
⇒ O aumento do módulo da velocidade da esfera por unidade de tempo é o módulo da aceleração da esfera.
⇒ Se a força de resistência do ar for desprezável, a única força a atual na esfera é a força gravítica, Fg, que lhe comunica a aceleração gravítica, g.
⇒ O módulo da aceleração gravítica é g = 10 m s-2 = 10 m s-1/s, o que significa que, em cada segundo, o módulo da velocidade aumenta 10 m s-1.
- 10 m s-1 (ou 9,8 m s-1) …………….. 6 pontos
2.2. A força de resistência do ar que atua na esfera durante a queda não é, contudo, desprezável.
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
- 10ºano – Física – A.l. – 1.2 – Movimento vertical de queda e ressalto de uma bola
2.2.1. Se a esfera chegar ao solo com velocidade de módulo 26 m s-1 , a fração de energia dissipada na queda será
(A) 0,68
(B) 0,48
(C) 0,32
(D) 0,52
- Opção (C) ……………. 6 pontos
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
2.2.2. Num dado instante, o módulo da aceleração da esfera é 6,0 m s-2 .
Nesse instante, a intensidade da força de resistência do ar que atua na esfera é _x_ % da intensidade da força gravítica que nela atua.
Determine o valor de x.
Apresente todas as etapas de resolução.
⇒ A Lei Fundamental da Dinâmica para o movimento da esfera é, Fg + Rar = ma; a componente escalar desta equação na direção do movimento escreve -se:
- Fg – Rar = ma ⇔ 10,0 m – Rar = 6,0 m ⇔ Rar = 4,0 m
⇒ A razão entre a intensidade da força de resistência do ar e a intensidade da força gravítica é:

- no instante considerado, Rar vale 40% de Fg, logo, x = 40.
- Etapas de resolução:
⇒ Apresentação da expressão Fg – Far = 6,0 m (ou equivalente), em que Fg representa a intensidade da força gravítica, Far representa a intensidade da força de resistência do ar e m representa a massa da esfera …….. 4 pontos
⇒ Determinação da intensidade da força de resistência do ar que atua na esfera em função da sua massa (Far = 4,0m) …….. 3 pontos
⇒ Determinação do valor de x (x = 40) (ver nota) …….. 3 pontos
Nota ‒ A apresentação do valor x = 0,40 implica uma desvalorização de 1 ponto.
GRUPO III
1. Quando um sinal sonoro se propaga no ar, há variações de pressão em cada ponto.
- 11ºano – Física – Domínio 2 – subdomínio 1 (Sinais e ondas)
1.1. Na Figura 3, está representada, num certo instante, uma determinada região do espaço em que se propaga, da esquerda para a direita, um sinal sonoro de período T .
As zonas mais escuras correspondem a zonas de compressão do ar, e as zonas mais claras correspondem a zonas de rarefação.
Na figura, encontra-se ainda representada, pela linha a tracejado, P, uma certa camada de ar naquela região do espaço.

Qual das figuras seguintes pode representar, um período e meio depois, a mesma região do espaço e a mesma camada de ar?

- Opção (A)
⇒ Nas ondas sonoras, as camadas de ar oscilam em torno das suas posições de equilíbrio, originando zonas de compressão e zonas de rarefação do ar.
⇒ Ocorre transferência de energia de umas camadas para as outras, mas não há transporte de matéria, ou seja, cada camada de ar permanece na sua posição média no espaço.
⇒ A Figura 3 mostra que a camada de ar identificada pela linha P corresponde a uma zona de compre são do ar, situação esta que volta a verificar-se após qualquer número inteiro de períodos, T, 2 T, etc.
⇒ Entre duas situações consecutivas de compressão, a camada de ar passa por uma situação de rarefação.
⇒ Quando tiver decorrido um período e meio, a camada de ar P já terá passado por uma nova situação de compressão e estará numa situação de rarefação.
- Opção (A) ……………. 6 pontos
- 11ºano – Física – Domínio 2 – subdomínio 1 (Sinais e ondas)
1.2. Um sinal sonoro foi convertido num sinal elétrico e analisado num osciloscópio, cuja base de tempo estava regulada para 0,5 ms por divisão.
Na Figura 4, está representada a imagem obtida no ecrã do osciloscópio.

Verificou-se experimentalmente que, em determinadas condições, um pulso do mesmo som demorava 5,78 x 10-2 s a percorrer uma distância de 20,0 m no ar.
Determine o comprimento de onda do som no ar, naquelas condições.
Apresente todas as etapas de resolução.
- Etapas de resolução:
⇒ Determinação do período do sinal sonoro (T = 1,50 ms ) …….. 3 pontos
⇒ Determinação do módulo da velocidade de propagação do sinal no ar, nas condições em que decorreu a experiência (v = 346,0 m s-1) …….. 3 pontos
⇒ Cálculo do comprimento de onda do som no ar, nas condições em que decorreu a experiência (λ = 0,52 m) …….. 4 pontos
2. Considere um feixe muito fino de luz laser (radiação monocromática), que se propaga inicialmente num vidro e que incide na superfície de separação vidro-ar.
Para a luz laser considerada, o índice de refração desse vidro é 1,51.
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
2.1. Quando o feixe de luz laser passa do vidro para o ar, mantêm-se constantes o ____ e a ____ da radiação.
(A) comprimento de onda … frequência
(B) comprimento de onda … velocidade de propagação
(C) período … frequência
(D) período … velocidade de propagação
- Opção (C)
⇒ O período e, consequentemente, a frequência de uma onda não dependem do meio de propagação, dependem apenas da fonte emissora.
ou
⇒ O período, T , e a frequência, f = 1/T, do feixe de luz laser (onda eletromagnética) mantém-se constantes, uma vez que só dependem das características da fonte emissora e não do meio em que se propagam.
⇒ A velocidade de propagação da luz, v, depende do meio em que se propaga e o mesmo se verifica com o comprimento de onda, λ, da radiação de uma frequência, uma vez que depende da velocidade de propagação.
- Opção (C) ……………. 6 pontos
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
2.2. Nos esquemas seguintes, está representado o trajeto do feixe que incide na superfície de separação vidro-ar, segundo um ângulo de incidência de amplitude 30o.
Em qual dos esquemas estão representados os trajetos dos feixes refletido e refratado na superfície de separação vidro-ar?

- Opção (D)

ou
⇒ Na superfície de separação vidro-ar uma parte do feixe é refletida e a outra sofre refração continuando a propagar-se no segundo meio (o ar).
⇒ De acordo com as leis da reflexão da luz, a amplitude do ângulo de reflexão é igual à amplitude do ângulo de incidência: assim, o feixe refletido deve ter uma direção que faz um ângulo de amplitude 30º com a normal à superfície no ponto d incidência.
- A direção do feixe refratado obtém-se usando a lei de Snell-Descartes.
⇒ Designando por αi e por αr a amplitude dos ângulos de incidência e de refração, respetivamente, e por n o índice refração, teremos, para este caso:

⇒ A direção do feixe refratado faz um ângulo de amplitude 49º com a direção normal à superfície no ponto de incidência.
⇒ O ângulo entre a direção do feixe refratado e a superfície de separação dos dois meios é o complementar, de amplitude 41º.
- Opção (D) ……………. 6 pontos
GRUPO IV
A densidade relativa de um metal foi determinada experimentalmente por picnometria de sólidos.
O procedimento experimental incluiu as pesagens A, B e C, efetuadas a 20 ºC, que estão representadas na Figura 5.

Fez-se a tara da balança, de modo a descontar a massa do vidro de relógio nas pesagens A e B.
- 10ºano – Química – Domínio 1 – subdomínio 3 (Tabela periódica)
- 10ºano – Química – A.l. – 1.3 – Densidade relativa de metais
- 11ºano – Física – A.l. – Medições
- ± 0,001 g
⇒ A incerteza de leitura da balança é 1 mg (0,001 g).
⇒ A incerteza de leitura em instrumentos digitais pode ser estimada por uma unidade do algarismo de menor valor posicional, neste caso, uma milésima grama.
- 0,001 g (ou equivalente) …….. 6 pontos
- 10ºano – Química – Domínio 1 – subdomínio 3 (Tabela periódica)
- 10ºano – Química – A.l. – 1.3 – Densidade relativa de metais
2. Explique como se pode obter a densidade relativa do metal constituinte da amostra a partir das determinações efetuadas (mA, mB e mC).
Apresente, num texto estruturado e com linguagem científica adequada, a explicação solicitada. No texto, deverá incluir a definição de densidade relativa de um metal.
(A) A densidade relativa do metal constituinte da amostra pode ser determinada pelo quociente entre a massa da amostra do metal (mA) e uma massa de água de volume igual ao volume daquela amostra.
(B) A massa de água de volume igual ao volume da amostra do metal (ou a massa de água deslocada) é dada pela diferença mB – mC.
ou
⇒ A densidade relativa de um metal é o quociente da massa volúmica desse metal por uma massa volúmica de referência, a da água a 4 ºC, traduzindo quantas vezes um dado volume de metal é mais pesado do que o mesmo volume de água líquida (desprezar a variação da densidade da água com a temperatura é uma boa aproximação).
⇒ Considerando volumes do metal e da água, a densidade relativa do metal pode ser determinada pelo quociente da massa do metal pela massa de água: este é o fundamento da picnometria de sólidos.
⇒ A diferença entre o volume de água em B e o volume de água em C é igual ao volume ocupado pela amostra do metal, dado que em C o metal está dentro do picnómetro.
⇒ Como em B e em C estão a mesma amostra do metal e o mesmo picnómetro, a diferença entre mB e mC é igual à massa de uma porção de água de volume igual ao volume da amostra do metal.
⇒ A densidade relativa do metal, d, é igual ao quociente da massa da amostra do metal, mA, pela massa de água de volume igual ao da amostra do metal, mB – mC:

- Tópicos de resposta:
A) A densidade relativa do metal constituinte da amostra pode ser determinada pelo quociente entre a massa da amostra do metal (mA) e uma massa de água de volume igual ao volume daquela amostra.
B) A massa de água de volume igual ao volume da amostra do metal (ou a massa de água deslocada) é dada pela diferença mB – mC.
- 10ºano – Química – Domínio 1 – subdomínio 3 (Tabela periódica)
- 10ºano – Química – A.l. – 1.3 – Densidade relativa de metais
3. O valor da densidade relativa do metal constituinte da amostra, obtido experimentalmente, foi 12,4.
O valor tabelado da densidade relativa desse metal é 11,3 (a 20 ºC).
Qual das expressões seguintes permite calcular o erro percentual (erro relativo, em percentagem) que afeta o valor experimental da densidade relativa do metal constituinte da amostra?

- Opção (C) ……………. 6 pontos
GRUPO V
A formação de SO3 ( g ), um dos reagentes utilizados na última etapa da preparação industrial do ácido sulfúrico, pode ser traduzida por
2 SO2 (g) + O2 (g) ⇋ 2 SO3 (g) ΔH < 0
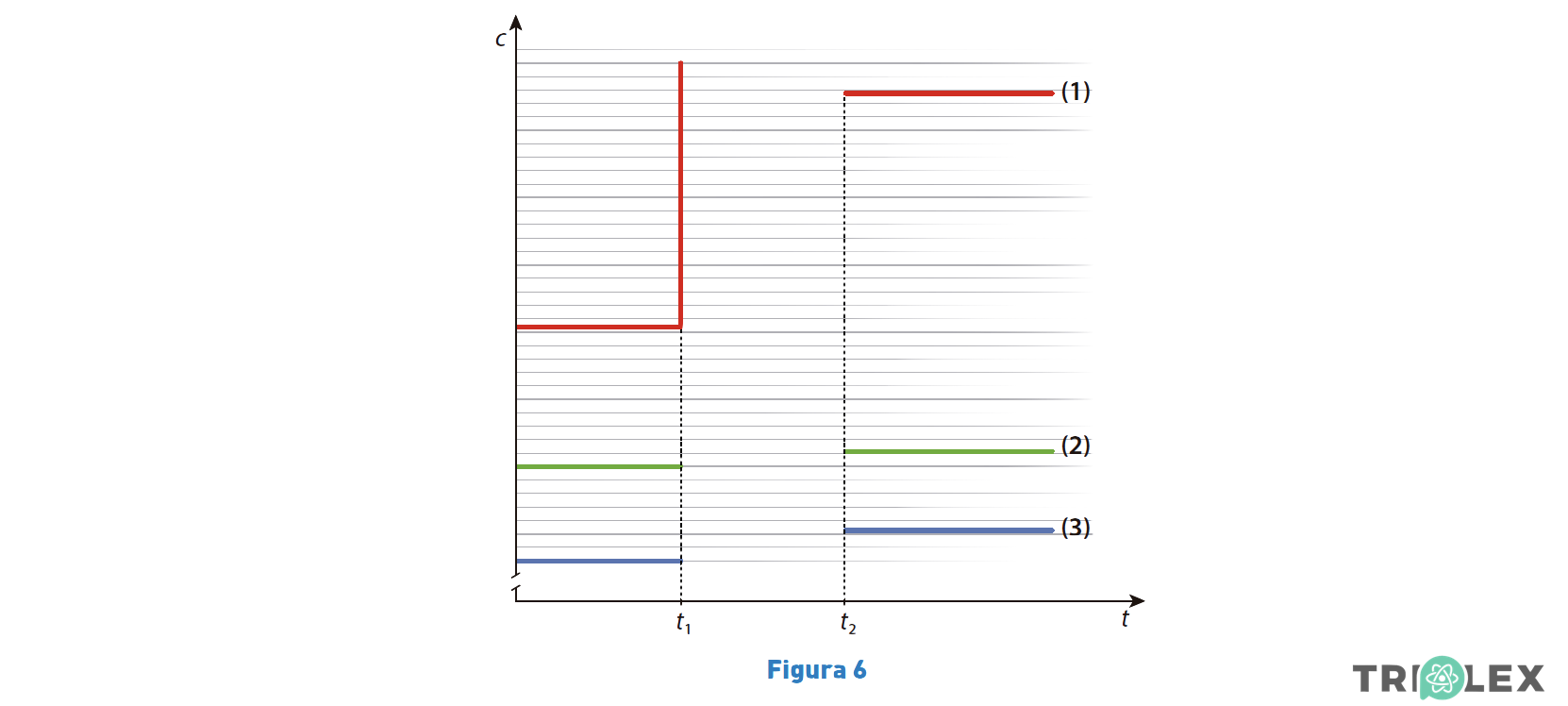
1. Na Figura 6, apresenta-se parte de um gráfico das concentrações, c , das três espécies envolvidas na reação considerada, a volume constante, em função do tempo, t.
O sistema, inicialmente em equilíbrio, sofre uma perturbação no instante t1, atingindo um novo estado de equilíbrio no instante t2.
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
1.1. O gráfico permite concluir que, no instante t1,
(A) se removeu uma certa quantidade de um dos componentes do sistema.
(B) se introduziu uma certa quantidade de um dos componentes do sistema.
(C) se provocou um aumento da temperatura do sistema.
(D) se provocou uma diminuição da pressão do sistema.
- Opção (B)
⇒ A partir do gráfico observa-se que a espécie correspondente à linha (1) teve um aumento brusco de concentração em t1.
⇒ Após esse aumento brusco, a concentração dessa espécie diminuiu e as espécies correspondentes às linhas (2) e (3) aumentaram a sua concentração.
- Opção (B) ……………. 6 pontos
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
1.2. O gráfico permite concluir que a curva ___ corresponde ao SO2 (g) e que, no intervalo de tempo [t1, t2 ], é favorecida a reação ____ .
(A) (2) … direta
(B) (2) … inversa
(C) (3) … direta
(D) (3) … inversa
- Opção (D)
⇒ De acordo com princípio de Le Châtelier, quando um sistema químico em equilíbrio é sujeito a uma perturbação (de temperatura, pressão ou concentração), evolui de modo a contrariar a perturbação que lhe foi imposta até atingir um novo estado de equilíbrio.
⇒ Neste caso, verificou-se um aumento da concentração da espécie corresponde a (1).
⇒ Após a perturbação, no novo estado de equilíbrio; a concentração de (1) diminuiu; as concentrações de (2) e (3) aumentaram.
- Na reação direta, forma-se uma única espécie, SO3.
⇒ Na reação inversa, formam-se duas espécies, SO2 e O2. Desta forma, favoreceu-se a reação inversa, que contrariou o aumento da espécie (1) e levou a um aumento da concentração das espécies (2) e (3). As variações das concentrações das espécies (3) e (2) estão na relação de 2 para 1, tal como os coeficientes estequiométricos nos reagentes SO2 e O2.
⇒ A variação das concentrações da espécie (1) é de 2 unidades, na mesma escala, consistente com o coeficiente estequiométrico de SO3.
⇒ As curvas (1), (2) e (3) dizem respeito, respetivamente, às espécies SO3, O2 e SO2.
- Opção (D) ……………. 6 pontos
2. Uma mistura de SO2 (g), O2 (g) e SO3 (g), em equilíbrio, está contida num recipiente fechado de volume variável, a uma temperatura T.
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
2.1. Introduziram-se inicialmente nesse recipiente 160,15 g de SO2 (g) (M = 64,06 g mol-1) e uma certa massa de O2 (g).
Verificou-se que, mantendo o volume do recipiente igual a 2,00 dm3, a concentração de SO3 (g), na mistura em equilíbrio, era 0,909 mol dm-3 .
Determine a percentagem de SO2 (g) que não se converteu em SO3 (g).
Apresente todas as etapas de resolução.

ou
⇒ A quantidade de SO3 (g) na mistura em equilíbrio é:
- n = c V = 0,909 x 2,00 = 1,818 mol
⇒ De acordo com a equação, 2 mol de SO2 originam 2 mol de SO3, logo, a formação de 1,818 mol de SO3 resultou da reação de 1,818 mol de SO2.
A massa de SO2 que reagiu foi:
- m = n M = 1,818 x 64,06 = 116,46 g
⇒ A fração de SO2 que não se converteu em SO3 foi a fração de SO2 que não reagiu:

- em percentagem 0,273 x 100 % = 27,3 %
- Etapas de resolução:
⇒ Cálculo da quantidade de SO2 (g) introduzida no recipiente (n = 2,500 mol) …….. 2 pontos
⇒ Cálculo da quantidade de SO3 (g) presente no equilíbrio (n = 1,818 mol) …….. 2 pontos
⇒ Identificação da quantidade de SO2 (g) que se converteu em SO3 (g) com a quantidade de SO3 (g) presente no equilíbrio …….. 2 pontos
⇒ Cálculo da percentagem de SO2 (g) que não se converteu em SO3 (g) (27,3%) …….. 4 pontos
ou
⇒ Cálculo da quantidade de SO3 (g) presente no equilíbrio (n = 1,818 mol) …….. 2 pontos
⇒ Cálculo da massa de SO2 (g) que se converteu em SO3 (g) (m = 116,5 g) …….. 4 pontos
⇒ Cálculo da percentagem de SO2 (g) que não se converteu em SO3 (g) (27,3%) …….. 4 pontos
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
2.2. Para alterar a percentagem de conversão de SO2 (g) em SO3 (g), pode-se variar a temperatura do sistema, a pressão constante, ou variar o volume do recipiente, a temperatura constante.
Para aumentar a percentagem de conversão de SO2 (g) em SO3 (g), dever-se-á, naquelas condições, ____ a temperatura do sistema ou ____ o volume do recipiente.
(A) aumentar … aumentar
(B) aumentar … diminuir
(C) diminuir … aumentar
(D) diminuir … diminuir
- Opção (D)
⇒ Para aumentar a percentagem de conversão de SO2 em SO3 é necessário favorecer a reação de formação de SO3 (g), a reação direta.
⇒ Como a variação de entalpia da reação é negativa, a reação direta é exotérmica.
⇒ De acordo com o Princípio de Le Chátelier, uma reação é exotérmica é favorecida por diminuição da temperatura.
⇒ Na reação direta, por cada 3 mol de reagentes que reagem formam-se 2 mol de produtos, ocorrendo, assim, uma diminuição do número total de moléculas no sistema e, em consequência, uma diminuição da pressão.
⇒ Para favorecer a reação direta é necessário diminuir o volume do sistema, pois desse modo a pressão aumenta, e o sistema, de acordo com o Principio de Le Châtelier, evoluirá no sentido em que a pressão diminui, o sentido da reação direta.
- Opção (D) ……………. 6 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
3. Considere uma amostra de 10 cm3 de uma qualquer mistura de SO2 (g), O2 (g) e SO3 (g), nas condições normais de pressão e de temperatura (PTN).
O número total de moléculas na amostra é
(A) 2,7 x 1023
(B) 2,7 x 1020
(C) 1,3 x 1027
(D) 1,3 x 1024
- Opção (B)

ou
Para gases ideais, o número total de moléculas por unidade de volume depende apenas das condições de pressão e temperatura.
- Nas condições PTN, o volume molar de uma gás ideal é 22,4 dm3 mol-1.
⇒ Como em 22,4 dm3 há 6,02 x 1023 moléculas, 10 cm3 = 10 x 10-3 dm3 haverá 2,7 x 1020 moléculas.
- Opção (B) ……………. 6 pontos
GRUPO VI
O ácido clorídrico, HCl ( aq ), é um ácido forte e o ácido acético, CH3COOH ( aq ), é um ácido fraco.
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
1. Considere duas soluções, uma de ácido clorídrico e outra de ácido acético, com o mesmo pH, a 25 ºC.
Pode-se concluir que
(A) as duas soluções têm a mesma concentração.
(B) a concentração da solução de ácido clorídrico é inferior à concentração da solução de ácido acético.
(C) a concentração da solução de ácido clorídrico é superior à concentração da solução de ácido acético.
(D) as duas soluções têm a mesma quantidade de ácido dissolvido.
- Opção (B)
⇒ As duas soluções apresentam o mesmo valor de pH, por isso, têm a mesma concentração de iões H3O+.
⇒ O HCl (aq), como é um ácido forte, não necessita de ser tão concentrado quanto o ácido acético, CH3COOH (aq), que é um ácido fraco, uma vez que, o ácido mais forte origina maior concentração desses iões quando comparado com o ácido mais fraco.
ou
⇒ O mesmo pH significa a mesma concentração de iões H3O+ (aq). A concentração de H3O+ (aq) na solução aumenta coma concentração do ácido e com a extensão de ionização.
⇒ Como o HCl (aq), ácido forte, se ioniza completamente e o CH3COOH (aq), ácido fraco, se ioniza parcialmente, a mesma concentração de H3O+ (aq) implica que o ácido que se ioniza mais extensamente, o HCl (aq), tenha menor concentração.
- Opção (B) ……………. 6 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
2. Uma solução I de HCl ( aq ) tem uma concentração que é o dobro da concentração de uma solução II, do mesmo ácido.
Uma amostra da solução I e uma amostra da solução II, de igual volume, foram tituladas com NaOH (aq ), de concentrações, respetivamente, cB e 4 cB.
Considere que VBI e VBII são os volumes de titulante gastos, respetivamente, até ao ponto de equivalência da titulação da amostra da solução I e até ao ponto de equivalência da titulação da amostra da solução II.
Qual é a relação entre VBI e VBII?

- Opção (C) ……………. 6 pontos
3. O vinagre é uma solução aquosa de ácido acético que contém também vestígios de outros componentes.
O grau de acidez de um vinagre pode ser expresso pela massa de ácido acético, em gramas, dissolvido em 100 cm3 do vinagre.
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
3.1. A concentração de ácido acético num determinado vinagre comercial é 1,3 mol dm-3 .
Determine o grau de acidez desse vinagre comercial.
Apresente todas as etapas de resolução.
- Vvinagre = 100 cm3
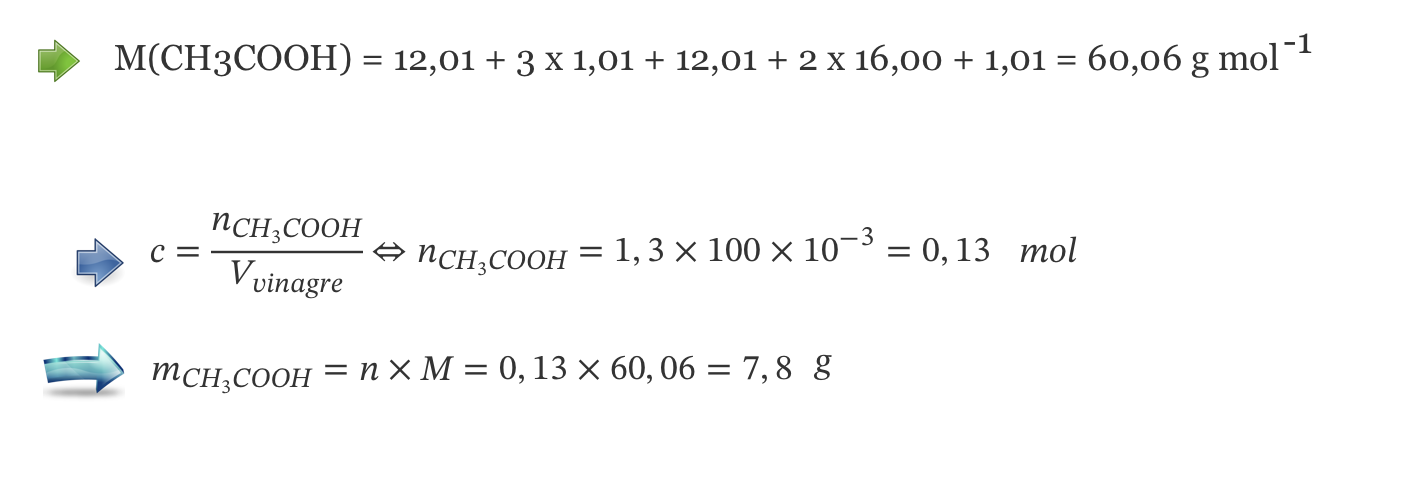
- Grau de acidez = 7,8 g de ácido acético em 100 cm3 de vinagre.
ou
A massa molar do ácido acético, CH3COOH, é
- M(C2H4O2) = (2 x 12,01 + 4 x 1,01 + 2 x 16,00) = 60,06 g mol-1
A concentração de ácido acético no vinagre considerado é 1,3 mol dm-3 o que significa que em cada dm3 de vinagre existe 1,3 mol de ácido, logo, uma massa de ácido
- m = n M = 1,3 x 60,06 = 78,1 g
A massa de ácido acético em 100 cm3 de vinagre comparada com a massa em 1 dm3 = 1000 cm3 de vinagre é 1000/100 = 10 vezes menor, portanto 78,1/10 = 7,8 g.
- O grau de acidez do vinagre considerado é 7,8°.
- Etapas de resolução:
⇒ Cálculo da concentração em massa de ácido acético no vinagre comercial (cm = 78,1 g dm-3)
ou
- Cálculo da quantidade de ácido acético em 100 cm3 do vinagre comercial ( n = 0,130 mol) …….. 5 pontos
⇒ Determinação do grau de acidez do vinagre comercial (7,8o ou 7,8 g em 100 cm3) (ver nota) …….. 5 pontos
Nota ‒ A não indicação da unidade ( o ou g em 100 cm3) não implica qualquer desvalorização.
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
3.2. Para determinar a percentagem, em massa, de ácido acético num vinagre, a partir do grau de acidez desse vinagre, tem ainda de ser conhecida
(A) a massa volúmica do vinagre.
(B) a massa molar da água.
(C) a massa molar do ácido acético.
(D) a massa de ácido acético em 100 cm3 do vinagre.
- Opção (A) ……………. 6 pontos
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
4. A molécula de CH3COOH pode ser representada através da notação de Lewis por
Quantos eletrões de valência ligantes existem, no total, na molécula?
(A) 16
(B) 8
(C) 24
(D) 12
- Opção (A)
⇒ Os electrões de valência ligantes são os representados por traços.
⇒ Na molécula estão representados 8 traços, como cada traço representa 2 eletrões, tal significa que esta molécula tem 8 x 2 = 16 eletrões de valência ligantes.
- Opção (A) ……………. 6 pontos
- 11ºano – Química – Domínio 2 – subdomínio 3 (Soluções e equilíbrio de solubilidade)
5. O acetato de prata é um sal que pode ser sintetizado através da reação de ácido acético puro com uma solução aquosa de nitrato de prata.
Na tabela seguinte, estão registados os valores da solubilidade do acetato de prata, em gramas de sal por 100 g de água, a diferentes temperaturas.
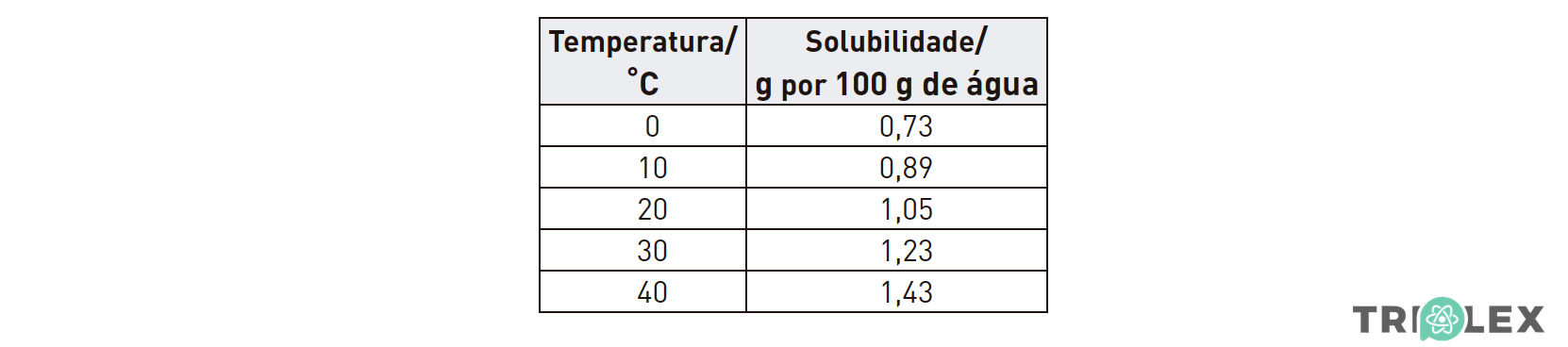
Dissolveram-se 12,0 g de acetato de prata em 1,0 kg de água, a 40 ºC. Esta solução foi depois aquecida até se evaporar metade do solvente (admita que o acetato de prata não é volátil) e, em seguida, a solução foi arrefecida até à temperatura de 20 ºC.
Calcule a massa de sal que terá precipitado.
Apresente todas as etapas de resolução.

- msal precipitado = 12,0 -5,26 = 6,75 g
ou
Inicialmente, a 40 ºC estão dissolvidos 12,0 g de acetato de prata em 1.0 kg de água.
⇒ No final, a solução está a 20 ºC e, a essa temperatura, a solubilidade do acetato de prata é 1,05 g por 100 g de água. Como metade do solvente se evapora, restam 5oo g = 5 x 100 g de água nos quais se dissolvem 5 x 1,05 g = 5,25 g de acetato de prata.
⇒ A restante massa deverá precipitar: 12,0 g – 5,25 g = 6,75 g, ou seja 6,8 g ( com dois algarismos significativos).
- Etapas de resolução:
⇒ Cálculo da massa de acetato de prata dissolvido na solução saturada a 20 oC (m = 5,25 g) …….. 6 pontos
⇒ Cálculo da massa de sal que terá precipitado (m = 6,8 g) …….. 4 pontos
ou
⇒ Cálculo da massa de acetato de prata que terá precipitado por cada 100 g da solução obtida por evaporação (m = 1,35 g) …….. 6 pontos
⇒ Cálculo da massa de sal que terá precipitado (m = 6,8 g) …….. 4 pontos
FIM










