2014 – 2ª Fase – Prova Escrita de Física e Química A
Voltar a: Física e Química
- Prova Escrita de Física e Química A – versão 1
- Prova 715: 2.ª Fase – 2014
GRUPO I
Eis-nos diante desse divertimento popular chamado montanha-russa. Um carrinho, levado ao ponto mais alto de uma linha de carris e aí abandonado à força da gravidade, cai, subindo e descendo depois pela linha fantasticamente curva, dando aos que vão dentro dele todas as sensações violentas das súbitas mudanças de velocidade… Partindo sempre do ponto mais alto, situado, por exemplo, a cem metros do chão, em parte nenhuma do percurso alcança ponto mais alto do que aquele. Vamos supor que alguém descobriu como eliminar totalmente as forças dissipativas e quer aplicar a sua descoberta à construção de uma montanha-russa. Nessa construção, deve seguir uma regra muito simples: não deve haver pontos situados a uma altura superior à do ponto de partida, embora a linha de carris possa ter qualquer comprimento. Se o carrinho puder mover-se livremente até ao final da linha de carris, poderá, no seu percurso, atingir várias vezes cem metros de altura, mas nunca poderá ultrapassar esse valor.
Nas montanhas-russas reais, não será assim: depois de abandonado, o carrinho nunca atingirá a altura do ponto de partida, devido à ação das forças dissipativas.A. Einstein, L. Infeld, A Evolução da Física, Lisboa, Livros do Brasil, pp. 43-45 (adaptado)
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
1. No texto, são referidas «todas as sensações violentas das súbitas mudanças de velocidade».
Qual é o nome da grandeza a que se refere a expressão em itálico?
- Aceleração
- Aceleração …….. 5 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
2. Um carrinho, abandonado no ponto mais alto da linha de carris de uma montanha-russa em que as forças dissipativas tenham sido totalmente eliminadas, passa no ponto mais baixo dessa linha, situado ao nível do chão, com uma velocidade cujo módulo é
(A) diretamente proporcional à energia mecânica inicial do sistema carrinho + Terra.
(B) diretamente proporcional à altura do ponto de partida.
(C) independente da massa do carrinho.
(D) independente do módulo da aceleração gravítica local.
- Opção (C)
⇒ Eliminando as forças dissipativas, na descida dos carris ao longo da montanha-russa há conservação de energia mecânica. Sendo nula a velocidade o carrinho no nível inicial, a uma altura h em relação ao solo, e descendo para um ponto ao nível do solo, usando a conservação de energia mecânica
- m g h = ½ m ν2 ⇔ ν2 = 2 gh
⇒ O módulo desta velocidade depende apenas da raiz quadrada do produto da aceleração da gravidade pela altura.
⇒ A energia mecânica inicial é diretamente proporcional à altura, logo, o módulo da velocidade não depende nem da massa nem é diretamente proporcional à altura.
- Opção (C) …………. 5 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
3. O trabalho realizado pelo peso do carrinho, entre o ponto de partida e o final da linha de carris,
(A) é independente do comprimento da linha de carris.
(B) depende do número de vezes que o carrinho atinge o ponto mais alto.
(C) é independente da massa do carrinho.
(D) depende da intensidade das forças dissipativas que atuem no carrinho.
- Opção (A)
⇒ A força gravítica, que designamos por peso, é uma força conservativa, ou seja, quando realiza trabalho sobre um sistema não faz variar a sua energia mecânica.
⇒ O trabalho realizado por uma força conservativa quando desloca um corpo de uma posição para outra depende apenas da posição inicial e final, qualquer que seja a trajetória descrita, assim nestas condições, o trabalho realizado pelo peso do carrinho, entre o ponto de partida e o final da linha de carris é independente do comprimento da linha de carris.
- Opção (A) …………. 5 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
4. Explique porque é que, nas montanhas-russas reais, «depois de abandonado, o carrinho nunca atingirá a altura do ponto de partida».
⇒ No ponto inicial o carrinho é abandonado com velocidade nula, logo, o sistema carrinho-Terra tem energia mecânica igual à sua energia potencial. Na descida de uma montanha-russa real há dissipação de energia, devida às forças dissipativas. Assim, ao longo dos carris, este processo de dissipação conduz à diminuição da energia mecânica do sistema carrinho-Terra.
⇒ Para atingir a altura inicial o sistema carrinho-Terra teria de possuir no mínimo (com velocidade nula) uma energia mecânica igual à inicial, mas já não a possui, porque houve dissipação de energia.
⇒ O carrinho numa montanha-russa real, em que o movimento apenas resulta do processo de transformação de energia de potencial em cinética, nunca chega à altura do ponto de partida.
- Tópicos de referência:
A) No ponto de partida e no ponto mais alto de cada uma das subidas, a energia cinética (ou a velocidade) do carrinho é nula e, assim, nesses pontos, a energia mecânica do sistema carrinho + Terra será igual à energia potencial gravítica [desse sistema].
B) Nas montanhas-russas reais, atuam sobre o carrinho forças dissipativas que [, à medida que o carrinho se desloca sobre a montanha-russa,] provocam uma diminuição da energia mecânica do sistema carrinho + Terra.
C) Assim, no ponto mais alto de cada uma das subidas, a energia potencial gravítica do sistema será sempre inferior à energia potencial gravítica [desse sistema] no ponto de partida, pelo que a altura [máxima] atingida pelo carrinho em cada uma das subidas será sempre inferior à altura do ponto de partida.

GRUPO II
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
1. A Figura 1 representa um plano inclinado, no topo do qual se abandonou uma bola. A bola desce o plano com aceleração constante.
Considere que a bola pode ser representada pelo seu centro de massa (modelo da partícula material).
Na tabela seguinte, estão registados os tempos, t, que a bola demorou a percorrer distâncias, d, sucessivamente maiores, sobre esse plano, assim como os quadrados desses tempos, t2.
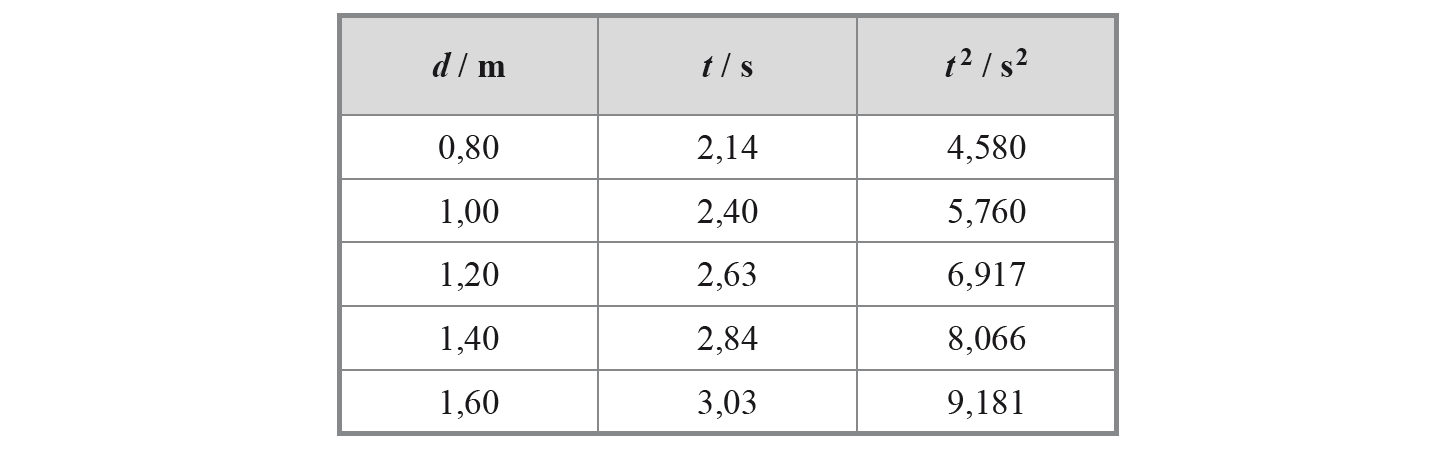
Calcule o módulo da aceleração da bola, no movimento considerado, a partir da equação da reta que melhor se ajusta ao conjunto dos valores de d e de t2 registados na tabela.
Apresente todas as etapas de resolução.
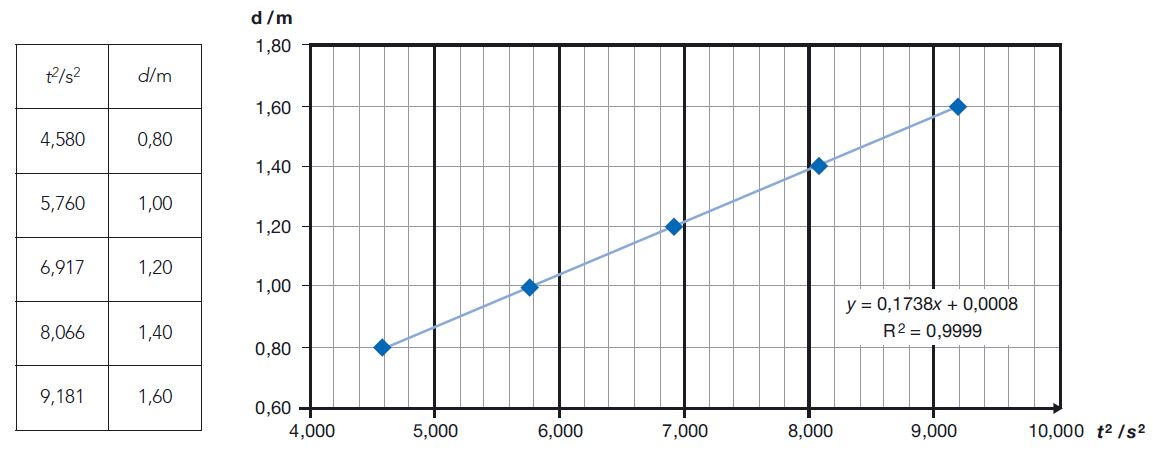
⇒ A equação da reta que melhor se ajusta aos pontos (t2; d) é a equação de regressão linear do gráfico de dispersão:
- d = 0,1738 t2 + 8 × 10–4
⇒ No modelo teórico, como a bola é abandonada no topo do plano inclinado, a equação do movimento é
- d = ½ a t2
⇒ Na expressão determinada 8 × 10–4 é aproximadamente zero, e esse valor resulta modelo do matemático do tratamento usado com os dados.
⇒ Comparando-a com a expressão obtida pela regressão linear tem-se
- 0,1738 = a
- a = 2 × 0,1738 = 0,3476 m s–2 = 0,348 m s–2
- Etapas de resolução:
A) Determinação, para t2 em função de d, da equação da reta que melhor se ajusta ao conjunto dos valores registados na tabela (t2 = 5,754 d – 4 × 10-3 (SI) ou y = 5,754 x – 4 × 10-3 (SI))
ou
- Determinação, para d em função de t2, da equação da reta que melhor se ajusta ao conjunto dos valores registados na tabela ( d = 0,1738 t2 + 8 × 10-4 (SI) ou y = 0,1738 x + 8 × 10-4 (SI)) …….. 5 pontos
B) Cálculo do módulo da aceleração da bola, no movimento considerado ( a = 0,348 m s-2) …….. 5 pontos
2. Numa outra situação, uma bola é abandonada de uma certa altura em relação ao solo, caindo verticalmente em condições nas quais a resistência do ar pode ser considerada desprezável.
Considere que a bola pode ser representada pelo seu centro de massa (modelo da partícula material).
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
2.1. Considere um referencial unidimensional Oy, vertical, com origem no solo e sentido positivo de baixo para cima.
Qual é o esboço do gráfico que pode representar a componente escalar da velocidade da bola, vy, em relação ao referencial considerado, em função do tempo, t, desde o instante em que é abandonada até chegar ao solo?

- Opção (B)
⇒ Se a bola é abandonada de uma certa altura em relação ao solo e cai verticalmente em condições tais que a resistência do ar pode ser considerada desprezável, o seu movimento é retilíneo uniformemente acelerado (o módulo da velocidade aumenta).
⇒ A única força que atua na bola é o peso e a velocidade inicial, v0, é nula.
⇒ Tendo em conta o referencial, a lei horária das velocidades é v = − at o que evidencia que a velocidade tem o sentido negativo do eixo de referência e o seu módulo é crescente.
- Opção (B) …………. 5 pontos
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
- 10ºano – Física – A.l. – 1.2 – Movimento vertical de queda e ressalto de uma bola
2.2. A bola cai e ressalta no solo.
Nos esquemas seguintes, o vetor ad representa a aceleração da bola num ponto da descida situado a uma determinada altura em relação ao solo.
Em qual dos esquemas seguintes o vetor as representa a aceleração da bola no ponto da subida situado à mesma altura?

- Opção (D)
⇒ Para situações em que a resistência do ar é desprezável, no movimento vertical a aceleração é a aceleração gravítica, tanto na subida como na descida.
⇒ A bola sobe e desce em condições segundo as quais a resistência do ar é desprezável.
⇒ Na descida o movimento da bola é retilíneo uniformemente acelerado sendo que a única força que atua é o peso.
⇒ Na subida o movimento da bola é retilíneo uniformemente retardado sendo que a única força que atua na bola é também o peso.
⇒ Na subida e na descida a aceleração do movimento é aceleração gravítica local, em ambos os sentidos do movimento a sua intensidade e sentido mantêm-se.
- Opção (D) …………. 5 pontos
GRUPO III
Com o objetivo de estabelecer o balanço energético de um sistema gelo + água líquida, um grupo de alunos realizou uma experiência, na qual adicionou 30,0 g de gelo fragmentado, à temperatura de 0,0 ºC, a 260,0 g de água líquida, a 20,0 ºC.
Os alunos consultaram tabelas de constantes físicas e registaram os seguintes valores:
- cágua líquida (capacidade térmica mássica da água líquida) = 4,18 × 103 J kg-1 ºC-1
- ΔHfusão gelo (variação de entalpia (ou calor) de fusão do gelo) = 3,34 × 105 J kg-1
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
1. Identifique a fonte e o recetor, quando se inicia o processo de transferência de energia que ocorre no interior do sistema considerado.
⇒ Quando se inicia o processo de transferência de energia que ocorre no interior do sistema considerado, a fonte de energia será a água líquida que se encontra a 20,0 ºC e o recetor de energia será o gelo que se encontra a 0 ºC.
⇒ Quando dois corpos a temperaturas diferentes são colocados em contato, há energia a transferir-se como calor do corpo que se encontra a uma temperatura mais elevada, neste caso a água líquida que se encontra a 20,0 ºC, funcionando este como a fonte de energia, para aquele que se encontra a uma temperatura mais baixa, neste caso o gelo que se encontra a 0 ºC, funcionando este como recetor de energia, até que ambos atinjam a mesma temperatura.
Fonte: água líquida [, a 20,0 ºC].
Recetor: gelo [, a 0,0 ºC] …….. 5 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
2. Qual das expressões seguintes permite calcular a energia, em joules (J), necessária para fundir completamente o gelo?

- Opção (C)
⇒ Recorrer à expressão E = m ΔH para calcular a energia, expressa em joules, necessária para fundir 30,0 g de gelo que se encontra a 0 ºC
- E = m ΔH ⇔ E = (0,0300 × 3,34 × 105) J
⇒ O valor da massa de gelo deve estar expresso em quilogramas devido às unidades em que está indicada a variação da entalpia de fusão do gelo.
- Opção (C) …………. 5 pontos
3. Com base nos resultados obtidos experimentalmente, os alunos estabeleceram o balanço energético do sistema.
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
3.1. Em que lei se baseia o estabelecimento do balanço energético do sistema?
⇒ O estabelecimento do balanço energético do sistema baseia-se na Lei da Conservação da Energia ou 1ª Lei da Termodinâmica.
- Lei da conservação da energia ou 1.ª Lei da Termodinâmica …….. 5 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
3.2. Os alunos calcularam a energia recebida pelo gelo, desde que este foi adicionado à água líquida até toda a mistura ter ficado à mesma temperatura de 11,0 ºC, tendo obtido 1,140 × 104 J.
Calcularam também a energia cedida pela água líquida, inicialmente a 20,0 ºC, no mesmo intervalo de tempo. Com base nos resultados obtidos, concluíram que, naquele intervalo de tempo, tinha ocorrido transferência de energia entre o sistema considerado e o exterior.
Conclua, justificando, em que sentido terá ocorrido aquela transferência de energia.
Apresente todas as etapas de resolução.
⇒ Energia recebida pelo gelo:
- Er = 1,140 × 104 J
⇒ Energia cedida pela água:
- Ec = m c ΔT ⇔ E = m c (θf−θi) ⇔ E = 0,2600 × 4,18 × 104 × (11,0 – 20,0) ⇔ E = 0,2600 × 4,18 × 104× (– 9,0) ⇔ E = − 9,781 × 103 J
⇒ Energia cedida pela água:
- ΔU = Er + Ec ⇔ ΔU = + 1,140 × 104 J − 9,781 × 103 J ⇔ ΔU = + 0,181 × 104 J
A variação de energia interna do sistema é positiva, ΔU > 0, então o sistema recebeu energia do exterior.
⇒ Assim, houve energia que se transferiu do exterior (ambiente) para o sistema gelo + água.
- Etapas de resolução:
A) Cálculo da energia cedida pela água líquida, inicialmente a 20,0 ºC, no intervalo de tempo considerado (E = 9,781 × 103 J)
ou
- Cálculo da variação de energia da água líquida, inicialmente a 20,0 ºC, no intervalo de tempo considerado (ΔE = -9,781 × 103 J) …….. 5 pontos
B) Comparação da energia recebida pelo gelo com a energia cedida pela água líquida, inicialmente a 20,0 ºC, no intervalo de tempo considerado (1,140 × 104 J > 9,781 × 103 J )
ou
- Demonstração de que a energia interna do sistema aumentou, no intervalo de tempo considerado
ou
- Cálculo da energia necessária à fusão completa do gelo e comparação desta energia com a energia cedida pela água líquida, inicialmente a 20,0 ºC, no intervalo de tempo considerado (1,002 × 104 J > 9,781 × 103 J ) …….. 5 pontos
C) Conclusão sobre o sentido em que terá ocorrido a transferência de energia (do exterior para o sistema) …….. 5 pontos
ou
A) Cálculo da diminuição de temperatura que a água líquida, inicialmente a 20,0 ºC, sofreria se tivesse cedido toda a energia recebida pelo gelo (10,5 ºC) …….. 5 pontos
B) Comparação da diminuição de temperatura que a água líquida sofreria com a diminuição de temperatura real, no intervalo de tempo considerado (10,5 ºC > 9,0 ºC) …….. 5 pontos
C) Conclusão sobre o sentido em que terá ocorrido a transferência de energia (do exterior para o sistema) …….. 5 pontos
Nota – A apresentação de valores calculados com arredondamentos incorretos, ou com um número incorreto de algarismos significativos, não implica, por si só, qualquer desvalorização.
GRUPO IV
A medição do índice de refração de soluções aquosas pode ser usada na determinação da concentração do soluto. Esta técnica de análise quantitativa requer o traçado de curvas de calibração, que relacionam os índices de refração, n, de soluções desse soluto com as respetivas concentrações, c.
A Figura 2 representa uma curva de calibração, obtida a partir de várias soluções aquosas de ácido acético de diferentes concentrações. Os índices de refração das soluções, para uma determinada radiação monocromática, foram medidos à temperatura de 20 ºC.

- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
- 11ºano – Física – A.l. – 3.1 – Ondas: absorção, reflexão, refração
1. Das várias soluções aquosas de ácido acético a partir das quais se obteve a curva de calibração representada na Figura 2, considere as soluções de concentração 0,50 mol dm-3 e 1,34 mol dm-3 .
Sobre cada uma dessas soluções, a 20 ºC, fez-se incidir um feixe, muito fino, da radiação monocromática referida, segundo um mesmo ângulo.
A velocidade de propagação dessa radiação será maior na solução de concentração
(A) 1,34 mol dm-3 , e o ângulo de refração será menor na mesma solução.
(B) 1,34 mol dm-3 , e o ângulo de refração será maior na mesma solução.
(C) 0,50 mol dm-3 , e o ângulo de refração será menor na mesma solução.
(D) 0,50 mol dm-3 , e o ângulo de refração será maior na mesma solução.
- Opção (D)
⇒ Como se tem para o índice de refração n = c/v , a velocidade, ν = c/n , será maior na solução de menor índice de refração, ou seja, na solução de concentração 0,50 mol dm-3.
⇒ Um feixe, passando do ar para a solução, sofre um desvio tanto menor quanto menor for o índice de refração desse meio.
⇒ Como o ângulo de refração é medido com a normal ao ponto de incidência, a um desvio menor corresponde um ângulo de refração maior.

- Opção (D) …………. 5 pontos
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
- 11ºano – Física – A.l. – 3.1 – Ondas: absorção, reflexão, refração
2. A Figura 3 representa uma tina contendo uma solução aquosa de ácido acético de concentração 1,20 mol dm-3 , à temperatura de 20 ºC, sobre a qual incide um feixe, muito fino, da radiação monocromática referida, segundo a direção representada.

Determine o ângulo de refração que se deverá observar.
Apresente todas as etapas de resolução.
- nar (índice de refração do ar) = 1,000
- Etapas de resolução:
A) Determinação do índice de refração da solução de ácido acético, para a radiação monocromática referida, à temperatura de 20 ºC (n = 1,3380) …….. 5 pontos
B) Cálculo do ângulo de refração que se deverá observar (α = 34,9º) …….. 5 pontos
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
- 11ºano – Física – A.l. – 3.1 – Ondas: absorção, reflexão, refração
3. Quando a luz se propaga numa solução de ácido acético e incide na superfície de separação entre a solução e o ar, segundo um ângulo superior ao ângulo crítico, ocorre reflexão total da luz.
O ângulo crítico depende do
(A) ângulo de incidência.
(B) ângulo de refração.
(C) índice de refração da solução.
(D) volume da solução.
- Opção (C)
⇒ Quando a luz passa da solução de ácido acético para o ar, segundo um ângulo superior ao ângulo crítico, ocorre a reflexão total porque a solução de ácido acético é um meio mais refringente, ou seja, meio com maior índice de refração que o ar.
⇒ Recorrendo à expressão que traduz a lei de Snell – Descartes para a refração nar sin αar = nsolução sin αsolução e sabendo que o ângulo crítico de incidência corresponde a um ângulo de refração de 90,0º , αsolução =90,0º resulta:
- nar sin 90,0º = nsolução sin αacrítico ⇔ sin αcrítico = 1 sin 90,0º/nsolução
o que evidencia que o ângulo crítico depende do índice de refração da solução.
- Opção (C) …………. 5 pontos
4. As soluções aquosas de ácido acético a partir das quais se obteve a curva de calibração representada na Figura 2 foram preparadas a partir de uma solução inicial de concentração 4,50 mol dm-3.
Qual é o fator de diluição a considerar na preparação da solução de ácido acético de concentração 0,50 mol dm-3?
(A) 9
(B) 5
(C) 4
(D) 2
- Opção (A)
- Fator de diluição = csolução concentrada/csolução diluída ⟺ Fator de diluição = 4,50/0,50 ⟺ Fator de diluição = 9
- Opção (A) …………. 5 pontos
5. A densidade de uma solução de ácido acético de concentração 0,50 mol dm-3 é 1,0025 × 103 g dm-3, a 20 ºC.
Qual das expressões seguintes permite calcular a quantidade de ácido acético que existe em 100 g da solução?

- Opção (A) …………. 5 pontos
GRUPO V
O ácido acético, CH3COOH (aq), é um ácido monoprótico fraco, cuja ionização em água pode ser traduzida por
CH3COOH (aq) + H2O (l ) ⇋ CH3COO– (aq) + H3O+ (aq)
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
1. Nesta reação, podem ser identificados dois pares conjugados de ácido-base, segundo a teoria de Brönsted-Lowry.
O que é uma base conjugada de um ácido de Brönsted-Lowry?
⇒ Uma base conjugada de Brönsted-Lowry é uma espécie que possui um protão (H+) a menos do que o seu ácido conjugado.
[Uma base conjugada de um ácido de Brönsted-Lowry] é a espécie química que resulta da perda de um protão pelo ácido ou equivalente …….. 5 pontos
2. Considere uma solução aquosa de ácido acético de concentração 0,100 mol dm-3, à qual foi sendo adicionada uma solução aquosa de hidróxido de sódio, NaOH(aq).
A tabela seguinte apresenta os valores de pH, a 25 ºC, da solução inicial e das soluções resultantes das adições efetuadas, em função do volume total de NaOH(aq) adicionado.

- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
2.1. Determine a percentagem de ácido acético não ionizado na solução inicial.
Apresente todas as etapas de resolução.
⇒ Cálculo da concentração de H3O+:
- [H3O+] = 10–pH = 10–2,88 = 1,32 x 10–3 mol dm–3
⇒ Da estequiometria da equação química, desprezando o contributo para o ião hidrónio da auto ionização da água, conclui-se que a concentração do ião acetato (concentração do ácido ionizado) é igual à do ião hidrónio (oxónio).
- [H3O+] = [CH3COO–] = 1,318 x 10–3 mol dm–3
⇒ Cálculo da concentração do ácido não ionizado:
- [CH3COOH]inicial – [CH3COOH]ionizado = [CH3COOH]inicial – [CH3COO–] = 0,100 – 1,318 x 10–3 = 0,09868 mol dm–3
⇒ Para um volume de 1 dm3, a percentagem do ácido não ionizado :

- Etapas de resolução:
A) Cálculo da concentração de ácido acético ionizado na solução inicial (c = 1,318 × 10-3 mol dm-3) …….. 3 pontos
B) Cálculo da concentração de ácido acético não ionizado na solução inicial (c = 9,868 × 10-2 mol dm-3) …….. 4 pontos
C) Cálculo da percentagem de ácido acético não ionizado na solução inicial (98,7%) …….. 3 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
2.2. Quando o volume total de NaOH (aq) adicionado é 40,00 cm3, verifica-se que a concentração hidrogeniónica, em relação ao valor inicial, diminui cerca de
(A) duas vezes.
(B) três vezes.
(C) trezentas vezes.
(D) mil vezes.
- Opção (C)
Tendo em conta a relação entre o pH e a concentração de H3O+ expressa em moles poe decímetro cúbico, pH = −log [H3O+] e analisando a tabela
⇒ Calcular a concentração de catião, H3O+, na solução inicial, [H3O+]i
- Por análise da tabela, verifica-se que o pH inicial da solução é 2,88
⇒ Calcular a concentração de catião, H3O+, na solução após a adição de 40,00 cm3 de NaHO, [H3O+]após
- Por análise da tabela, verifica-se que o pH da solução após a adição de 40,00 cm3 de NaHO é 5,36
⇒ Estabelecer a razão entre as concentrações correspondentes
- O que mostra que, quando o volume total de NaHO (aq) adicionado é 40,00 cm3, a concentração hidrogeniónica diminui cerca de trezentas vezes, em relação ao valor inicial.
- Opção (C) …………. 5 pontos
2.3. O ácido acético é um ácido fraco e, assim, a sua ionização em água ocorrerá em pequena extensão.
Conclua, justificando com base no Princípio de Le Châtelier, se a ionização deste ácido em água é favorecida pela adição de NaOH (aq).
⇒ Ao se adicionar NaOH (aq) à solução de ácido acético, o OH– ionizado reage com o H3O+ (aq) da solução, diminuindo desta forma a sua concentração.
- NaOH (aq) + H3O+ (aq) → Na+ (aq) + 2 H2O (ℓ)
⇒ De acordo com o Princípio de Le Châtelier, à perturbação que diminui a concentração de uma espécie o sistema reacional reage evoluindo no sentido em que procura repor a concentração dessa espécie, neste caso o produto da reação H3O+ (aq).
Portanto, neste caso o sistema evolui no sentido direto, o qual favorece a ionização do ácido.
ou
⇒ A adição de solução aquosa de hidróxido de sódio, NaHO (aq), a uma solução aquosa de ácido acético provoca uma diminuição da concentração hidrogeniónica, [H3O+] (aq), devido a ocorrer a reação representada pela seguinte equação química:
- NaOH (aq) + H3O+ (aq) → Na+ (aq) + 2 H2O (ℓ)
⇒ Tendo em consideração o Principio de Le Chatelier, (quando um sistema em equilíbrio é sujeito a uma perturbação única, o sistema desloca-se no sentido de contrariar essa perturbação até se estabelecer um novo estado de equilíbrio) pode dizer-se que será favorecida a reação que conduz a um aumento da concentração de H3O+, que nestas circunstâncias é a reação de ionização do ácido acético, representada pela equação química:
- CH3COOH (aq) + H2O (ℓ) ⇄ CH3COO− (aq) + H3O+ (aq)
Deste modo, é possível concluir que a ionização do ácido acético em água é favorecida pela adição de NaOH.
- Tópicos de referência:
A) A adição de NaOH(aq) [a uma solução aquosa de ácido acético] provoca uma diminuição da concentração de H3O+(aq).
B) Assim, [de acordo com o Princípio de Le Châtelier,] é favorecida a reação que conduz a um aumento da concentração de H3O+ (aq), o que permite concluir que a ionização do ácido [acético em água] é favorecida [pela adição de NaOH (aq)].

GRUPO VI
1. O ácido acético (M = 60,06 g mol-1) pode formar-se a partir do etanal, CH3CHO (M = 44,06 g mol-1), segundo uma reação que pode ser traduzida por
5 CH3CHO (l) + 2 MnO4– (aq) + 6 H3O+ (aq) → 5 CH3COOH (aq) + 2 Mn2+ (aq) + 9 H2O (l)
- 11ºano – Química – Domínio 2 – subdomínio 2 (Reações de oxidação redução)
1.1. Na reação considerada, o número de oxidação do manganês (Mn)
(A) aumenta, atuando o ião permanganato (MnO4– ) como redutor.
(B) aumenta, atuando o ião permanganato (MnO4– ) como oxidante.
(C) diminui, atuando o ião permanganato (MnO4– ) como redutor.
(D) diminui, atuando o ião permanganato (MnO4– ) como oxidante.
- Opção (D)
⇒ O número de oxidação (n.o.) de um elemento num composto covalente, num dado estado, é a carga que um átomo desse elemento adquiriria se os eletrões ligantes, em cada ligação, fossem totalmente atribuídos aos átomos mais eletronegativos.
⇒ Determinar o número de oxidação, n, do manganês, Mn, no ião permanganato, MnO4–
⇒ A soma algébrica dos números de oxidação de todos os átomos num ião é igual à carga do ião.
⇒ O número de oxidação do oxigénio é −2 exceto nos peróxidos onde o número de oxidação é −1, e nos superóxidos onde é −½.
- n.o. (Mn) + 4 n.o. (O) = −1 ⇔ n.o. (Mn) + 4 (−2) = −1 ⇔ n.o. (Mn) −8 = −1 ⇔ n.o. (Mn) = −1 + 8 ⇔ n.o.(Mn) = 7
⇒ Determinar o número de oxidação, n.o. do manganês, Mn, no catião manganês(II), Mn2+
⇒ O número de oxidação de um elemento num ião monoatómico coincide com a carga do ião.
- Δn.o. (Mn) =n.o. (Mn)final − n.o. (Mn)inicial ⇔ Δn.o. (Mn) =+2 − (+7) ⇔ Δn.o. (Mn) = −5
⇒ Na reação considerada, o número de oxidação do manganês diminui de +7 para +2, isto é, sofre uma variação de −5 , pelo que sofreu redução, funcionando como oxidante, dado que capta eletrões, provocando a oxidação da outra espécie.
- Opção (D) …………. 5 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
1.2. Considere uma amostra impura de CH3CHO, de massa 1,0 × 103 g, que contém 64% (em massa) de CH3CHO.
Qual das expressões seguintes permite calcular a massa, em gramas (g), de CH3COOH que se poderia formar a partir da reação de todo o CH3CHO existente na referida amostra?

- Opção (B) …………. 5 pontos
- 11ºano – Química – Domínio 1 – subdomínio 1 (Aspetos quantitativos das reações químicas)
1.3. Admita agora que, noutras condições, o rendimento da reação considerada é 85%.
Determine a massa de CH3CHO que tem de reagir para que se possa obter, na prática, 15 g de CH3COOH.
Apresente todas as etapas de resolução.
- Etapas de resolução:
A) Cálculo da massa de ácido acético que se obteria se o rendimento da reação fosse 100% (m = 17,6 g) ou equivalente …….. 5 pontos
B) Cálculo da massa de CH3CHO que tem de reagir (m = 13 g) …….. 5 pontos
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
2. A molécula de CH3COOH pode ser representada através da notação de Lewis por

A molécula de CH3COOH apresenta, no total,
(A) 24 eletrões de valência.
(B) 16 eletrões de valência.
(C) 12 eletrões de valência.
(D) 8 eletrões de valência.
- Opção (A)
⇒ Tendo em consideração a notação de Lewis para a molécula de ácido acético CH3COOH, e sabendo que cada traço representa um par de eletrões ligantes (dois eletrões) e que cada dois pontos representam um par de eletrões (dois eletrões) não partilhados e que neste tipo de representação apenas são representados os eletrões de valência, verifica-se que a molécula de ácido acético apresenta no total 24 eletrões de valência.
Nota: Poder-se-ia ter chegado à mesma conclusão tendo em conta que o número de eletrões de valência, n.e.v., que uma molécula apresenta é a soma do número de eletrões de valência dos átomos que a constituem. Assim, neste caso, sabendo que os eletrões de valência, para os elementos representativos são os do último nível, tendo em consideração a configuração eletrónica de estado fundamental, começaríamos por escrever as respetivas configurações eletrónicas dos elementos envolvidos:
1H ⇒ 1s1
6C ⇒ 1s2 2s2 2p2
8O ⇒ 1s2 2s2 2p4
- n.e.v.(CH3COOH) = 4 n.e.v.(H) + 2 n.e.v.(C) +2 n.e.v.(O) ⇔ n.e.v.(CH3COOH) = 4(1) + 2(4) +2(6) ⇔ n.e.v.(CH3COOH) = 4 + 8 +12 ⇔ n.e.v.(CH3COOH) = 24
⇒ Chegando-se, como seria de prever, à conclusão que cada molécula de ácido acético tem 24 eletrões de valência.
- Opção (A) …………. 5 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
3. Quantos átomos de hidrogénio existem em 5,0 moles de moléculas de ácido acético, CH3COOH?
(A) 2,4 ×1025
(B) 3,0 ×1024
(C) 2,4 ×1024
(D) 1,2 ×1025
- Opção (D)
⇒ Analisando a fórmula química do ácido acético, verifica-se que cada molécula é constituída por 8 átomos (4 átomos de hidrogénio, 2 átomos de carbono e 2 átomos de oxigénio), permitindo concluir que o número de átomos de hidrogénio é 4 vezes superior ao número de moléculas.
⇒ Calcular o número de moléculas, N, de ácido acético existente em 5 moles, n, de moléculas de CH3COOH
- N(CH3COOH) = n(CH3COOH) × NA ⇔ N(CH3COOH) = 5 × 6,02×1023 ⇔ N(CH3COOH) = 3,01×1024 moléculas
⇒ Calcular o número de átomos de hidrogénio, N, existente em 3,01×1024 moléculas de CH3COOH
- N(H) = 4 × N(CH3COOH) ⇔ N(H) = 3,01×1024 × 4 ⇔ N(H) = 1,2×1025 átomos.
- Opção (D) …………. 5 pontos
GRUPO VII
1. «Por oposição a estado fundamental, que é o estado natural dos átomos, existem estados que correspondem à excitação dos átomos por fornecimento de energia.»
J. L. da Silva, P. F. da Silva, A Importância de Ser Eletrão, Lisboa, Gradiva, p. 99, 2009
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
1.1. O que se designa por estado fundamental de um átomo?
⇒ O estado fundamental de um átomo designa-se por estado de menor energia do átomo ou estado que corresponde à distribuição eletrónica de menor energia.
- Estado de menor energia [do átomo] ou equivalente …….. 5 pontos
- 10ºano – Química – Domínio 1 – subdomínio 3 (Tabela periódica)
1.2. Considere um átomo do elemento que pertence ao 2.º período e ao grupo 15 da tabela periódica.
Quantos valores diferenciados de energia apresentam os eletrões de valência desse átomo no estado fundamental?
(A) Dois.
(B) Três.
(C) Quatro.
(D) Cinco.
- Opção (A)
⇒ Um átomo de um elemento que pertence ao segundo período da tabela periódica distribui os seus eletrões por dois níveis energéticos diferentes, o nível a que corresponde o número quântico principal, n= 1, e aquele a que corresponde número quântico principal, n = 2. Se pertence ao grupo 15 é porque possui 5 eletrões de valência.
⇒ Então a configuração eletrónica de menor energia (a configuração eletrónica de estado fundamental) para átomos desse elemento será 1s2 2s2 2p3 (o que permite concluir que o elemento em estudo possui número atómico sete, sendo por isso o nitrogénio).
⇒ Nos átomos polieletrónicos, isto é, em átomos que possuem mais do que um eletrão, a energia de cada eletrão depende do número quântico principal n, e também depende do número quântico secundário, ℓ.
⇒ Os cinco eletrões de valência (os eletrões do último nível) distribuem-se, no estado fundamental, por quatro orbitais a que correspondem dois valores diferenciados de energia, (E2s < E2p ), um para a orbital 2s, e outro para qualquer uma das orbitais 2p (as três orbitais 2p: 2px, 2py e 2pz, possuem todas a mesma energia, por isso se chamam orbitais degeneradas).
- Opção (A) …………. 5 pontos
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
1.3. Considere um átomo do elemento cujo número atómico é 8.
Qual das configurações eletrónicas seguintes pode corresponder a esse átomo num estado excitado?
(A) 1s2 2s1 2px3 2py1 2pz1
(B) 1s2 2s1 2px2 2py2 2pz1
(C) 1s2 2s2 2px1 2py2 2pz1
(D) 1s1 2s3 2px2 2py1 2pz1
- Opção (B)
⇒ Configuração eletrónica de estado excitado é uma configuração eletrónica que não obedece ao princípio da energia mínima.
⇒ Assim:
(A) representa uma configuração eletrónica impossível porque apresenta 3 eletrões numa orbital 2p.
(C) representa a configuração eletrónica de estado fundamental.
(D) representa uma configuração eletrónica impossível porque apresenta 3 eletrões na orbital 2s.
- Opção (B) …………. 5 pontos
2. «Existem vários átomos cujas configurações eletrónicas de valência são semelhantes, diferindo apenas no facto de envolverem diferentes números quânticos principais.»
J. L. da Silva, P. F. da Silva, A Importância de Ser Eletrão, Lisboa, Gradiva, p. 101, 2009
Esta afirmação refere-se a átomos de elementos de um mesmo _____ da tabela periódica, que apresentam um número ______ de eletrões de valência.
(A) período … igual
(B) grupo … diferente
(C) período … diferente
(D) grupo … igual
*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
- Opção (D)
⇒ Se as configurações eletrónicas de valência são semelhantes significa que possuem o mesmo número de eletrões de valência, por isso referem-se a átomos que pertencem ao mesmo grupo.
⇒ Se esses eletrões se distribuem por orbitais do mesmo tipo é porque o número quântico secundário não varia, mas de número quântico principal diferente, pelo que o período é diferente.
- Opção (D) …………. 5 pontos
- 10ºano – Química – Domínio 1 – subdomínio 3 (Tabela periódica)
3. Explique porque é que a energia de ionização dos átomos dos elementos representativos da tabela periódica diminui ao longo de um mesmo grupo (à medida que o número atómico aumenta).
⇒ Energia de ionização é a energia mínima necessária para remover um eletrão de um átomo, gasoso, isolado, no seu estado fundamental. A grandeza da energia de ionização está relacionada com a força com que o eletrão está “preso” ao átomo. Quanto maior a energia de ionização, mais difícil é a remoção do eletrão.
⇒ Ao longo de um mesmo grupo da tabela periódica, à medida que o número atómico aumenta, os eletrões de valência, dos elementos representativos, estão em orbitais de número quântico principal, n, sucessivamente maior, isto é, níveis de energia sucessivamente mais elevados.
⇒ A energia dos eletrões de valência aumenta ao longo de um mesmo grupo da tabela periódica à medida que o número atómico aumenta, porque os eletrões de valência encontram-se a distâncias médias dos respetivos núcleos sucessivamente maiores, o que implica que a força de atração entre o núcleo e esses eletrões seja sucessivamente menor.
⇒ Sendo a energia dos eletrões de valência sucessivamente mais elevada, ao longo de um mesmo grupo da tabela periódica, à medida que o número atómico aumenta, a energia mínima necessária para remover um dos eletrões de valência, do átomo, gasoso, isolado, no seu estado fundamental, será cada vez menor.
- Tópicos de referência:
A) [Ao longo de um mesmo grupo da tabela periódica (à medida que o número atómico aumenta),] os eletrões de valência [dos átomos dos elementos representativos] encontram-se em orbitais com número quântico principal sucessivamente maior (ou em níveis de energia sucessivamente mais elevados) ou equivalente.
B) Sendo a energia dos eletrões de valência sucessivamente mais elevada, a energia mínima necessária para remover um dos eletrões de valência (ou equivalente) [do átomo, no estado fundamental,] será cada vez menor.
ou
- Os eletrões de valência encontram-se a distâncias [médias] dos respetivos núcleos sucessivamente maiores (ou equivalente), o que implica que a força de atração entre o núcleo e esses eletrões seja sucessivamente menor. Assim, a energia mínima necessária para remover um dos eletrões de valência (ou equivalente) [do átomo, no estado fundamental,] será cada vez menor.

FIM










