2017 – 2ª Fase – Prova Escrita de Física e Química A
Voltar a: Física e Química
- Prova Escrita de Física e Química A – versão 1
- Prova 715: 2.ª Fase – 2017
GRUPO I
Considere dois conjuntos, A e B, ambos constituídos por um ciclista e pela respetiva bicicleta. Estes conjuntos movem-se numa pista horizontal.
Admita que cada conjunto pode ser representado pelo seu centro de massa (modelo da partícula material).
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
1. O trabalho realizado pelo peso do conjunto A, num percurso nessa pista,
(A) é nulo, porque o peso do conjunto é perpendicular ao deslocamento efetuado.
(B) será diferente de zero se a energia cinética do conjunto variar.
(C) é nulo, porque o peso do conjunto é independente do deslocamento efetuado.
(D) será diferente de zero se a trajetória do conjunto for circular.
- Opção (A)
⇒ O deslocamento tem a direção horizontal e o peso é uma força com direção vertical, logo, como os dois vetores são perpendiculares, o trabalho do peso é nulo.
- Opção (A) ……………. 5 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
2. Considere que vA representa o módulo da velocidade do conjunto A e que vB representa o módulo da velocidade do conjunto B.
Se a massa do conjunto A for ¾ da massa do conjunto B, a energia cinética do conjunto A será igual à energia cinética do conjunto B quando

- Opção (C) ……………. 5 pontos
3. Admita que, num determinado intervalo de tempo, os conjuntos A e B se movem paralelamente um ao outro, num troço retilíneo da pista horizontal.
Considere um referencial unidimensional, Ox, paralelo à trajetória dos conjuntos nesse troço.
Na Figura, encontram-se representados os esboços dos gráficos das componentes escalares da velocidade, vx , dos conjuntos A e B, segundo o referencial Ox , em função do tempo, t , no intervalo de tempo considerado.

- 11ºano – Física – Domínio 1 – subdomínio 1 (Tempo, posição e velocidade)
3.1. De acordo com o gráfico, no intervalo de tempo [0, t2 ], os conjuntos A e B
(A) cruzam-se no instante t1.
(B) movem-se no mesmo sentido.
(C) percorrem distâncias diferentes.
(D) têm módulos da aceleração diferentes.
- Opção (B)
O gráfico da componente escalar da velocidade dá informação sobre o sentido do movimento, sobre a variação dessa componente e permite concluir sobre a distância percorrida.
No intervalo [0, t2], as componentes escalares da velocidade são ambas positivas, a velocidade inicial de A é igual à velocidade de B no instante t2 e os módulos das variações de velocidade são iguais:
⇒ os conjuntos movem-se no mesmo sentido, o sentido positivo;
⇒ no instante t1 os conjuntos têm igual velocidade;
⇒ sendo iguais as áreas entre o gráfico e o eixo do tempo, as distâncias percorridas foram iguais.
- Opção (B) ……………. 5 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
3.2. Conclua se a soma dos trabalhos realizados pelas forças não conservativas que atuam no conjunto A, no intervalo de tempo [0, t2 ], é positiva ou negativa.
Apresente num texto a fundamentação da conclusão solicitada.
⇒ A soma dos trabalhos realizados pelas forças aplicadas em A é igual à soma dos trabalhos realizados pelo peso e pelas forças não conservativas.
⇒ O trabalho realizado pelo peso é nulo dado que este (vertical) é perpendicular ao deslocamento (horizontal).
⇒ A soma dos trabalhos realizados pelas forças não conservativas que atuam em A, no percurso considerado, é igual à soma dos trabalhos realizados pelas forças que atuam em A, portanto, igual à variação de energia cinética que é positiva, dado que a velocidade de A aumenta.
- A resposta integra os tópicos de referência seguintes ou outros de conteúdo equivalente:
A) A soma dos trabalhos realizados pelas forças não conservativas [que atuam no conjunto A] é igual à soma da variação da energia cinética [do conjunto] e da variação da energia potencial gravítica [do sistema conjunto + Terra].
B) [No intervalo de tempo considerado,] a variação da energia cinética [do conjunto] é positiva, uma vez que o módulo da velocidade [daquele conjunto] aumenta.
C) [No intervalo de tempo considerado,] a variação da energia potencial gravítica [do sistema conjunto + Terra] é nula, uma vez que o conjunto se move sobre uma superfície horizontal.
D) [Consequentemente, no intervalo de tempo considerado,] a soma dos trabalhos realizados pelas forças não conservativas que atuam no conjunto [, sendo igual à variação da energia cinética do conjunto, no mesmo intervalo de tempo,] é positiva.
ou
A) A soma dos trabalhos realizados pelas forças conservativas e pelas forças não conservativas [que atuam no conjunto A] é igual à variação da energia cinética [desse conjunto].
B) [ No intervalo de tempo considerado,] a variação da energia cinética [do conjunto] é positiva, uma vez que o módulo da velocidade [daquele conjunto] aumenta.
C) [No intervalo de tempo considerado,] o trabalho realizado pelo peso do conjunto [(a única força conservativa que atua nesse conjunto)] é nulo, uma vez que o peso é uma força perpendicular ao deslocamento.
D) [Consequentemente, no intervalo de tempo considerado,] a soma dos trabalhos realizados pelas forças não conservativas que atuam no conjunto [, sendo igual à variação da energia cinética do conjunto, no mesmo intervalo de tempo,] é positiva.
ou
A) [No intervalo de tempo considerado,] a aceleração do conjunto A (ou a resultante das forças que atuam no conjunto A) tem o sentido do movimento, uma vez que o módulo da velocidade aumenta.
B) O trabalho realizado pela resultante das forças [que atuam no conjunto] é positivo, uma vez que essa resultante tem o sentido do deslocamento (ou uma vez que o módulo da velocidade aumenta).
C) [No intervalo de tempo considerado,] o trabalho realizado pelo peso do conjunto [(a única força conservativa que atua nesse conjunto)] é nulo, uma vez que o peso é uma força perpendicular ao deslocamento.
D) [Consequentemente, no intervalo de tempo considerado,] a soma dos trabalhos realizados pelas forças não conservativas que atuam no conjunto [, sendo igual ao trabalho realizado pela resultante das forças que atuam no conjunto, no mesmo intervalo de tempo,] é positiva.
ou
A) [Deslocando-se o conjunto A sobre uma superfície horizontal,] as forças [conservativas ou não conservativas] que realizem trabalho [não nulo] serão as forças responsáveis pela variação do módulo da velocidade do conjunto.
B) [No intervalo de tempo considerado,] o trabalho realizado pelo peso do conjunto [(a única força conservativa que atua nesse conjunto)] é nulo, uma vez que o peso é uma força perpendicular ao deslocamento.
C) Assim, o aumento do módulo da velocidade do conjunto [, no intervalo de tempo considerado,] resulta do trabalho realizado pelas (ou da ação das) forças não conservativas que atuam no conjunto.
D) [Consequentemente, no intervalo de tempo considerado,] a soma dos trabalhos realizados pelas forças não conservativas que atuam no conjunto é positiva.

- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
3.3. Nos esquemas seguintes, está representado o conjunto B, que se move da esquerda para a direita.
Em qual dos esquemas se encontram representados o vetor resultante das forças, F , que atuam nesse conjunto e o vetor aceleração, a , no intervalo de tempo [0, t2 ]?

- Opção (D)
⇒ A aceleração tem a mesma direção e o mesmo sentido da resultante das forças.
⇒ Como a velocidade diminui, a aceleração tem sentido contrário à velocidade (vetor com o sentido do movimento).
- Opção (D) ……………. 5 pontos
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
4. Considere que um dos conjuntos, de massa 80 kg e inicialmente com uma velocidade de módulo 6,0 m s-1, percorre, num outro troço retilíneo da pista, 100 m em 20 s, sob a ação de uma força de travagem constante.
Determine a intensidade da resultante das forças que atuam no conjunto, no intervalo de tempo considerado.
Admita que essa resultante se mantém constante.
Apresente todas as etapas de resolução.
- Da equação do movimento pode determinar-se a componente escalar da aceleração:

Usando a 2.a Lei de Newton, obtém-se a intensidade da resultante das forças:

ou
⇒ O conjunto bicicleta + ciclista tem movimento retilíneo e está sujeito a um sistema de forças de resultante constante, logo, move-se com aceleração constante, de componente escalar a segundo a direção do movimento.
Assim, a componente escalar do seu deslocamento obedece à relação x = x0 + v0t + ½at2.
⇒ O ciclista desloca-se 100 m em 20 se a componente escalar, segundo Ox, da sua velocidade inicial é 6,0 ms-1 , portanto:
- 100 = 6,0 x 20 + ½ x a x 202
Logo, a= -0,100 m s-2. Da Segunda Lei de Newton obtém-se o módulo da resultante das forças:
- Fr = m x a = 80 kg x 0,100 m s-2 = 8,0 N.
- Etapas de resolução:
A) Cálculo do módulo da aceleração do conjunto, no intervalo de tempo considerado (a = 0,100 m s-2) (ver nota 1) …….. 5 pontos
B) Cálculo da intensidade da resultante das forças que atuam no conjunto, no intervalo de tempo considerado (F = 8,0 N) (ver nota 2) …….. 5 pontos
Notas:
1. A apresentação do valor «- 0,100 m s-2» não implica qualquer desvalorização.
2. A apresentação do valor «- 8,0 N» corresponde a um erro de tipo 2.
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
5. Um dos conjuntos descreve, num outro intervalo de tempo, um arco de circunferência, com velocidade de módulo constante.
Conclua, com base na caracterização do vetor velocidade, relativamente à trajetória descrita, se a aceleração do conjunto é, ou não, nula, no intervalo de tempo considerado.
Apresente num texto a fundamentação da conclusão solicitada.
⇒ A velocidade é, em cada ponto, tangente à trajetória.
⇒ Como a trajetória é curvilínea a direção das tangentes à trajetória varia continuamente, por isso, a velocidade não é constante, dado variar em direção.
⇒ Como há variação de velocidade, a aceleração, taxa temporal de variação da velocidade, não é nula.
- A resposta integra os tópicos de referência seguintes ou outros de conteúdo equivalente:
A) O vetor velocidade é [, em cada ponto,] tangente à trajetória [descrita pelo conjunto].
B) Como a trajetória é circular, [a tangente à trajetória varia continuamente a sua direção, pelo que,] o vetor velocidade muda [continuamente] de direção (ou a velocidade não é constante).
C) [Uma vez que há variação de velocidade,] conclui-se que a aceleração [do conjunto] não é nula [no intervalo de tempo considerado].

GRUPO II
Considere amostras puras de gelo fragmentado, à pressão de 1 atm e à temperatura de fusão (0,0 ºC).
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
1. Admita que uma dessas amostras de gelo se encontrava inicialmente a −10 ºC.
Qual foi a variação de temperatura, expressa em kelvin, dessa amostra, até ficar à temperatura de fusão?
(A) 283 K
(B) 263 K
(C) −10 K
(D) 10 K
- Opção (D)
- ΔT = 0 – (–10 °C) = 10 °C = 273 k – (263 K) = 10 K
ou
⇒ Uma variação de temperatura expressa em grau celsius tem, por definição, o mesmo valor do que expressa em kelvin: Δt = 0 ºC – (- 10 ºC) = 10 ºC ou ΔT = 273 K – 263 K = 10 K
- Opção (D) ……………. 5 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
2. Enquanto uma pequena amostra de gelo se funde, a sua energia interna
(A) mantém-se constante, porque a sua temperatura se mantém constante.
(B) aumenta, porque a sua temperatura aumenta.
(C) mantém-se constante, apesar de a sua temperatura aumentar.
(D) aumenta, apesar de a sua temperatura se manter constante.
- Opção (D)
⇒ Quando ocorre fusão a temperatura mantém-se constante, mas a amostra de gelo recebe energia, aumentando a sua energia interna.
⇒ A energia recebida é utilizada na quebra das ligações intermoleculares (as ligações entre as moléculas de água ficam, em média, menos intensas, ou seja, a energia potencial associada à interação entre as moléculas aumenta).
- Opção (D) ……………. 5 pontos
3. Num recipiente, introduz-se uma amostra de 150 g de gelo, à temperatura de 0,0 ºC, e uma amostra de água, à temperatura de 20,0 ºC.
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
3.1. Determine a massa mínima de água, a 20,0 ºC, que será necessário adicionar à amostra de gelo para que esta apenas se funda, ficando a mistura em equilíbrio térmico à temperatura de 0,0 ºC.
Admita que não há trocas de energia entre a mistura obtida e a sua vizinhança.
A energia necessária à fusão de 1,0 kg de gelo é 3,34 x 105 J.
Apresente todas as etapas de resolução.
⇒ A energia necessária para fundir 1,0 kg de gelo é 3,34 × 104 J, então, para fundir 150 g de gelo a 0°C, é necessária a energia

⇒ Esta energia foi cedida ao gelo pela água inicialmente a 20 °C. A massa mínima dessa água necessária para fundir o gelo pode calcular-se por

ou
⇒ O sistema água + gelo é isolado, portanto, a sua energia interna é constante: a energia cedida pela água líquida ao arrefecer ele 20 ºC a 0 ºC é igual à energia absorvida pelo gelo na fusão,
- Ecedida = Eabsorvida, ou seja, – mágua líquida cΔt = Efusão
A massa mínima de água, a 20 ºC, que é necessário adicionar para a fusão do gelo é

- Etapas de resolução:
A) Cálculo da energia necessária à fusão do gelo (E = 5,1 x 104 J) …….. 5 pontos
B) Cálculo da massa mínima de água que será necessário adicionar à amostra de gelo (m = 0,60 kg) …….. 5 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
3.2. Para que a amostra de água adicionada ao gelo ficasse à temperatura de 20,0 ºC, forneceu-se-lhe energia com uma fonte de 250 W, durante 1,5 minutos.
Neste processo, a energia interna da água aumentou 1,4 x 104 J.
Qual foi o rendimento do processo de aquecimento da água?
(A) 37%
(B) 62%
(C) 2,7%
(D) 70%
- Opção (B) ……………. 5 pontos
GRUPO III
Na Figura, encontra-se representado o gráfico do índice de refração, n, de um vidro SF10, em função do comprimento de onda, λ, da radiação eletromagnética, no vazio.

- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
1. Explique, com base no gráfico, como varia a velocidade de propagação da radiação eletromagnética no vidro SF10, à medida que o comprimento de onda da radiação, no vazio, aumenta.
Apresente num texto a explicação solicitada.
⇒ Na região de comprimentos de onda considerada, à medida que o comprimento de onda, λ, aumenta, o índice de refração, n, do vidro SF10 diminui.
⇒ O índice de refração, n, de um certo meio é inversamente proporcional à velocidade de propagação da luz, v, nesse meio: n =c/v. Assim, se o índice de refração diminui, a velocidade de propagação da luz aumenta.⇒ Na região considerada, a velocidade de propagação da luz, v, aumenta com o comprimento de onda, λ.
- A resposta integra os tópicos de referência seguintes ou outros de conteúdo equivalente:
A) [De acordo com a informação fornecida,] à medida que o comprimento de onda da radiação [, no vazio,] aumenta, o índice de refração do vidro [SF10] diminui.
B) Como o índice de refração [de um meio] é inversamente proporcional à velocidade de propagação da radiação [nesse meio], a velocidade de propagação da radiação [no vidro considerado] aumenta [à medida que o comprimento de onda da radiação, no vazio, aumenta].

2. A Figura representa um feixe de radiação monocromática, de comprimento de onda 588 nm, no vazio, que, propagando-se inicialmente no interior de um paralelepípedo de vidro SF10, incide numa das faces desse paralelepípedo.
Uma parte desse feixe é refletida nessa face, enquanto outra parte passa a propagar-se no ar.

- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
2.1. Qual é o ângulo entre o feixe refletido e a face do paralelepípedo na qual o feixe se refletiu?
⇒ A amplitude do ângulo entre o feixe refletido e a face do paralelepípedo na qual o feixe se refletiu é 65º.
⇒ O ângulo entre o feixe incidente e a normal à superfície de separação vidro-ar (ângulo de incidência), 25º, é igual ao ângulo entre o feixe refletido e essa normal (ângulo de reflexão).
⇒ O ângulo entre o feixe refletido e a face do paralelepípedo na qual o feixe se refletido é complementar do ângulo de reflexão:
- 90º – 25º = 65°
- 65º …………. 5 pontos
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
2.2. Qual é o ângulo de incidência a partir do qual o feixe será totalmente refletido na face do paralelepípedo?
(A) 35,4º
(B) 42,8º
(C) 46,7º
(D) 90,0º
- Opção (A)

ou
Quando a luz se propaga de um meio de maior índice de refração para outro de menor, neste caso, do vidro para o ar, existe um ângulo de incidência limite, αlimite para a ocorrência de refração, ou seja, para o qual o ângulo de refração é 90º.
⇒ Aplicando a Lei d’e Snell-Descartes, nvidro x sinαlimite = nar sin 90º, obtém-se:

- Para ângulos de incidência superiores a 35,4º ocorre reflexão total.
- Opção (A) ……………. 5 pontos
GRUPO IV
A reação que ocorre na titulação de uma solução aquosa de ácido clorídrico com uma solução aquosa de hidróxido de sódio pode ser traduzida por
H3O+ (aq) + OH– (aq) → 2 H2O (l)
Com o objetivo de obter a curva da titulação ácido-base, um grupo de alunos efetuou a titulação de uma amostra de uma solução aquosa de ácido clorídrico, HCl (aq ), com uma solução aquosa de hidróxido de sódio, NaOH (aq ).
Na Figura, está representada uma montagem semelhante à que foi utilizada pelos alunos na referida
No início da titulação, o copo continha 50,0 cm3 de uma solução aquosa de HCl, de concentração 2,00 x 10-4 mol por 1,00 cm3 de solução.
A concentração da solução aquosa de NaOH, utilizada como solução titulante, era 0,400 mol dm-3.
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
- 11ºano – Química – A.l. – 2.1 – Titulação ácido-base
1. O que se designa por curva de titulação?
- Gráfico do pH [da solução resultante da titulação] em função do volume de titulante [adicionado] …………. 5 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
- 11ºano – Química – A.l. – 2.1 – Titulação ácido-base
2. Que volume de solução de NaOH deverá ter sido adicionado à solução de HCl até ao ponto de equivalência da titulação?
(A) 25,0 cm3
(B) 20,0 cm3
(C) 0,500 cm3
(D) 2,00 cm3
- Opção (A) ……………. 5 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
- 11ºano – Química – A.l. – 2.1 – Titulação ácido-base
3. No ponto de equivalência da titulação,
(A) existirá uma quantidade de iões H3O+ (aq ) superior à de iões OH– (aq ).
(B) não existirá qualquer quantidade de iões H3O+ (aq ) nem de iões OH– (aq ).
(C) existirão quantidades iguais de iões H3O+ (aq ) e de iões OH– (aq ).
(D) existirá uma quantidade de iões OH– (aq ) superior à de iões H3O+ (aq ).
- Opção (C)
⇒ Numa titulação ácido forte-base forte, a solução resultante no ponto de equivalência é neutra (as concentrações dos iões H3O+ e OH– são iguais, logo, também as respetivas quantidades) e, a 25 ºC, o pH no ponto de equivalência é 7,0.
- Opção (C) ……………. 5 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
- 11ºano – Química – A.l. – 2.1 – Titulação ácido-base
4. Para obter a curva de titulação, é necessário continuar a adicionar a solução titulante depois de atingido o ponto de equivalência da titulação.
Considere que, à solução inicial de HCl, foi adicionado um volume total de 40,0 cm3 de solução de NaOH, admitindo-se, assim, que o volume total da solução resultante era 90,0 cm3.
Determine o pH, a 25 ºC, da solução resultante.
Apresente todas as etapas de resolução.
- Etapas de resolução:
A) Cálculo da quantidade de H3O+ (aq) na solução inicial (1,000 x 102 mol) …….. 2 pontos
B) Cálculo da quantidade de OH– (aq) adicionada (1,600 x 10-2 mol) …….. 2 pontos
C) Cálculo da quantidade de OH– (aq) em excesso na solução resultante da titulação (6,00 x 10-3 mol) …….. 5 pontos
D) Cálculo da concentração de OH– (aq) na solução resultante (6,67 x 10-2 mol dm-3) …….. 2 pontos
E) Cálculo do pH da solução resultante (12,82) …….. 4 pontos
ou
A) Cálculo do volume de titulante adicionado até ao ponto de equivalência da titulação (V = 25,0 cm3) …….. 2 pontos
B) Cálculo do volume de titulante adicionado em excesso (V = 15,0 cm3) …….. 2 pontos
C) Cálculo da quantidade de OH– (aq) adicionada em excesso (6,00 x 10-3 mol) …….. 5 pontos
D) Cálculo da concentração de OH– (aq) na solução resultante (6,67 x 10-2 mol dm-3) …….. 2 pontos
E) Cálculo do pH da solução resultante (12,82) …….. 4 pontos
GRUPO V
Considere que, num reator com a capacidade de 1,00 L, se misturaram 0,80 mol de um reagente A (g) com 1,30 mol de um outro reagente B (g), que reagiram entre si, formando-se os produtos C (g) e D (g). Esta reação pode ser traduzida porA (g) + 2 B (g) ⇋ C (g) + D (g)
Depois de atingido o equilíbrio, à temperatura T, verificou-se que existiam no reator 0,45 mol de C ( g ).- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
1. Determine a constante de equilíbrio, Kc , da reação considerada, à temperatura T.
Apresente todas as etapas de resolução.
A (g) + 2 B (g) ⇋ C (g) + D (g)

⇒ As quantidades de equilíbrio das espécies C (g) e D (g) é:
- x = 0,45 mol
⇒ A quantidade de equilíbrio da espécie A (g) é:
- 0,80 – x = 0,80 – 0,45 = 0,35 mol
⇒ A quantidade de equilíbrio da espécie B (g) é:
- 1,30 – 2x = 1,30 – (2 x 0,45) = 0,40 mol
Como o volume é 1,00 L, as concentrações das diferentes espécies são numericamente iguais às suas quantidades.
⇒ A constante de equilíbrio é:

- Etapas de resolução:
A) Determinação das quantidades de equilíbrio das espécies A e D (ne,A = 0,35 mol; ne,D = 0,45 mol) …….. 2 pontos
B) Determinação da quantidade de equilíbrio da espécie B (ne,B = 0,40 mol) …….. 4 pontos
C) Cálculo da constante de equilíbrio da reação considerada (Kc = 3,6) …….. 4 pontos
- 11ºano – Química – Domínio 1 – subdomínio 1 (Aspetos quantitativos das reações químicas)
2. Determine o rendimento da reação, nas condições consideradas.
Apresente todas as etapas de resolução.
⇒ De acordo com a estequiometria da reação, 1 mol de A é estequiometricamente equivalente a 2 mol de B.
⇒ Para reagir completamente com 0,80 mol de A, seriam necessários 2 × 0,80 mol = 1,60 mol de B.
⇒ Como há apenas 1,30 mol de B, este é o reagente limitante.
⇒ Se 1,30 mol de B reagissem totalmente, seriam produzidos 1,30/2 = 0,65 mol de C.
⇒ Consequentemente, o rendimento da reação, em percentagem, foi:
- η(%) = (0,45/0,65) × 100 = 69%
- Etapas de resolução:
A) Cálculo da quantidade de C (ou de D) que se formaria a partir do reagente limitante, B, se a reação fosse completa (n = 0,6500 mol) …….. 5 pontos
B) Cálculo do rendimento da reação, nas condições consideradas (η = 69 %) …….. 5 pontos
GRUPO VI
1. Considere uma mistura gasosa constituída por 76,5% (m/m) de nitrogénio, N2 ( g ), e por 23,5% (m/m) de oxigénio, O2 ( g ).
Na Figura 5, está representado um gráfico do volume, V, ocupado por um gás ideal (como é o caso da mistura gasosa considerada) em função da quantidade, n, de gás, a 20 ºC e 1 atm.

- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
1.1. Qual é o significado físico do declive da reta representada?
- Volume molar [de um gás (ideal), a 20 °C e 1 atm] …………. 5 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
1.2. Calcule a massa volúmica da mistura gasosa, a 20 ºC e 1 atm.
Apresente todas as etapas de resolução.
⇒ A massa volúmica determina-se pelo quociente entre a massa da mistura e o volume que ela ocupa, ρ = m/V .
- Em 100 g da mistura, há 76,5 g de N2 (g) e 23,5 g de O2 (g).
⇒ A estas massas correspondem as quantidades:
⇒ Para a quantidade total, (2,73 + 0,73) mol = 3,46 mol, pode ler-se no gráfico o volume de 84 dm3
- ρ = 100/84 = 1,2 dm–3.
- Etapas de resolução:
A) Cálculo da quantidade de um dos gases (N2 ( g ) ou O2 (g)) numa determinada massa da mistura gasosa
ou
- Cálculo da massa de mistura gasosa que contém uma determinada quantidade de um dos gases (N2 (g) ou O2 (g)) …….. 2 pontos
B) Cálculo da quantidade do outro gás na mesma massa da mistura gasosa …….. 2 pontos
C) Determinação do volume ocupado pela massa considerada da mistura gasosa …….. 3 pontos
D) Cálculo da massa volúmica da mistura gasosa, nas condições de pressão e de temperatura consideradas (ρ = 1,2 g dm-3) ……… 3 pontos
ou
A) Cálculo da massa de mistura gasosa que contém uma determinada quantidade de moléculas …….. 4 pontos
B) Determinação do volume ocupado pela massa considerada da mistura gasosa …….. 3 pontos
C) Cálculo da massa volúmica da mistura gasosa, nas condições de pressão e de temperatura consideradas (ρ = 1,2 g dm-3) ……… 3 pontos
- 10ºano – Química – Domínio 1 – subdomínio 1 (Massa e tamanho dos átomos)
2. Uma amostra pura de 100 g de N2 (g conterá, no total, cerca de
(A) 2,15 x 1024 átomos.
(B) 3,37 x 1023 átomos.
(C) 4,30 x 1024 átomos.
(D) 1,69 x 1023 átomos.
- Opção (C)
- M(N2) = 2 × 14,01 g mol–1 = 28,02 g mol–1
⇒ O número de moléculas em 100 g N2 é:
- N = nNA = (m/M) x NA = (100/28,02 ) × 6,02 × 1023 mol–1 = 2,148 × 1024
⇒ Cada molécula tem 2 átomos, logo, o número de átomos em 100 g de N2 é :
- 2 × 2,148 × 1024 = 4,30 × 1024
- Opção (C) ……………. 5 pontos
- 11ºano – Química – Domínio 2 – subdomínio 2 (Reações de oxidação redução)
3. O nitrogénio, N2 (g), e o oxigénio, O2 (g), reagem entre si a temperaturas elevadas, formando-se óxido de nitrogénio, NO (g), uma substância poluente.
A reação de formação do NO (g) pode ser traduzida por
N2 (g) + O2 (g) ⇋ 2 NO (g)
Nesta reação, o agente redutor é o
(A) N2 (g), sendo a variação do número de oxidação do átomo de nitrogénio +2.
(B) N2 (g), sendo a variação do número de oxidação do átomo de nitrogénio -2.
(C) O2 (g), sendo a variação do número de oxidação do átomo de oxigénio +2.
(D) O2 (g), sendo a variação do número de oxidação do átomo de oxigénio -2.
- Opção (A)
⇒ O número de oxidação do oxigénio diminui de 0 para –2, então, reduz-se, logo, é o oxidante.
⇒ O de nitrogénio aumenta de 0 para +2, consequentemente, oxida-se e o N2 é o redutor.
- Opção (A) ……………. 5 pontos
GRUPO VII
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
1. Na representação da molécula de N2 na notação de Lewis, quantos eletrões, no total, devem estar representados?
- 10 eletrões
⇒ O nitrogénio, Z = 7, com configuração eletrónica no estado fundamental 1s2 2s2 2p3, tem 5 eletrões de valência.
⇒ Na notação de Lewis representam-se os eletrões dos dois átomos.
⇒ Um traço representa um par de eletrões partilhados e cada ponto representa um dos eletrões de valência não partilhados.
- 10 [eletrões.] …………. 5 pontos
- 10ºano – Química – Domínio 2 – subdomínio 3 (Transformações químicas)
2. A energia, transferida como calor, necessária para dissociar 1 mol de moléculas de N2 (g), a pressão constante, é 945 kJ.
A variação de entalpia associada à obtenção de 4 mol de átomos de nitrogénio, em fase gasosa, a partir de 2 mol de N2 (g) é
(A) + (4 x 945) kJ
(B) – (4 x 945) kJ
(C) + (2 x 945) kJ
(D) – (2 x 945) kJ
- Opção (C)
⇒ Por convenção considera-se positiva a energia recebida.
⇒ Para a obtenção de 2 mol de átomos, por decomposição da molécula, tem-se
- N2 (g) → 2 N (g); ΔH = + 945 kJ
⇒ Para 4 mol de átomos são +2 × 945 kJ
- Opção (C) ……………. 5 pontos
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
3. Os eletrões de valência do átomo de nitrogénio, no estado fundamental, encontram-se distribuídos por
(A) duas orbitais, uma das quais apresenta menor energia do que a outra.
(B) quatro orbitais, uma das quais apresenta menor energia do que as outras.
(C) quatro orbitais, apresentando todas a mesma energia.
(D) duas orbitais, apresentando ambas a mesma energia.
- Opção (B)
⇒ O nitrogénio, Z = 7, com configuração eletrónica no estado fundamental 1s2 2s2 2px1 2py1 2pz1, tem os 5 eletrões de valência distribuídos por quatro orbitais.
⇒ A orbital 2s apresenta menor energia do que as orbitais 2p.
- Opção (B) ……………. 5 pontos
- 10ºano – Química – Domínio 1 – subdomínio 1 (Massa e tamanho dos átomos)
4. Um dos dois isótopos naturais do nitrogénio tem número de massa 15.
Quantos neutrões existem, no total, no núcleo de um átomo desse isótopo?
(A) 7 neutrões.
(B) 8 neutrões.
(C) 14 neutrões.
(D) 15 neutrões.
- Opção (B)
- Opção (B) ……………. 5 pontos
- 10ºano – Química – Domínio 1 – subdomínio 3 (Tabela periódica)
5. Qual é o elemento do 2.º período da tabela periódica cujos átomos, no estado fundamental, apresentam menor raio atómico?
- Néon ou Ne.
⇒ Na tabela Períodica, há uma tendência geral para a diminuição do raio atómico ao longo de um período (linha horizontal).
- Néon ou Ne …………. 5 pontos
FIM









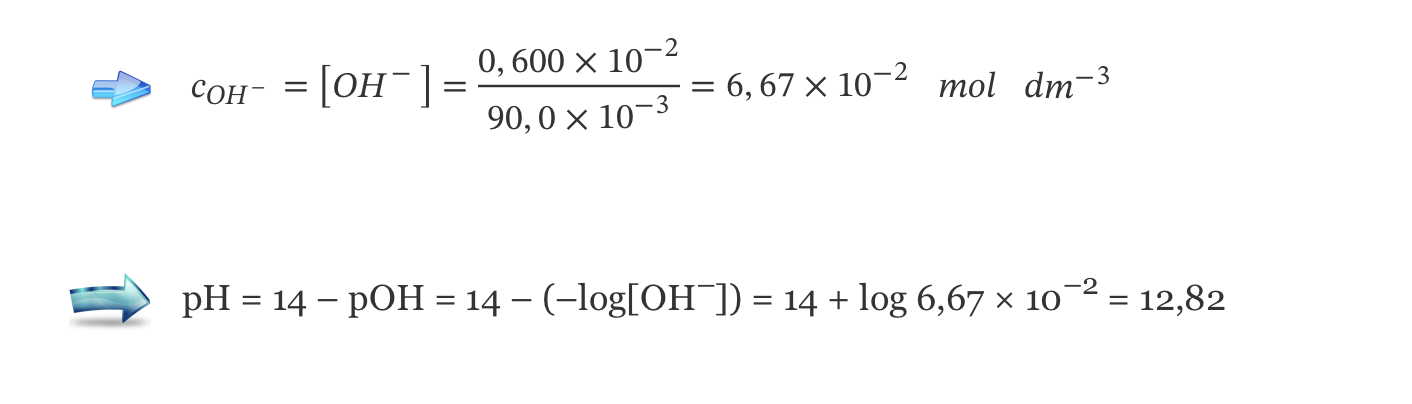


Boa noite.
No exercício 1.2) do grupo VI, eu somei as massas molares do N2 e do O2 e depois dividi as 100g por esse valor, mas não deu o mesmo resultado, não posso fazer assim?
Obrigada!