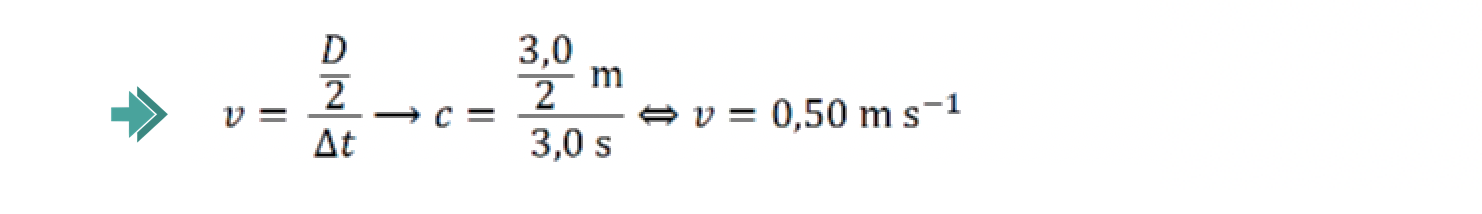2022 – 1ªFase – Prova Escrita de FQ A
Voltar a: Física e Química
Prova Escrita de Física e Química A – versão 1
Prova 715: 1.ª Fase – 2022
A prova inclui 16 itens, devidamente identificados no enunciado, cujas respostas contribuem obrigatoriamente para a classificação final.
Dos restantes 8 itens da prova, apenas contribuem para a classificação final os 4 itens cujas respostas obtenham melhor pontuação.
1. Em 2020, foi enviada mais uma sonda espacial ao planeta Marte, integrada na missão Mars 2020. Essa sonda transportou, pela primeira vez na história da exploração espacial, um pequeno helicóptero.
Fazer voar um helicóptero em Marte foi um desafio. Os engenheiros sabiam que a aceleração gravítica de Marte, aproximadamente 1/3 da terrestre, ajudaria na descolagem, mas a sua atmosfera rarefeita iria tornar mais difícil a sustentação. Assim, o pequeno helicóptero, de 1,8 kg de massa, foi construído com duas hélices de 1,2 m de diâmetro, que rodam, em direções opostas, a 2400 rotações por minuto.
https://mars.nasa.gov (consultado em 18/10/2021). (Texto adaptado)
1.1. Com os dados do altímetro, os engenheiros confirmaram o sucesso do primeiro voo de teste, em que o helicóptero apenas efetuou uma trajetória vertical.
Na Figura 1, encontra-se representado o gráfico da altitude do helicóptero, y, em função do tempo, t.
https://mars.nasa.gov/resources/25820/altimeter-chart-for-ingenuitys-first-flight
(consultado em 01/05/2021). (Adaptado)
Considere que o helicóptero pode ser representado pelo seu centro de massa (modelo da partícula material).
- 11ºano – Física – Domínio 1 – subdomínio 1 (Tempo, posição e velocidade)
1.1.1. O gráfico da Figura 1 permite concluir que,
(A) entre 0 e t1 , o helicóptero se afastou do ponto de partida.
(B) entre t1 e t2 , o movimento do helicóptero foi uniformemente acelerado.
(C) entre t2 e t3 , o helicóptero descreveu uma trajetória retilínea.
(D) entre 0 e t4 , ocorreu uma inversão no sentido do movimento do helicóptero.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (D) ……………. 10 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
1.1.2. Em Marte, o trabalho realizado pela força gravítica que atua no helicóptero, no deslocamento entre a posição inicial e a altitude máxima,
(A) 54 J.
(B) 18 J.
(C) -18 J.
(D) – 54 J.
- Opção (C) ……………. 10 pontos
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
1.1.3. Considere uma parte do percurso em que o helicóptero se move com velocidade constante.
Qual das opções pode representar, na mesma escala, as forças que atuam no helicóptero:
a força de sustentação gerada pela rotação das hélices, Fs , e a força gravítica, Fg ?
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (B)
⇒ A opção que pode representar, na mesma escala, as forças que atuam no helicóptero: a força de sustentação gerada pela rotação das hélices, Fs, e a força gravítica, Fg é:
Notas:
⇒ Se a velocidade é constante, a resultante das forças é nula.
⇒ Uma vez que se considera que as únicas forças que atuam no helicóptero são Fg e Fs, tem-se:
- Fg + Fs = 0 ⇔ Fg = – Fs
- Opção (B) ……………. 10 pontos
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
1.2. Qual das expressões seguintes permite calcular, em m s-1, o módulo da velocidade de um ponto na extremidade de uma hélice do helicóptero?
- Opção (C)
⇒ A expressão que permite calcular o módulo da velocidade de um ponto na extremidade de uma hélice do helicóptero é:
Notas:
⇒ Sendo a frequência, f, 2400 rotações/minuto, ou seja:
⇒ Sendo v = ω r, em que ω é o módulo da velocidade angular, que está relacionado com o período, T, pela expressão seguinte:
- r o raio da trajetória descrita por um ponto da extremidade da hélice (metade do diâmetro), vem :
- Opção (C) ……………. 10 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
1.3. A entrada da sonda na atmosfera de Marte foi uma das fases críticas da missão.
A interação da sonda com a atmosfera provocou um aumento significativo da temperatura do seu revestimento.
Numa aproximação à situação real, esquematiza-se na Figura 2, que não está à escala, uma parte de um percurso retilíneo da sonda ao entrar na atmosfera marciana, entre a posição A e a posição B.
Admita que, sobre a sonda, atuam três forças constantes: a força gravítica, Fg , uma força perpendicular à trajetória, F , e a força de arrasto (força de atrito aerodinâmico), Fa.
Admita que a sonda, de massa 1050 kg , passa pela posição A com uma velocidade de 16 500 km h-1 e descreve uma trajetória que faz um ângulo de 80º com a vertical.
Considere que, no percurso entre A e B:
– a sonda perde 55% da sua energia cinética inicial;
– a intensidade da força de arrasto é, em média, 30 vezes superior à da força gravítica.
Determine a distância percorrida, d.
Apresente todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
⇒ Cálculo da variação de energia cinética, ΔEc:
em que m é a massa da sonda e vA o módulo da velocidade em A.
- Substituindo, vem:
⇒ Expressão do trabalho realizado pela força gravítica ( ou da variação de energia potencial gravítica do sistema sonda + Marte):
em que m é a massa da sonda, g a aceleração da gravidade à superfície da Terra.
- O desnível entre as posições A e B, hA – hB, relaciona-se com a distância percorrida pela expressão hA – hB = d cos 80º
⇒ Expressão do trabalho realizado pela força de arrasto, Fa, considera constante:
⇒ Determinação de d usando o Teorema de Energia cinética:
- Uma vez que WF é nulo, pois a força F é perpendicular à velocidade, temos:
ou
⇒ Determinação do módulo da aceleração (considerada constante), usando a Lei Fundamental da Dinâmica:
⇒ Cálculo do módulo da velocidade em cada uma das posições A e B :
⇒ Dedução da expressão vB2 = vA2 – 2ad :
- Admitindo que o movimento é retilíneo uniformemente retardado, no sentido positivo, tem-se:
⇒ Substituindo e cálculo de d:
- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Explicita que WFa + WF + WFg = ΔEc (ver nota 1) …….. 2 pontos
⇒ Calcula a variação da energia cinética da sonda no percurso entre A e B ( – 6,07 x 109 J ) (ver nota 1) …….. 2 pontos
⇒ Calcula o trabalho realizado pela força gravítica (608 d J) (ver notas 1 e 2) ……… 3 pontos
⇒ Calcula a distância percorrida pela sonda no percurso entre A e B (5,8 x 104 m) ……… 3 pontos
Notas:
1. A ordem das três primeiras etapas é arbitrária.
2. No caso de ser utilizado g = 10 m s-2, considera-se um erro de tipo 2.
2. Para preparar uma futura expedição a Marte, na missão Mars 2020 seguiu o módulo MOXIE. Este dispositivo foi concebido para testar, pela primeira vez, a produção local de dioxigénio, O2 , a partir do dióxido de carbono, CO2 , existente na atmosfera marciana, de acordo com as semirreações traduzidas por
(1) CO2 + 2 e– → CO + O2-
(2) 2 O2- → 4 e– + O2
- 11ºano – Química – Domínio 2 – subdomínio 2 (Reações de oxidação redução)
2.1. Na semirreação representada em (1), a variação do número de oxidação do carbono é
(A) +2, sendo o CO2 a espécie oxidante.
(B) -2, sendo o CO2 a espécie oxidante.
(C) +2, sendo o CO2 a espécie redutora.
(D) -2, sendo o CO2 a espécie redutora.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (B)
⇒ A semiequação seguinte, corresponde a uma semirreação de redução (ganho de eletrões; variação negativa do número de oxidação), pelo que CO2 é a espécie oxidante.
⇒ Cálculo da variação do número de oxidação do carbono:
⇒ Cálculo da variação do número de oxidação do carbono:
- CO2
n.o. (C) + 2 x n.o. (O) = 0 ⇔ n.o. (C) + (-2) x 2 = 0 ⇔ n.o. (C) = +4
- CO
n.o. (C) + n.o. (O) = 0 ⇔ n.o. (C) + (-2) = 0 ⇔ n.o. (C) = +2
- Δn.o. (C) = +2 – (+4) = -2 ⇒ redução
- Opção (B) ……………. 10 pontos
- 11ºano – Química – Domínio 1 – subdomínio 1 (Aspetos quantitativos das reações químicas)
2.2. Calcule o número de módulos MOXIE necessários para produzir 1000 kg de O2 em 365 dias.
Considere que o módulo MOXIE consegue retirar, por hora, 16,70 g de CO2 da atmosfera marciana e que a transformação de CO2 em O2 tem um rendimento de 50%.
Admita que a duração de um dia em Marte é aproximadamente igual à de um dia terrestre.
Apresente todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
⇒ Equação química que traduz a reação de eletrólise do dióxido de carbono.
- Semiequação de redução:
(CO2 + 2 e– → CO + O2- ) x 2
- Semiequação de oxidação:
2 O2- → 4 e– + O2
- Equação global:
2 CO2 → 2 CO + O2
⇒ Calcular a quantidade de matéria de O2 que seria obtida durante 1 h, usando 1 módulo, se o rendimento fosse de 100 % :
⇒ Calcular a quantidade de matéria de O2 obtida durante 1 h usando a equação de definição de rendimento:
⇒ Calcular a massa de O2 obtida durante 1 h usando 1 módulo:
⇒ Calcular a massa de O2 obtida durante 365 dias usando 1 módulo:
⇒ Calcular o número de módulos MOXIE, x:
Este item pode ser resolvido por, pelo menos, dois processos.
- 1.º Processo
Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a quantidade de O2 que poderia ser obtida, por hora, se toda a massa de CO2 reagisse completamente (0,190 mol) …….. 4 pontos
⇒ Calcula a quantidade de O2 que é obtida por hora (0,0950 mol) …….. 3 pontos
⇒ Calcula o número de módulos MOXIE necessários (38) (ver nota) ……… 3 pontos
- 2.º Processo
Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a massa de O2 que poderia ser obtida, por hora, se toda a massa de CO2 reagisse completamente (6,07 g) …….. 4 pontos
⇒ Calcula a massa de O2 que é obtida por hora (3,04 g) …….. 3 pontos
⇒ Calcula o número de módulos MOXIE necessários (38) (ver nota) ……… 3 pontos
Notas:
- A apresentação do resultado 37,6 implica a desvalorização de 2 pontos.
3. A procura de vida extraterrestre envolve a deteção de substâncias cuja existência pode ser indicadora da presença de vida.
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
3.1. O metano, CH4 , é uma dessas substâncias e já foi detetado em Marte.
A molécula de CH4 apresenta geometria
(A) piramidal trigonal e é polar.
(B) tetraédrica e é polar.
(C) piramidal trigonal e é apolar.
(D) tetraédrica e é apolar.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (D)
⇒ O metano apresenta quatro ligações covalentes simples entre o átomo central de carbono e os quatro átomos de hidrogénio.
⇒ A repulsão entre os pares de eletrões ligantes é minimizada assumindo, a molécula, uma geometria tetraédrica, onde o átomo de carbono assume a posição central e os átomos de hidrogénio se situam nos vértices do tetraedro.
⇒ As ligações carbono-hidrogénio são ligeiramente polares, mas, dada a simetria da molécula, as moléculas de metano são apolares.
⇒ A situação pode ser ilustrada na figura seguinte.
- Opção (D) ……………. 10 pontos
- 10ºano – Química – Domínio 1 – subdomínio 1 (Massa e tamanho dos átomos)
3.2. A descoberta da origem do metano, CH4 (M = 16,05 g mol-1), em Marte irá, provavelmente, requerer medições isotópicas.
No planeta Terra, o carbono apresenta dois isótopos estáveis, o carbono-12 (12C) e o carbono-13 (13C).
A fração molar do isótopo 13C no carbono é 0,0108.
Calcule o número de átomos do isótopo carbono-13 presentes numa amostra de 1000 g de CH4 terrestre.
Apresente todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a quantidade de C presente em 1000 g de CH4 (62,31 mol) …….. 3 pontos
⇒ Calcula a quantidade de 13C presente em 1000 g de CH4 (0,6729 mol) …….. 4 pontos
⇒ Calcula o número de átomos de 13C presentes em 1000 g de CH4 (4,05 x 1023 átomos ) ……… 3 pontos
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
3.3. Num átomo de carbono, no estado fundamental, existem
(A) quatro eletrões de valência distribuídos por duas orbitais.
(B) quatro eletrões de valência distribuídos por três orbitais.
(C) dois eletrões de valência distribuídos por duas orbitais.
(D) dois eletrões de valência distribuídos por uma orbital.
- Opção (B)
⇒ O átomo de carbono apresenta seis eletrões.
⇒ Aplicando o Princípio da Energia Mínima (estado fundamental) e obedecendo ao Princípio da Exclusão de Pauli e à Regra de Hund, os eletrões encontram-se distribuídos como se encontra representado pela configuração eletrónica (complementada pelo diagrama de caixas) seguinte:
⇒ O nível de valência é o segundo (último nível energético ocupado, no estado fundamental), com quatro eletrões, distribuídos por três orbitais.
⇒ Existem 4 orbitais de valência (2º nível), das quais uma está completamente preenchida (o nº máximo de eletrões por orbital é 2); duas semipreenchidas e uma vazia.
- Opção (B) ……………. 10 pontos
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
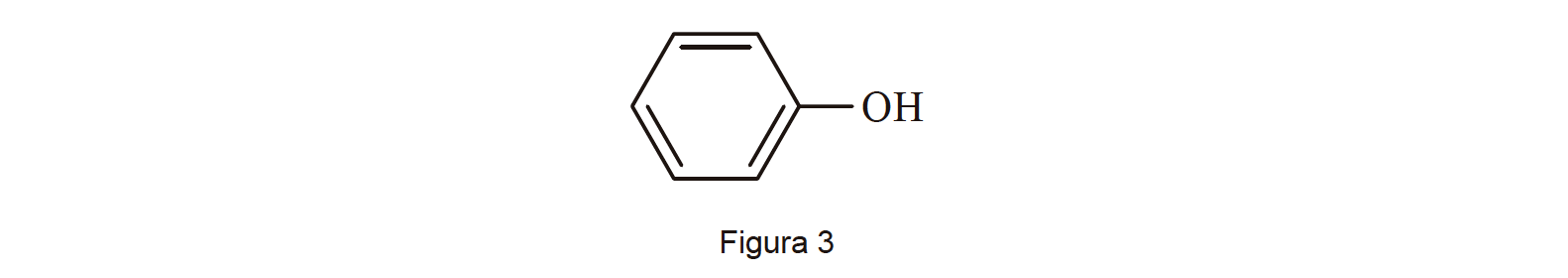
3.4. Na Figura 3, está representada a fórmula de estrutura da molécula de uma substância presente no solo marciano.
Esta substância pertence à familia
(A) dos aldeídos.
(B) das aminas.
(C) das cetonas.
(D) dos álcoois.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (D)
⇒ O grupo hidroxilo, OH, é o grupo caraterístico dos álcoois e dos fenóis.
- Em bom rigor, o composto apresentado é Fenol ordinário (ou ácido fénico ou hidroxibenzeno).
⇒ No contexto do item, a escolha mais adequada será a opção D, família dos álcoois.
- Opção (D) ……………. 10 pontos
4. Um navio transporta metano, CH4 (M = 16,05 g mol-1), acondicionado em tanques. Um tanque na sua capacidade máxima contém 1,17 x 105 kg de CH4 liquefeito. O CH4 liquefeito tem massa volúmica de 0,4241 g cm-3.
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
4.1. Calcule a massa máxima de CH4 que seria possível transportar num tanque, caso esta substância se encontrasse no estado gasoso, em condições PTN.
Apresente todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
Este item pode ser resolvido por, pelo menos, dois processos.
- 1.º Processo
Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula o volume do tanque (2,759 x 105 dm3) …….. 4 pontos
⇒ Calcula a massa de CH4, em condições PTN, que será possível transportar no tanque (1,98 x 105 g) …….. 6 pontos
- 2.º Processo
Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Deduz a expressão:
- (ou equivalente) …….. 6 pontos
⇒ Calcula a massa de CH4, em condições PTN, que será possível transportar no tanque (1,98 x 105 g) …….. 4 pontos
4.2. A reação do CH4 com o dioxigénio, O2 , em fase gasosa, é traduzida por
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (g) ΔH = -890 kJ
- 10ºano – Química – Domínio 2 – subdomínio 3 (Transformações químicas)
4.2.1. Na reação completa do CH4 proveniente do tanque do navio de transporte, são
(A) libertados 6,49 x 1012 J de energia.
(B) libertados 8,90 x 105 J de energia.
(C) consumidos 8,90 x 105 J de energia.
(D) consumidos 6,49 x 1012 J de energia.
- Opção (A)
⇒ Determinação da quantidade de matéria de CH4:
⇒ Classificação da reação do ponto de vista energético:
- ΔH <0 ⇒ a reação é exotérmica. Logo, há libertação de energia.
⇒ Cálculo da energia libertada:
Nota: O calculo refere-se à reação completa da massa referente ao tanque do navio transportando o máximo volume possível, ou seja, na sua capacidade.
- Opção (A) ……………. 10 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
4.2.2. O dióxido de carbono, CO2 , ao reagir com a água da chuva, origina um ácido fraco, o ácido carbónico, H2CO3.
A primeira ionização do ácido carbónico em água pode ser traduzida por
H2CO3 (aq) + H2O (l) HCO3– (aq) + H3O+ (aq)
Quais são as duas espécies que resultam da segunda ionização do ácido carbónico em água?
(A) CO2 e OH–
(B) H3O+ e CO2
(C) CO23- e OH–
(D) H3O+ e CO23-
- Opção (D) ……………. 10 pontos
5. Nas imediações de um lago, um vulcão entra em erupção, com libertação de grandes quantidades de dióxido de enxofre, SO2 . Este gás reage com o dioxigénio atmosférico, O2 , transformando-se em trióxido de enxofre, SO3 .
Em sistema fechado, esta reação pode ser traduzida por
2 SO2 (g) + O2 (g) 2 SO3 (g)
5.1. O gráfico da Figura 4 representa o rendimento da reação de formação do SO3 , a diferentes temperaturas, θ , em equilíbrio, à pressão de 1 atmosfera, em sistema fechado.
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
5.1.1. A reação considerada, no sentido direto, é _____, e a constante de equilíbrio à temperatura de 800 ºC é _____ à constante de equilíbrio à temperatura de 400 ºC.
(A) exotérmica … inferior
(B) endotérmica … inferior
(C) exotérmica … superior
(D) endotérmica … superior
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (A)
⇒ O gráfico mostra que, à pressão de 1 atm e em sistema fechado, aumentando a temperatura, a percentagem de conversão em SO3 (g) diminui, o que significa que um aumento de temperatura favorece a reação inversa.
⇒ Como o aumento de temperatura favorece a reação endotérmica concluindo-se, assim, que a reação direta é exotérmica.
⇒ Para uma reação química exotérmica, quanto mais elevada for a temperatura, menor é constante de equilíbrio.
- Opção (A) ……………. 10 pontos
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
5.1.2. Preveja, de acordo com o princípio de Le Châtelier, o que aconteceria ao rendimento de
formação de SO3 se, a uma temperatura constante, a pressão aumentasse.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
⇒ Se durante o processo, a temperatura permanecer constante, não há alteração do valor da constante de equilíbrio.
⇒ Considerando a equação química 2 SO2 (g)+O2 (g) ⇌ 2 SO3 (g), conclui-se que, para este sistema reacional em que todos os componentes são gasosos, o somatório dos coeficientes estequiométricos nos reagentes (1º membro) — igual a 3 — e superior ao somatório dos coeficientes estequiométricos nos produtos de reação (2º membro) — igual a 2.
⇒ Assim, o aumento de pressão (por diminuição da capacidade do reator, por exemplo) favorece a reação direta, ou seja, a que origina menor número de moléculas gasosas, pois, de acordo com a Lei de Avogadro, a pressão de uma mesma quantidade de qualquer gás é a mesma, à mesma pressão e temperatura.
⇒ Pelo Princípio de Le Châtelier, aumentando a pressão, o sistema reacional vai evoluir de modo a que a pressão baixe, pelo que vai evoluir de modo a quantidade de matéria total — ou o número total de moléculas — no sistema reacional diminua.
⇒ Evoluindo o sistema reacional no sentido da reação direta, ou seja, no sentido da formação de SO3 (g), a percentagem de conversão em SO3 (g) aumenta, o que poder a conduzir a um maior rendimento da reação de formação de SO3 (g).
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
5.2. A erupção de um vulcão pode libertar energia suficiente para vaporizar a água de um lago.
Calcule a energia, em unidades SI, necessária para vaporizar 59 400 m3 de água no estado líquido, à pressão atmosférica normal.
Admita que, nas condições indicadas:
– a massa volúmica da água é 1,00 g cm-3 ;
– a temperatura inicial da água é 18,0 ºC ;
– a entalpia de vaporização da água é 2,26 x 103 kJ/kg-1.
Apresente todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
⇒ Cálculo da energia necessária, 𝐸1, para que, à pressão atmosférica normal, a temperatura da água do lago se eleve de 18,0 ℃ para 100,0 ℃ (considerada o ponto de ebulição):
E1 = c m Δθ
em que 𝑐 é a capacidade térmica mássica da água do lago, 𝑚 a massa da água do lago e Δ𝜃 a variação de temperatura.
- Admite-se que :
‒ durante o processo, a porção de água do lago que se evapora é desprezável;
‒ a capacidade térmica mássica da água do lago é a da água líquida e que permanece constante nesse intervalo de temperaturas;
‒ a 18,0 ℃, a densidade da água do lago é 1,00 g cm−3 (1,00×103 kg m−3)
A massa da água do lago obtém-se usando a equação de definição de densidade.
⇒ Cálculo da energia necessária, 𝐸2, para que, à pressão atmosférica normal, a água do lago passe do estado líquido para o estado gasoso:
E2 = m x Δhvaporização
em que 𝑚 a massa da água do lago e Δℎvaporização a variação de entalpia de vaporização
- 𝐸2 = 5,940 × 107 × 2,26×106 ⇔𝐸2 = 1,342 × 1014 J
⇒ Cálculo da energia total, 𝐸total, envolvida no processo:
- 𝐸total = 𝐸1 + 𝐸2 ⟶ 𝐸total =2,036 × 1013 J + 1,342 × 1014 J ⇔ 𝐸total = 1,55 × 1014 J
- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a energia necessária para elevar a temperatura da água de 18 ºC a 100 ºC (2,036 x 1013) (ver nota) …….. 4 pontos
⇒ Calcula a energia necessária à mudança de estado físico da água (1,342 x 1014 J ) (ver nota) …….. 4 pontos
⇒ Calcula a energia necessária à vaporização de 59 400 m3 de água (1,55 x 1014 J) ……… 2 pontos
Nota:
- A ordem das três primeiras etapas é arbitrária.
- 11ºano – Química – Domínio 2 – subdomínio 3 (Soluções e equilíbrio de solubilidade)
5.3. A cinza vulcânica é responsável pela adição de iões metálicos à água, em lagos e cursos de água.
O hidróxido de ferro (II) é um sal pouco solúvel em água. O seu equilíbrio de solubilidade é expresso por
Fe (OH)2 (s) Fe2+ (aq) + 2 OH– (aq)
O produto de solubilidade, Ks , é 4,10 x 10-15 , à temperatura T.
A solubilidade do hidróxido de ferro(II), em água, à temperatura considerada, é
(A) 1,27 x 10-5 mol dm-3
(B) 6,40 x 10-8 mol dm-3
(C) 1,01 x 10-5 mol dm-3
(C) 3,20 x 10-8 mol dm-3
- Opção (C) ……………. 10 pontos
- 11ºano – Física – Domínio 2 – subdomínio 1 (Sinais e ondas)
5.4. Para prever erupções vulcânicas, os cientistas monitorizam a atividade sísmica com sismógrafos.
Os sismos geram, entre outros tipos de ondas, ondas transversais, S, e ondas longitudinais, P.
O epicentro de um sismo ocorre a 3220 km de uma estação sismográfica, sendo as ondas S detetadas 4,8 minutos depois das ondas P.
Admita uma propagação em linha reta e considere que as velocidades das ondas P e S se mantêm constantes durante o percurso.
A velocidade de propagação das ondas P é 8,0 km s-1. Qual é a velocidade de propagação das ondas S?
(A) 7,9 km s-1
(B) 3,2 km s-1
(C) 4,7 km s-1
(D) 11,2 km s-1
- Opção (C) ……………. 10 pontos
6. Num percurso pedestre no litoral algarvio, um rapaz encontra aos seus pés uma abertura na rocha.
Ao olhar para o seu interior, observa que se trata de uma cavidade de desenvolvimento vertical, de profundidade elevada, sobre a água. Este tipo de cavidades designa-se algar.
Pela abertura do algar, o rapaz deixa cair verticalmente uma pedra, como se representa na Figura 5.
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
6.1. O som da pedra a bater na água é ouvido 3,0 s depois de a pedra ser largada.
Admita que a velocidade do som no ar é 340 m s-1 e que a resistência do ar é desprezável.
Mostre que, para a distância percorrida, h, a razão entre o tempo de queda, tq , da pedra e o tempo de propagação do som, ts , é 24 (tq/ts = 24 ).
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
⇒ Considerando que o som da pedra a bater na água é ouvido 3,0 s depois de a pedra ser largada, tem-se:
tqueda pedra + tsom = 3,0 s
⇒ Considerando o movimento de queda da pedra retilíneo uniformemente acelerado, a altura de queda está relacionada com o tempo de queda da pedra pela equação:
⇒ Sendo a velocidade de propagação do som no ar constante, a altura de queda da pedra pode relacionar-se com 𝑡som pela equação:
⇒ Assim, comparando as equações, temos:
⇒ Assim determinando o quociente entre tqueda pedra e tsom, temos:
- Elementos de resposta:
⇒ considera 3,0 s como o somatório do tempo de queda da pedra e do tempo de propagação do som (tq + ts = 3,0 s);
⇒ identifica o movimento de queda da pedra como retilíneo uniformemente acelerado e a propagação do som como movimento retilíneo uniforme, expressando as respetivas equações (dq = 5 tq2 ; ds = 340 ts );
⇒ considera que a distância percorrida na queda da pedra é igual à distância percorrida pelo som (ou seja, dq = ds = h, pelo que 5 tq2 = 340 ts);
⇒ mostra que tq/ts = 24
- 11ºano – Física – Domínio 2 – subdomínio 1 (Sinais e ondas)
6.2. A queda vertical da pedra na superfície da água origina uma onda circular, tal como se representa na Figura 6.
Na imagem, as zonas mais claras correspondem a cristas, e as zonas mais escuras correspondem a vales.
Admita um diâmetro, D, de 3,0 m.
Entre o instante em que a pedra atinge a água e o instante em que a frente de onda atinge a margem, o intervalo de tempo decorrido é 3,0 s.
A onda que se propaga na água tem
(A) uma frequência de 3,3 Hz.
(B) um comprimento de onda de 0,6 m.
(C) uma frequência de 1,7 Hz.
(D) um comprimento de onda de 1,0 m.
- Opção (C) ……………. 10 pontos
7. Com o objetivo de determinar as características de uma pilha, um grupo de alunos montou um circuito elétrico, constituído por uma pilha, uma resistência variável e um interruptor.
Foram também instalados dois aparelhos de medida (um voltímetro e um amperímetro), tal como se esquematiza na Figura 7.
- 10ºano – Física – subdomínio 2 (Energia e fenómenos elétricos)
7.1. O voltímetro é o aparelho de medida representado por
(A) X e está instalado em paralelo com a pilha.
(B) X e está instalado em série com a pilha.
(C) Y e está instalado em paralelo com a pilha.
(D) Y e está instalado em série com a pilha.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (A) ……………. 10 pontos
- 10ºano – Física – subdomínio 2 (Energia e fenómenos elétricos)
7.2. A força eletromotriz da pilha pode ser determinada antes da montagem do circuito, através de uma única medição direta.
Descreva esse procedimento e explique o seu fundamento.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
⇒ A força eletromotriz da pilha pode ser determinada instalando (em série) um voltímetro, X, nos seus terminais, conforme se ilustra na figura, e fazendo a leitura do valor no voltímetro — uma medição direta.
⇒ A força eletromotriz é a diferença de potencial elétrico nos terminais da pilha em circuito aberto.
⇒ Como a resistência interna do voltímetro é muito elevada (há voltímetros com uma resistência interna de aproximadamente 10 MΩ) quando comparada com a resistência interna da pilha de 9 V, o valor da corrente elétrica que percorre o circuito assim constituído é muito baixa, 𝐼 ≈ 0 A (uma corrente elétrica de aproximadamente 1 μA é desprezável quando comparada com os valores apresentados na tabela do item 7.3.).
⇒ Como a diferença de potencial elétrico nos terminais de uma pilha é dada pela expressão 𝑈 = 𝜀−𝑟 𝐼, nessas condições 𝑈 ≈ 𝜀.
⇒ Assim, o valor lido diretamente nos terminais do voltímetro constitui uma boa aproximação para a força eletromotriz da pilha.
- 10ºano – Física – subdomínio 2 (Energia e fenómenos elétricos)
7.3. Na tabela seguinte, estão registados os valores da diferença de potencial, U, e da corrente elétrica, I, medidos para cada valor de resistência elétrica introduzida no circuito.
Ao traçar o gráfico de U, em função de I, os alunos perceberam que um dos pares de valores experimentais não acompanhava a tendência linear dos restantes. Na determinação das características da pilha, decidiram eliminar esse par de valores.
Apresente as características da pilha, com dois algarismos significativos.
Na resposta:
– identifique o par de valores experimentais que os alunos eliminaram;
– apresente a equação da reta de ajuste ao gráfico de U, em função de I (para os cinco ensaios considerados).
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
⇒ O gráfico correspondente aos seis ensaios:
Pelo gráfico, podemos verificar que o ensaio que deve ser eliminado é o 4.º, ao qual corresponde o par de valores (0,38 A;6,01 V), que se afasta da relação linear encontrada.
⇒ O gráfico correspondente aos 1.º, 2.º, 3.º, 5.º e 6.º ensaios:
⇒ Características da pilha:
As características de uma pilha são: a força eletromotriz (diferença de potencial elétrico nos terminais da pilha em circuito aberto) e a resistência interna.
A diferença de potencial elétrico nos terminais da pilha é dada por:
- 𝑈 = 𝜀−𝑟 𝐼 ⇔ 𝑈 = 8,91 − 4,3 𝐼 (SI)
Assim,
- 𝜀 = 8,9 V (com dois algarismos significativos, conforme o solicitado)
- 𝑟 = 4,3 Ω
- Elementos de resposta:
⇒ identifica o ensaio a eliminar (4.º ensaio);
⇒ apresenta a equação da reta de ajuste ao gráfico U = f (I) ( U = -4,3 I + 8,9 (V) );
⇒ apresenta a força eletromotriz e a resistência interna da pilha (ε = 8,9 V e ri = 4,3 Ω).
Nota :
- Caso seja apresentada a equação da reta de ajuste ao gráfico U = f (I) correta, considera-se que o primeiro elemento de resposta está presente.
FIM

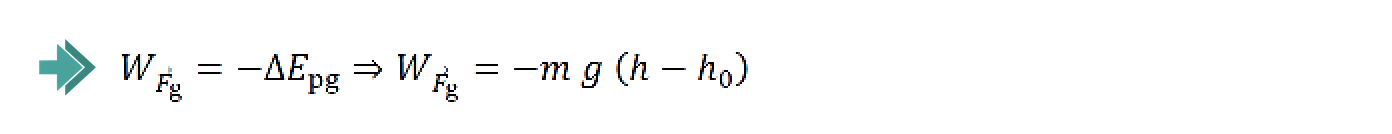


























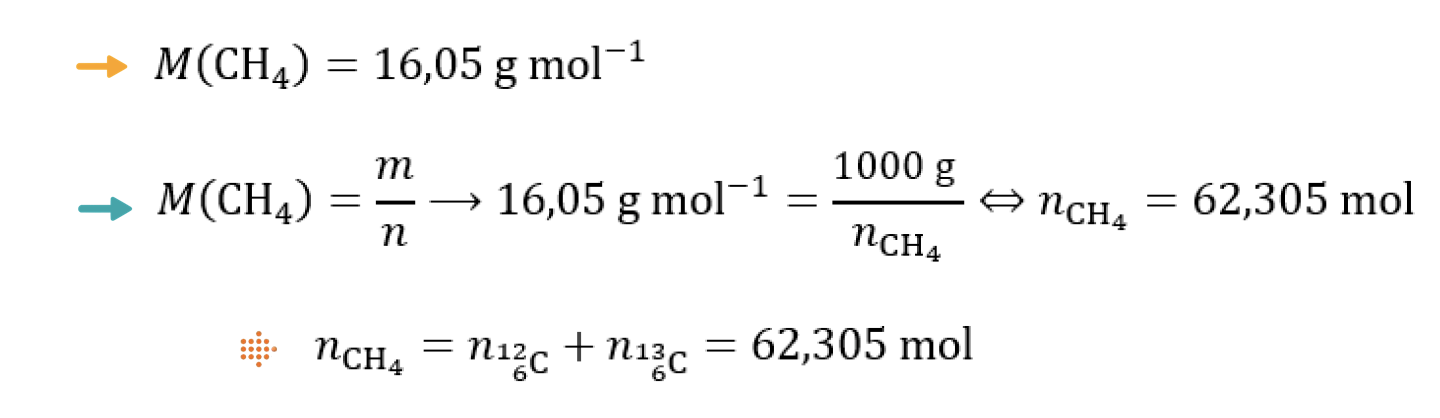









 HCO3– (aq) + H3O+ (aq)
HCO3– (aq) + H3O+ (aq)