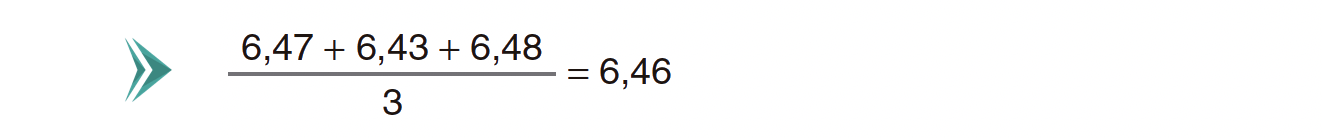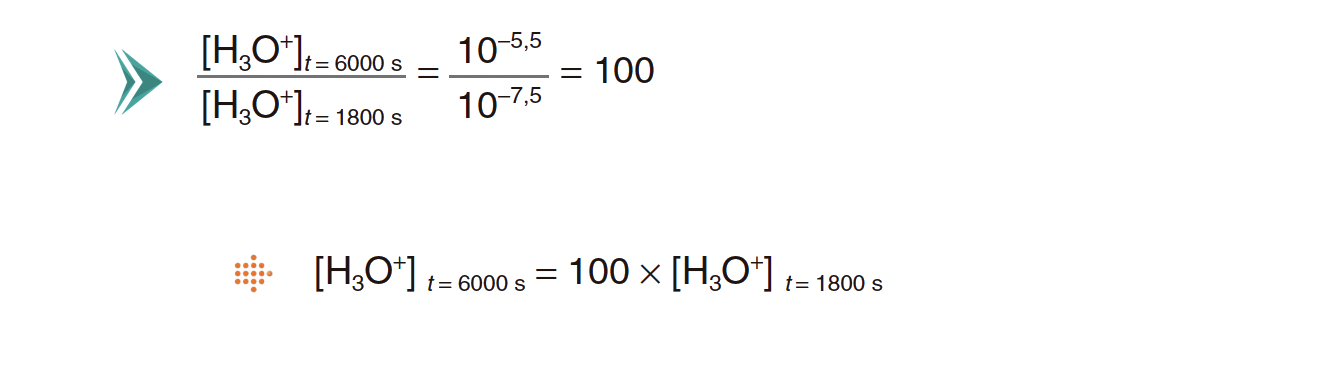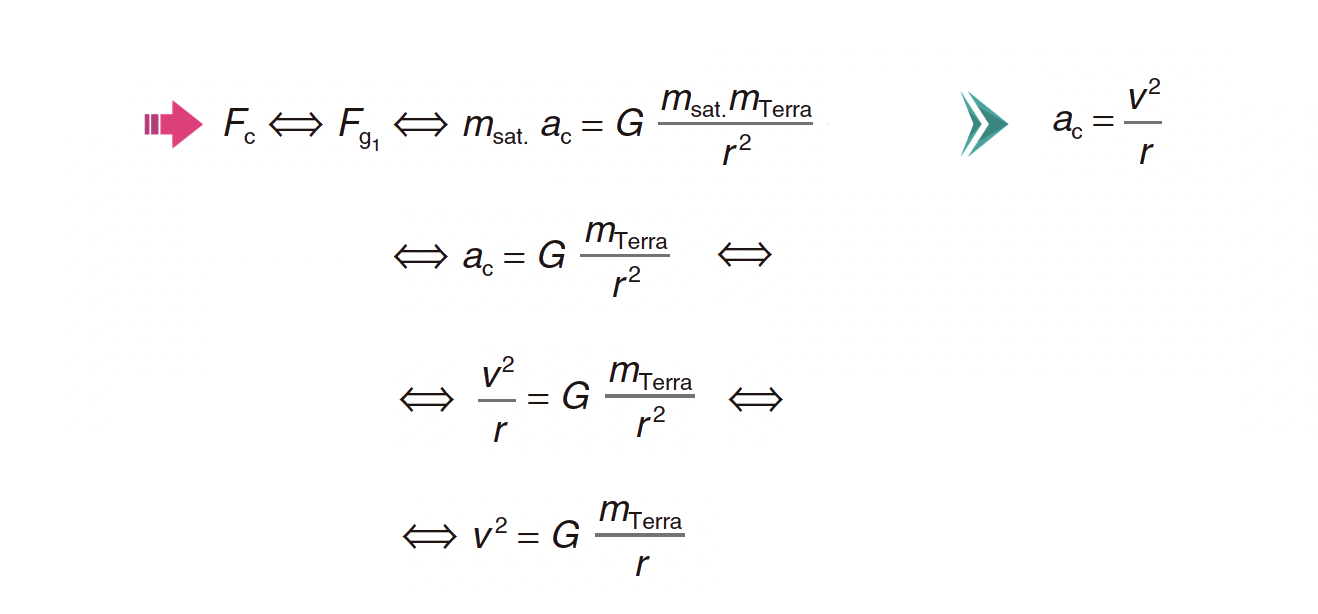2011 – Teste Intermédio – 11ºAno – maio
Voltar a: Física e Química
- Prova Escrita de Física e Química A – Versão 1
- Prova: Teste Intermédio – 11ºAno – 2011
- Duração do Teste: 90 minutos | 05.05.2011
Grupo I
No início do século XX, o amoníaco começou a ser produzido industrialmente, em larga escala, pelo processo de Haber-Bosch. Neste processo, o amoníaco é sintetizado, em condições de pressão e de temperatura adequadas, fazendo-se reagir azoto e hidrogénio em fase gasosa na presença de um catalisador.
A reação de síntese pode ser traduzida por
N2 (g) + 3 H2 (g) ⇋ 2 NH3 (g) ΔH < 0
O amoníaco é uma matéria-prima muito utilizada na indústria química, nomeadamente, no fabrico de ácido nítrico e de compostos usados como adubos e fertilizantes agrícolas, como, por exemplo, sais de amónio, nitratos e ureia.
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
1. Quais são as matérias-primas utilizadas na produção industrial de amoníaco pelo processo de Haber-Bosch?
- Diazoto (N2) e di-hidrogénio
- Azoto (OU N2) e Hidrogénio (OU H2) —————————– 8 pontos
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
2. Realizando a síntese do amoníaco pelo processo de Haber-Bosch, a temperatura constante, um aumento de pressão devido a uma diminuição do volume do sistema, deverá provocar
(A) um aumento da constante de equilíbrio da reação.
(B) um aumento do rendimento da reação.
(C) uma diminuição da constante de equilíbrio da reação.
(D) uma diminuição do rendimento da reação.
- Opção (B)
⇒ De acordo com o Princípio de Le Chatelier, num sistema em estado de equilíbrio, um aumento de pressão devido a uma diminuição de volume do sistema provoca um deslocamento do equilíbrio no sentido em que a pressão diminua, ou seja, no sentido em que se forma menor quantidade (em moles) de substâncias gasosas.
⇒ No caso da síntese do amoníaco, a reação vai evoluir no sentido direto, aumentando assim o rendimento da reação.
⇒ As afirmações (A) e (C) são falsas porque se a temperatura é constante a constante de equilíbrio mantém-se.
- Opção (B)…………. 8 pontos
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
3. Conclua, justificando, se a reação de síntese do amoníaco é favorecida, do ponto de vista do equilíbrio químico, por um aumento ou por uma diminuição de temperatura.
⇒ Como a reação de síntese do amoníaco apresenta um valor de ΔH < 0, pode concluir-se que é uma reação exotérmica no sentido direto.
⇒ De acordo com o Princípio de Le Chatelier, uma diminuição de temperatura de um sistema num estado de equilíbrio provoca um deslocamento do equilíbrio no sentido exotérmico (neste caso no sentido direto) de modo a contrariar essa diminuição de temperatura.
⇒ Conclui-se, assim, que do ponto de vista do equilíbrio químico a reação é favorecida por uma diminuição de temperatura.
- A resposta deve apresentar os seguintes tópicos:
A) A reação de síntese do amoníaco é uma reação exotérmica.
B) Assim, de acordo com o Princípio de Le Châtelier, a reação é favorecida por uma diminuição de temperatura.
A classificação da resposta a este item é feita em função do enquadramento da mesma num dos níveis de desempenho, de acordo com a tabela seguinte.

4. Considere que se fez reagir N2 (g) e H2 (g) num recipiente com a capacidade de 1 L.
O gráfico da Figura 1 representa a evolução, ao longo do tempo, t , das concentrações das espécies envolvidas na reação de síntese do amoníaco, a temperatura constante.

- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
- Zero …………. 8 pontos
- 11ºano – Química – Domínio 1 – subdomínio 1 (Aspetos quantitativos das reações químicas)
4.2. Calcule o rendimento da reação de síntese.
Apresente todas as etapas de resolução.
- V = 1 L
⇒ Cálculo da quantidade de amoníaco, NH3, que se formaria se a reação fosse completa:
De acordo com o gráfico, as concentrações iniciais de azoto e de hidrogénio são iguais a 0,200 mol dm-3.
Como V = 1 L = 1 dm3, as quantidades de N2 (g) e de H2 (g) no início da reação são iguais a 0,200 mol.
De acordo com a estequiometria da reação de ionização de amoníaco em água, o reagente limitante é o H2 (g), pois 0,200 mol de N2 necessitam de 3 x 0,200 mol de H2 e só existem 0,200 mol, isto é, o H2 está em defeito.
Esta conclusão pode obter-se verificando que H2 é o reagente com a menor das razões:

A equação química mostra que 3 mol de H2 (g) podem originar 2 mol de NH3 (g), ou seja, a proporção estequiométrica entre H2 (g) e NH3 (g) é de 3:2.
⇒ Cálculo do rendimento da reação de síntese:
De acordo com o gráfico, a quantidade de NH3 (g) obtida foi de 0,090 mol.
O rendimento (quociente entre a quantidade obtida e a quantidade que teoricamente seria possível obter se a reação fosse completa) é:

- A resolução deve apresentar as seguintes etapas:
A) Determinação da quantidade de NH3 (g) que se deveria formar, considerando o H2 (g) como reagente limitante (n = 0,1333 mol).
B) Determinação do rendimento da reação de síntese (h = 68%).
A resposta a este item deve ser enquadrada num dos níveis de desempenho relacionados com a consecução das etapas, de acordo com a tabela seguinte.

A classificação a atribuir à resposta resulta da pontuação decorrente do enquadramento num dos níveis de desempenho atrás descritos, à qual podem ser subtraídos pontos, de acordo com o enquadramento nos níveis de desempenho relacionados com o tipo de erros cometidos.
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
- Geometria piramidal trigonal
⇒ A geometria de uma molécula é aquela que conduz à máxima estabilidade do sistema molecular. Segundo a teoria da repulsão dos pares de eletrões de valência, estes dispõem-se no espaço o mais afastados possível, de modo a conduzir às menores repulsões eletrónicas.
⇒ No caso da molécula NH3, os pares eletrónicos de valência que rodeiam o átomo central de azoto são três pares de eletrões ligantes, correspondentes às três ligações covalentes N–H, e um par eletrónico não ligante localizado no azoto.
⇒ O maior afastamento possível destes quatro pares obtém-se quando eles se dispõem no espaço de modo aproximadamente tetraédrico (tetraedro distorcido segundo o vértice diferente correspondente ao par de eletrões não ligante), conferindo ao conjunto NH3 uma geometria piramidal trigonal.
⇒ Os ângulos de ligação na molécula de amoníaco são menores que os ângulos de um tetraedro regular devido ao facto de o efeito repulsivo entre um par de eletrões não ligantes e um par de eletrões ligante ser superior ao efeito repulsivo entre dois pares de eletrões ligantes.
- Piramidal trigonal …………. 8 pontos
Grupo II
O amoníaco dissolve-se em água, dando origem a uma solução básica.1. A constante de basicidade de NH3 (aq) é 1,8 × 10-5, a 25 ºC.
1.1. O carácter básico de uma solução de amoníaco deve-se à reação de NH3 (aq) com a água.
Essa reação corresponde a um processo de
(A) dissociação completa.
(B) dissociação parcial.
(C) ionização completa.
(D) ionização parcial.
*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
- Opção (D)
⇒ A reação referida corresponde a um processo de ionização porque, nesta reação, ocorre:
→ formação de iões (ionização).
⇒ Trata-se de uma ionização parcial, porque apresenta uma constante de equilíbrio relativamente pequena, o que evidencia que a reação é incompleta.
- Opção (D)…………. 8 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)

- Opção (A)…………. 8 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
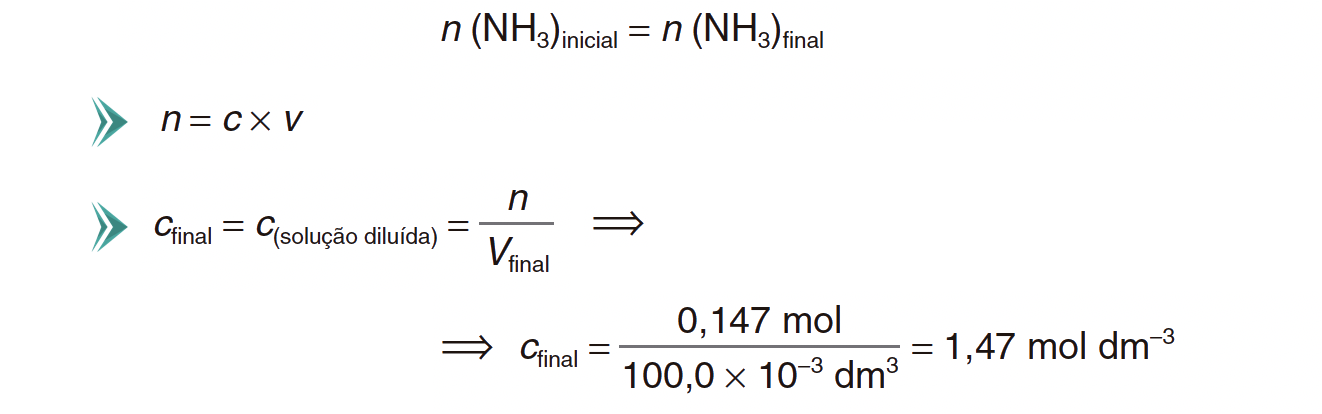
2. Transferem-se 20,0 cm3 de uma solução aquosa de amoníaco, de concentração 7,34 mol dm-3, para um balão volumétrico de 100,0 mL, adicionando-se água até ao traço de referência do balão.
Calcule a concentração da solução diluída.
Apresente todas as etapas de resolução.
- A resolução deve apresentar as seguintes etapas:
A) Determinação da quantidade de amoníaco existente em 20,0 cm3 de solução concentrada (n = 0,1468 mol).
ou
- Determinação do fator de diluição (5,00).
B) Determinação da concentração da solução diluída (c = 1,47 mol dm-3).
A resposta a este item deve ser enquadrada num dos níveis de desempenho relacionados com a consecução das etapas, de acordo com a tabela seguinte.

A classificação a atribuir à resposta resulta da pontuação decorrente do enquadramento num dos níveis de desempenho atrás descritos, à qual podem ser subtraídos pontos, de acordo com o enquadramento nos níveis de desempenho relacionados com o tipo de erros cometidos.
Grupo III
1. Considere a configuração eletrónica do átomo de azoto, no estado fundamental.
Quantos eletrões se encontram em orbitais caracterizadas pelo número quântico secundário l = 1?
(A) 2
(B) 3
(C) 4
(D) 5
*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
- Opção (B)
- 7N – 1s2 2s2 2p3
⇒ As orbitais caracterizadas pelo número quântico secundário l = 1 são as orbitais do tipo p.
⇒ De acordo com a configuração eletrónica do átomo de azoto no estado fundamental, encontram-se três eletrões neste tipo de orbitais.
- Opção (B)…………. 8 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
2. Em determinadas condições de pressão e de temperatura, 0,5 mol de N2 (g) ocupa o volume V1.
Nas mesmas condições de pressão e de temperatura, 0,5 mol de NO2 (g) ocupa o volume
(A) 2/3 V1
(B) V1
(C) 3/2 V1
(D) 2 V1
- Opção (B)
⇒ Em 0,5 mol de N2 (g) existe o mesmo número de partículas que em 0,5 mol de NO2 (g), logo, pela lei de Avogadro, os volumes deste gases são iguais pois volumes iguais de gases diferentes, nas mesmas condições de pressão e temperatura, contêm o mesmo número de partículas,
- Opção (B)…………. 8 pontos
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
3. Na molécula N2 , os átomos de azoto partilham entre si
(A) dois eletrões.
(B) três eletrões.
(C) quatro eletrões.
(D) seis eletrões.
- Opção (D)
⇒ O átomo de azoto tem cinco eletrões de valência.
⇒ Na molécula de azoto, N2, os dois átomos unem-se compartilhando três dupletos (seis eletrões), de modo que cada átomo fique rodeado por oito eletrões, como o gás nobre mais próximo.
⇒ |N ≡ N|
- Opção (D)…………. 8 pontos
- 10ºano – Química – Domínio 1 – subdomínio 3 (Tabela periódica)
4. O ião fluoreto, F–, e o ião sódio, Na+, são partículas que, no estado fundamental, apresentam a mesma configuração eletrónica.
Preveja, justificando, qual dessas partículas deverá apresentar maior raio.
⇒ O raio do ião F– é superior ao raio do ião Na+.
⇒ Os iões F– e Na+ são partículas isoeletrónicas.
⇒ Como a carga nuclear do ião F– (+9) é inferior à carga nuclear do ião Na+ (+11), a força atrativa núcleo-eletrões é menor no ião F– que no ião Na+, o que faz com que o ião F– tenha um raio superior ao do ião Na+.
- A resposta deve apresentar os seguintes tópicos:
A) A carga nuclear do ião F– é inferior à carga nuclear do ião Na+.
B) Consequentemente, apresentando os iões F– e Na+ a mesma configuração eletrónica [no estado fundamental], o núcleo do ião F– exerce menor atração sobre os eletrões do que o núcleo do ião Na+.
C) Prevê-se, assim, que o ião F– tenha um raio superior ao do ião Na+.A classificação da resposta a este item é feita em função do enquadramento da mesma num dos níveis de desempenho, de acordo com a tabela seguinte.

Grupo IV
Com o objetivo de estudar o pH de soluções aquosas, um grupo de alunos realizou várias medições, utilizando um sensor devidamente calibrado.
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
- 11ºano – Química – A.l. – 2.1 – Titulação ácido-base
1. Os alunos começaram por medir o pH de uma amostra de água mineral.
Os valores de pH obtidos em três ensaios, a 25 ºC, encontram-se registados na tabela seguinte.

Obtenha o resultado da medição de pH.
Exprima esse resultado em função do valor mais provável e da incerteza absoluta.
Apresente todas as etapas de resolução.
- A resolução deve apresentar as seguintes etapas:
A) Determinação do valor mais provável de pH (6,46).
B) Determinação dos módulos dos desvios de cada valor medido em relação ao valor mais provável (0,01; 0,03 ; 0,02).
C) Apresentação do resultado da medição de pH (6,46 ± 0,03 ou 6,46 ± 0,02).A resposta a este item deve ser enquadrada num dos níveis de desempenho relacionados com a consecução das etapas, de acordo com a tabela seguinte.

A classificação a atribuir à resposta resulta da pontuação decorrente do enquadramento num dos níveis de desempenho atrás descritos, à qual podem ser subtraídos pontos, de acordo com o enquadramento nos níveis de desempenho relacionados com o tipo de erros cometidos.
2. Em seguida, os alunos mediram, a 25 ºC, o pH ao longo do tempo de uma outra amostra de água mineral.
A esta amostra foi sendo adicionado dióxido de carbono, CO2 (g), durante o intervalo de tempo em que decorreu a experiência.
A Figura 2 apresenta o gráfico do pH da amostra de água em função do tempo.

- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
- 11ºano – Química – A.l. – 2.1 – Titulação ácido-base
2.1. A variação de pH que se observa entre os instantes t = 1800 s e t = 6000 s traduz, em relação à concentração hidrogeniónica,
(A) um aumento de vinte vezes.
(B) um aumento de cem vezes.
(C) uma diminuição de duas vezes.
(D) uma diminuição de mil vezes.
- Opção (B)…………. 8 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
- 11ºano – Química – A.l. – 2.1 – Titulação ácido-base
2.2. O CO2 dissolvido reage com a água, dando origem a um ácido fraco, o ácido carbónico, H2CO3 (aq).
A reação pode ser traduzida por
CO2 (aq) + H2O (l) ⇋ H2CO3 (aq)
Explique a diminuição do pH da amostra de água mineral, durante o intervalo de tempo em que decorreu a experiência.
⇒ A adição contínua de dióxido de carbono, CO2 (g), origina um aumento da concentração de CO2 dissolvido, o que, de acordo com o Princípio de Le Chatelier, favorece a reação de formação de ácido carbónico, H2 CO3 (segundo a equação que é fornecida).
⇒ O aumento da quantidade de, instável e imediatamente protolisado origina um aumento das quantidades de HCO3– e de H3O+.
⇒ Isto é, a dissolução na água mineral do dióxido de carbono conduz a um aumento da concentração de H3O+.
⇒ Como pH =- log [H3O+], o aumento da [H3O+] origina uma diminuição de pH da amostra de água mineral.
- A resposta deve apresentar os seguintes tópicos:
A) [De acordo com o Princípio de Le Châtelier,] o aumento do teor de CO2 dissolvido favorece a reação de formação do ácido carbónico no sentido direto, pelo que a concentração de H2CO3 (aq) aumenta.
B) O aumento da concentração de H2CO3 (aq) conduz a um aumento da concentração de H3O+(aq) durante o intervalo de tempo em que decorreu a experiência.
C) O aumento da concentração de H3O+ (aq) implica uma diminuição do pH da amostra de água mineral.
A classificação da resposta a este item é feita em função do enquadramento da mesma num dos níveis de desempenho, de acordo com a tabela seguinte.

Grupo V
O primeiro satélite português, o PoSAT-1, de massa 50 kg, descrevia, no seu tempo de vida útil, uma órbita aproximadamente circular, de raio 7,2 × 106 m, com um período de 101 minutos.
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
1. Verifique que a intensidade da força gravítica que atuava no satélite, na órbita considerada, é cerca de 4/5 da intensidade da força gravítica que atuaria no mesmo satélite, se este se encontrasse à superfície da Terra.
Apresente todas as etapas de resolução.
- msat. = 50 kg;
- r = 7,2 x 106 m;
- T= 101 min = 101 x 60 s ⇔ T = 6,06 x 103 s;
- g = 10 m s-2
→ Fg1 – força gravítica que atua sobre o satélite à distância r do centro da Terra;
→ Fg – força gravítica que atua sobre o satélite à superfície da Terra.
⇒ A força gravítica que atua sobre o satélite, na órbita considerada, é igual à força centrípeta, que é a força resultante:
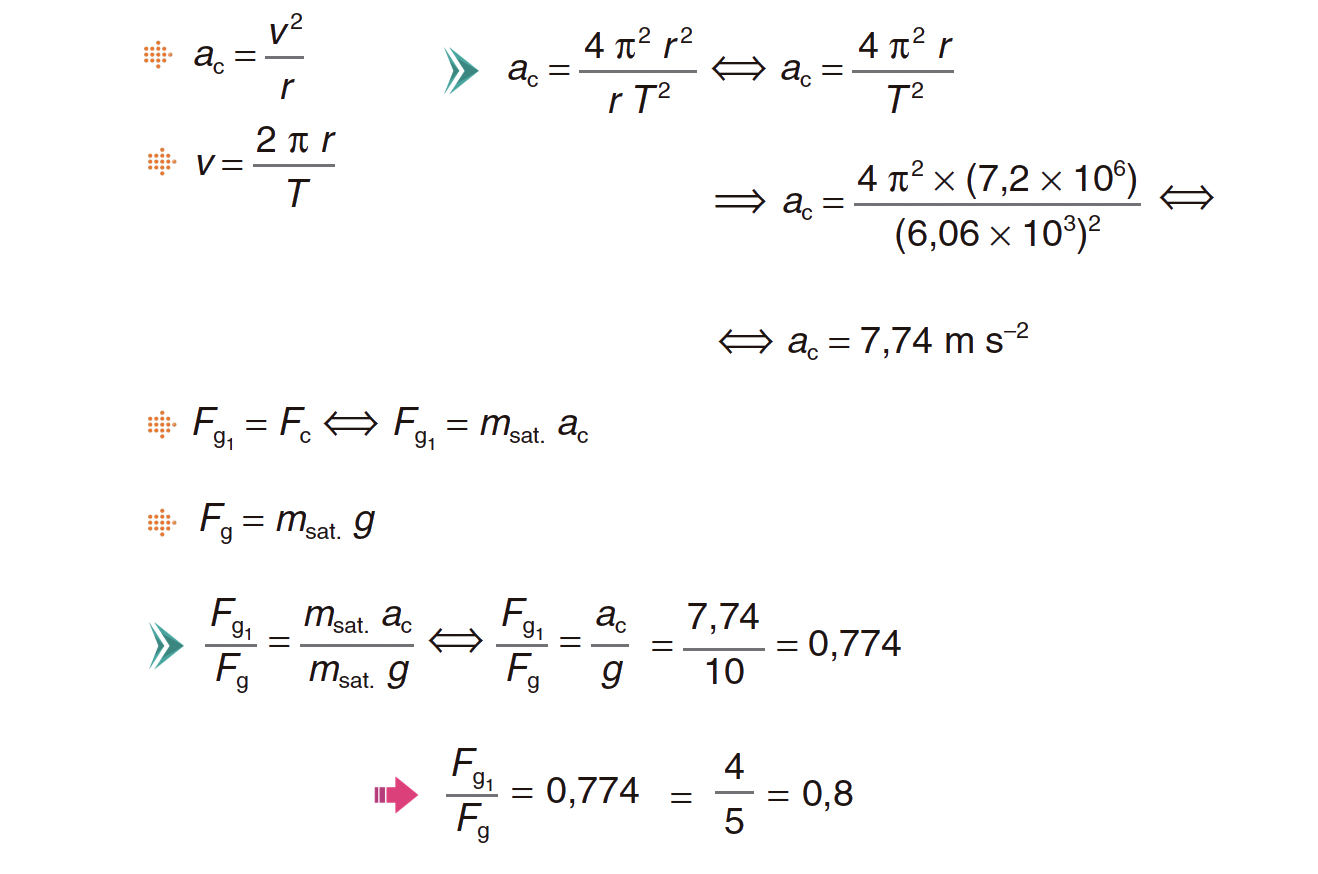
⇒ Pode afirmar-se que a intensidade da força gravítica que atua sobre o satélite, na órbita considerada, é cerca de 4/5 da intensidade da força gravítica que sobre ele atua à superfície da Terra.
- A resolução deve apresentar as seguintes etapas:
A) Determinação do valor da velocidade do satélite (v = 7,46 x 103 m s-1).
ou
- Determinação do valor da velocidade angular do satélite (ω = 1,036 x 10-3 rad s-1)
B) Determinação do valor da aceleração do satélite (ac = 7,73 m s-2).
C) Determinação da intensidade da força gravítica que atuava no satélite na órbita considerada (F = 3,9 x 102 N).
D) Comparação da intensidade da força gravítica que atuava no satélite na órbita considerada com a intensidade da força gravítica à superfície da Terra.
A resposta a este item deve ser enquadrada num dos níveis de desempenho relacionados com a consecução das etapas, de acordo com a tabela seguinte.

A classificação a atribuir à resposta resulta da pontuação decorrente do enquadramento num dos níveis de desempenho atrás descritos, à qual podem ser subtraídos pontos, de acordo com o enquadramento nos níveis de desempenho relacionados com o tipo de erros cometidos.
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
2. A velocidade com que um satélite descreve uma órbita
(A) depende da sua massa e do raio da órbita.
(B) depende da sua massa, mas é independente do raio da órbita.
(C) é independente da sua massa, mas depende do raio da órbita.
(D) é independente da sua massa e do raio da órbita.
- Opção (C)…………. 8 pontos
Grupo VI
- 11ºano – Física – Domínio 2 – subdomínio 1 (Sinais e ondas)
1. Uma tina de ondas é um dispositivo que permite estudar algumas propriedades das ondas produzidas à superfície da água.
Nas imagens obtidas com este dispositivo, as zonas claras correspondem a vales dessas ondas e as zonas escuras, a cristas.

A Figura 3 representa ondas planas produzidas numa tina de ondas, com o gerador de ondas ajustado para uma frequência de 6,0 Hz.
Na experiência realizada, verificou-se que a distância entre os pontos A e B, representados na figura, era de 20,8 cm.
Calcule o valor da velocidade de propagação das ondas na experiência descrita.
Apresente todas as etapas de resolução.
- f = 6,0 Hz;
- AB = 20,8 cm
⇒ Para determinar o valor da velocidade, v, de propagação das ondas, tem de se conhecer o comprimento de onda, λ.
⇒ Para determinar o valor de λ, recorre-se à figura 3. Como as zonas claras correspondem a vales, onde se encontram os pontos A e B, e as zonas escuras a cristas, conclui-se que a distância entre dois vales consecutivos (duas zonas claras) corresponde a um comprimento de onda.
⇒ Assim, da análise da figura 3, verifica-se que entre os pontos A e B estão contidos 5 comprimentos de onda, logo:
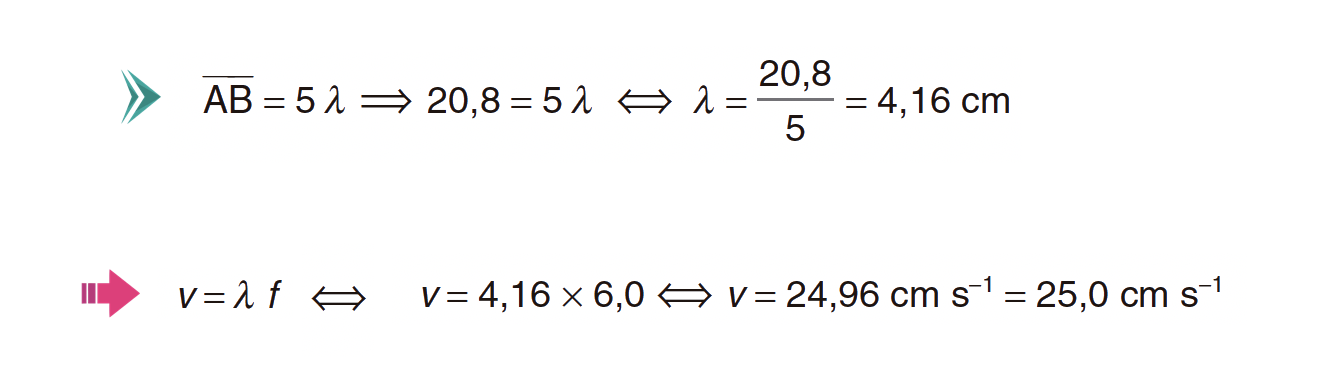
⇒ O módulo da velocidade de propagação das ondas é de 25,0 cm s-1.
- A resolução deve apresentar as seguintes etapas:
A) Determinação do comprimento de onda (λ = 4,16 cm).
B) Determinação do valor da velocidade de propagação das ondas (v = 25 cm s-1).
Nota – O resultado final pode ser expresso em qualquer unidade adequada.A resposta a este item deve ser enquadrada num dos níveis de desempenho relacionados com a consecução das etapas, de acordo com a tabela seguinte.

A classificação a atribuir à resposta resulta da pontuação decorrente do enquadramento num dos níveis de desempenho atrás descritos, à qual podem ser subtraídos pontos, de acordo com o enquadramento nos níveis de desempenho relacionados com o tipo de erros cometidos.
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
2. A Figura 4 representa um feixe, muito fino, de luz monocromática, que incide na superfície de separação de dois meios transparentes, I e II, cujos índices de refração são, respetivamente, nI e nII.

Se a luz se propagar com maior velocidade no meio II, o ângulo de refração será
(A) maior do que o ângulo de incidência, uma vez que nI > nII .
(B) menor do que o ângulo de incidência, uma vez que nI > nII .
(C) maior do que o ângulo de incidência, uma vez que nI < nII .
(D) menor do que o ângulo de incidência, uma vez que nI < nII .
- Opção (A)
⇒ meio I:
- vI – velocidade de propagação;
- αI – ângulo de incidência;
- nI – índice de refração;
⇒ meio II:
- vII – velocidade de propagação;
- αII – ângulo de refração;
- nII – índice de refração;
vII > vI
⇒ O índice de refração de um dado meio ótico é igual à razão entre a velocidade de propagação da luz no vazio, c (constante) e a velocidade de propagação nesse meio, v:

⇒ Como vII > vI, conclui-se que nI > nII, pelo que se eliminam as opções (C) e (D).
⇒ Para comparar os ângulos de incidência e de refração, recorre-se à Lei de Snell-Descartes para a refração:
nI sin αI = nII sin αII
⇒ Uma vez que nI > nII, então sin αII > sin αI e, consequentemente, αII > αI, isto é, o ângulo de refração é maior do que o ângulo de incidência.
- Opção (A)…………. 8 pontos
FIM