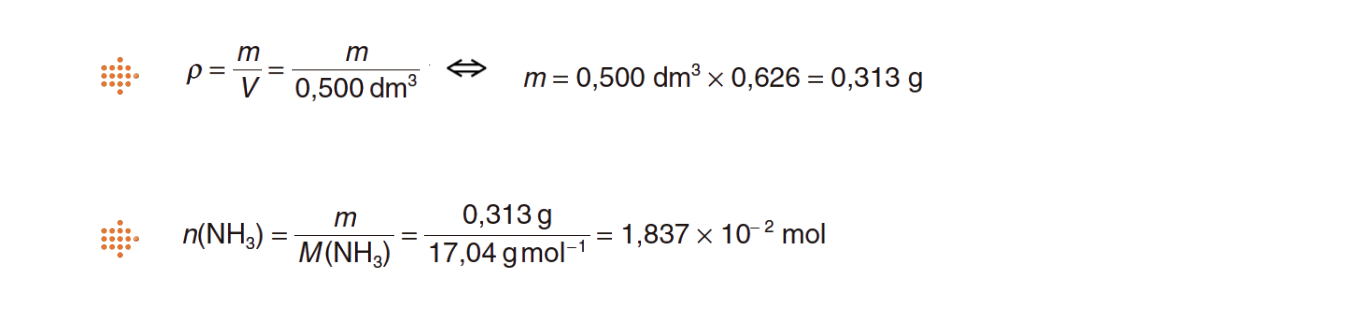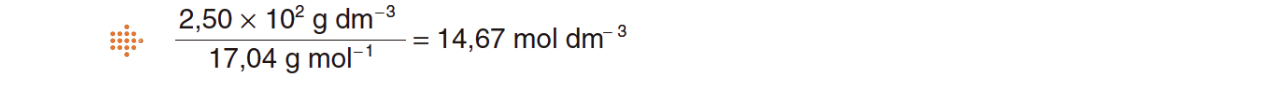2010 – Teste Intermédio – 11ºAno – abril
Voltar a: Física e Química
Prova Escrita de Física e Química A – Versão 1
Prova: Teste Intermédio – 11ºAno – 2010
Duração do Teste: 90 minutos | 30.04.2010
Maxwell (1831-1879) previu a existência de ondas electromagnéticas, que seriam originadas por cargas eléctricas em movimento acelerado. Previu ainda que estas ondas deveriam propagar-se no vácuo à velocidade da luz.
De 1885 a 1889, Hertz conduziu uma série de experiências que lhe permitiram não só gerar e detectar ondas electromagnéticas, como medir a sua velocidade de propagação, confirmando, assim, as previsões de Maxwell. Estes estudos abriram caminho ao desenvolvimento dos modernos sistemas de telecomunicações.
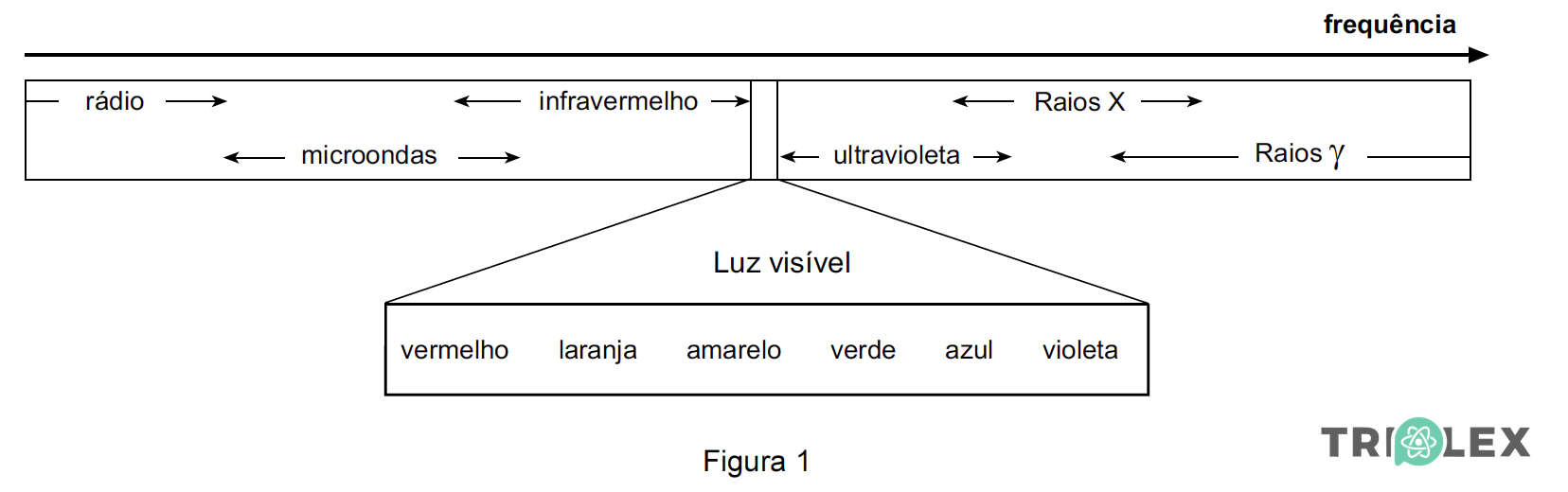
Ao conjunto das ondas electromagnéticas, ordenadas segundo as suas frequências, chama-se espectro electromagnético, que pode ser representado como mostra a Figura 1.
As ondas electromagnéticas usadas em telecomunicações apresentam comportamentos distintos na atmosfera, consoante a sua frequência. Algumas contornam facilmente obstáculos, como edifícios e montanhas, podendo ser usadas para comunicações fora da linha de vista.
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
1.1. Seleccione a única opção que permite obter uma afirmação correcta.
Maxwell previu que as ondas luminosas seriam ondas electromagnéticas porque, de acordo com o trabalho por ele desenvolvido, as ondas electromagnéticas…
(A) seriam originadas por cargas eléctricas em movimento rectilíneo uniforme.
(B) poderiam ser usadas em sistemas de telecomunicações.
(C) apresentariam comportamentos distintos na atmosfera.
(D) se propagariam no vácuo à velocidade da luz.
- Opção (D)
⇒ De acordo com o parágrafo 1 do texto, Maxwell apenas previu que as ondas eletromagnéticas seriam originadas por cargas elétricas em movimento acelerado, que se propagariam no vácuo à velocidade da luz.
- Opção (D)…………. 8 pontos
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
1.2. Seleccione a única opção que identifica o fenómeno a que se refere a última frase do texto.
(A) Refracção
(B) Reflexão
(C) Difracção
(D) Dispersão
- Opção (C)
⇒ A difração é um fenómeno ondulatório que se caracteriza por ondas contornarem obstáculos, desde que o seu comprimento de onda seja da ordem de grandeza das dimensões desses obstáculos.
- Opção (C)…………. 8 pontos
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
1.3. A Figura 2 representa um feixe luminoso monocromático, muito fino, que incide na superfície de separação de dois meios transparentes, I e II, sofrendo refracção.
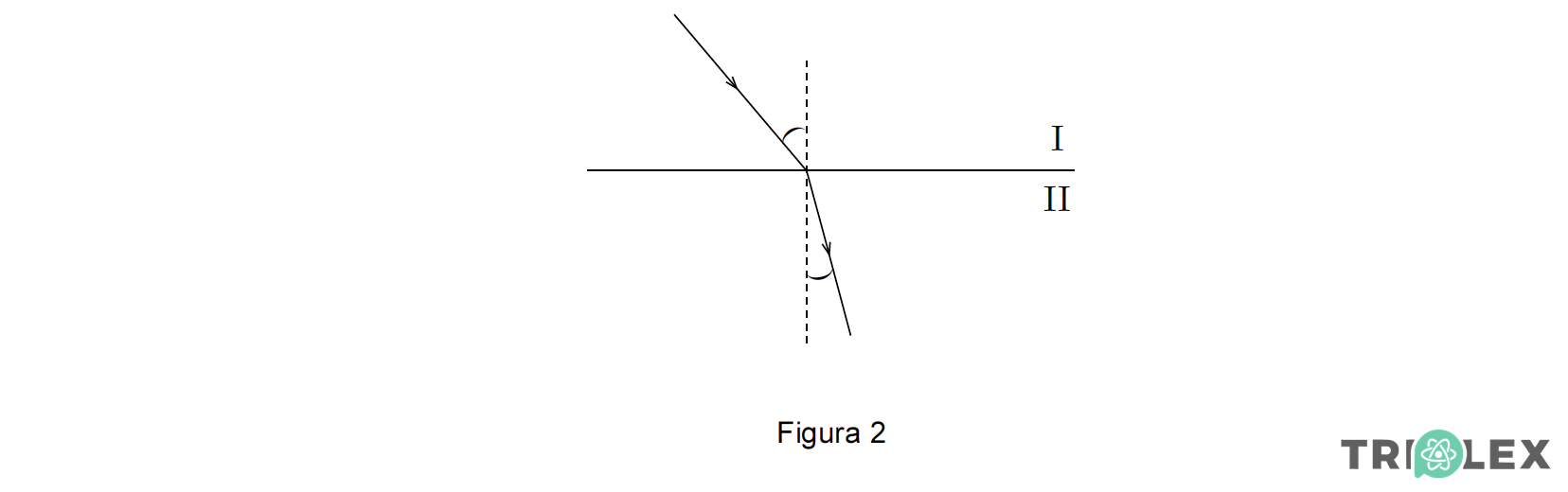
Seleccione a única opção que contém os termos que preenchem, sequencialmente, os espaços seguintes, de modo a obter uma afirmação correcta.
O índice de refracção do meio I é ________ ao índice de refracção do meio II, sendo a velocidade de propagação do feixe luminoso _______ no meio I .
(A) superior … maior
(B) inferior … menor
(C) inferior … maior
(D) superior … menor
- Opção (C)
⇒ Como:
- n1 sin α1 = n2 sin α2
⇒ Como da figura 2 se verifica que α1 (meio I) é superior a α2 (meio II), então:
- sin α1 > sin α2 ⇒ n1 < n2
⇒ O índice de refração de um meio, n, relaciona a velocidade de propagação da radiação nesse meio, v, com a velocidade de propagação no vazio, c, através da expressão:
- n = c/v ⇔ c = n v
- n1 v1 = n2 v2
- n1 < n2
- Opção (C)…………. 8 pontos
1.4. O césio é um metal alcalino bastante utilizado em células fotoeléctricas.
1.4.1. Fazendo incidir, sobre uma placa de césio, quer radiação verde, quer radiação violeta, ocorre efeito fotoeléctrico.
Justifique a afirmação seguinte.
Considerando electrões com a mesma energia de remoção, a radiação violeta provoca ejecção de electrões com maior energia cinética do que a radiação verde.
*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
⇒ A energia cinética de um eletrão (Ec) removido por efeito fotoelétrico depende da energia do fotão incidente (Einc) e da energia mínima necessária para extrair o eletrão do metal (Erem):
- Ec = Einc – Erem
Usando radiação violeta: Ec (violeta) = Einc (violeta) – Erem
Usando radiação verde: Ec(verde) = Einc (verde) – Erem
⇒ A energia do fotão da radiação violeta é superior à energia do fotão da radiação verde, logo, considerando eletrões com a mesma energia de remoção, a energia cinética do eletrão removido por radiação violeta é superior à energia cinética do eletrão removido por radiação verde.
- A resposta deve abordar os seguintes tópicos:
⇒ A energia cinética dos electrões ejectados é igual à diferença entre a energia de um fotão da radiação incidente e a energia de remoção de um electrão do césio.
⇒ Como a energia de um fotão de radiação violeta é superior à energia de um fotão de radiação verde, conclui-se que, das radiações referidas, a violeta provoca a ejecção de electrões com maior energia cinética.
A classificação da resposta a este item é feita em função do enquadramento da mesma num dos níveis de desempenho, de acordo com a tabela seguinte:

- 10ºano – Química – Domínio 1 – subdomínio 3 (Tabela periódica)
1.4.2. Justifique a afirmação seguinte, com base na configuração electrónica de valência dos átomos dos elementos considerados, no estado fundamental.
A energia de ionização do césio (Cs) é inferior à energia de ionização do potássio (K).
*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
⇒ Tanto o potássio como o césio se encontram no grupo 1 da T.P., com um só eletrão de valência.
⇒ No estado fundamental, o eletrão de valência do átomo de césio encontra-se num nível energético superior (n = 6) ao do eletrão de valência do átomo de potássio (n = 4).
⇒ Embora a carga nuclear do átomo de césio (+ 55) seja superior à carga nuclear do átomo de potássio (+ 19), a carga nuclear efetiva do átomo de potássio é superior à carga nuclear efetiva do átomo de césio, devido ao menor número de camadas eletrónicas interiores, que produzem menor blindagem nuclear.
⇒ Assim, a força atrativa núcleo-eletrão ns1 é superior no átomo de potássio, sendo necessário fornecer maior energia para remover este eletrão (maior energia de ionização).
- A resposta deve abordar os seguintes tópicos:
⇒ No estado fundamental, o electrão de valência de um átomo de césio encontra-se num nível energético superior ao do electrão de valência de um átomo de potássio.
⇒ É, assim, necessário menos energia para remover o electrão de valência de um átomo de césio do que para remover o electrão de valência de um átomo de potássio.
A classificação da resposta a este item é feita em função do enquadramento da mesma num dos níveis de desempenho, de acordo com a tabela seguinte:

- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
- 10ºano – Química – A.l. – 1.2 – Teste de chama
1.5. Verifica-se que os sais de potássio conferem uma cor violeta à chama de um bico de Bunsen, pelo que o teste de chama pode ser utilizado para averiguar a presença desse elemento, em amostras sólidas.
Seleccione a única opção que contém os termos que preenchem, sequencialmente, os espaços seguintes, de modo a obter uma afirmação correcta.
A cor observada deve-se à _______ de radiação, quando electrões do ião potássio transitam de níveis energéticos _______ para níveis energéticos ________.
(A) emissão … inferiores … superiores
(B) emissão … superiores … inferiores
(C) absorção … inferiores … superiores
(D) absorção … superiores … inferiores
- Opção (B)
⇒ Quando os sais de potássio são aquecidos à chama, iões K+ são reduzidos a K por ação da chama; os eletrões dos átomos de K passam a estados de maior energia (são excitados).
⇒ Quando regressam ao estado inicial, de menor energia, libertam essa energia sob a forma de radiação, emitindo luz com cor característica do elemento.
- Opção (B)…………. 8 pontos
- 11ºano – Física – Domínio 2 – subdomínio 1 (Sinais e ondas)
2. Quando se percute um diapasão, este emite um som puro, que, após ser captado por um microfone e convertido num sinal eléctrico, pode ser visualizado no ecrã de um osciloscópio.
Na Figura 3 estão representados dois sinais eléctricos, A e B, originados por dois sinais sonoros.
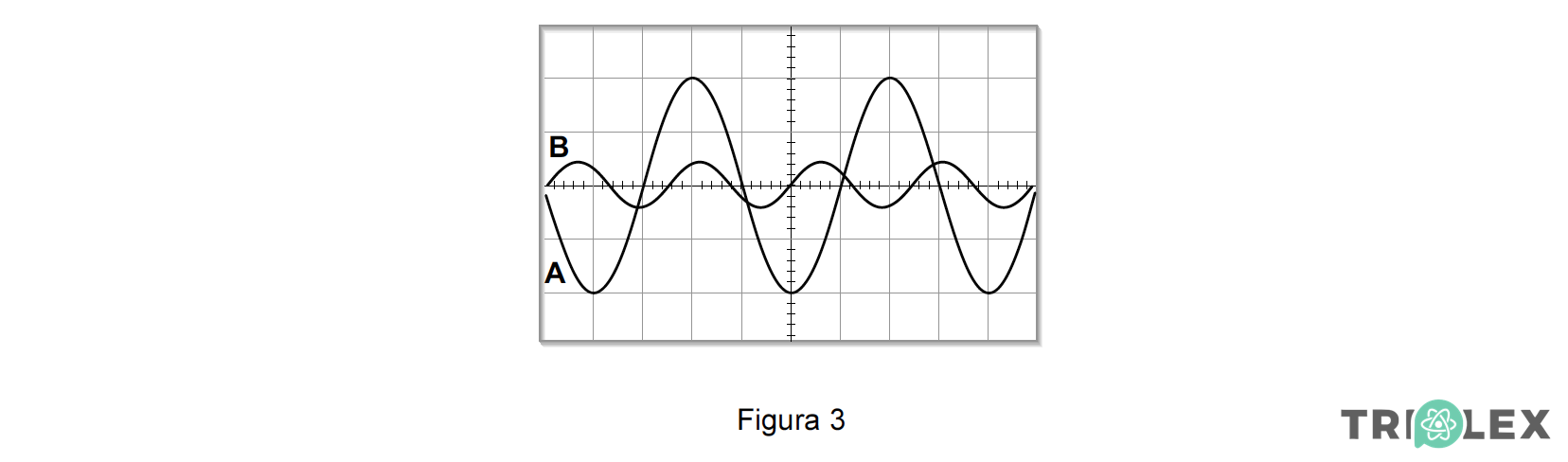
Seleccione a única opção que contém os termos que preenchem, sequencialmente, os espaços seguintes, de modo a obter uma afirmação correcta.
O sinal A tem ___________ amplitude e __________ frequência do que o sinal B.
(A) maior … maior
(B) maior … menor
(C) menor … maior
(D) menor … menor
- Opção (B)
⇒ No ecrã de um osciloscópio, o eixo horizontal representa a base de tempo e o eixo vertical representa, para cada instante, a elongação de uma partícula em vibração.
⇒ A amplitude corresponde à elongação máxima da partícula, enquanto o período é igual ao menor intervalo de tempo decorrido para que a partícula se encontre na mesma fase de vibração.
⇒ Da análise da figura 3 verifica-se que a amplitude do sinal A é muito superior à do sinal B.
⇒ O período do sinal A é superior ao do sinal B, logo, a frequência de A é inferior à frequência de B, pois a frequência da oscilação é inversamente proporcional ao período:
- f = 1/T
⇒ O sinal A tem maior amplitude e menor frequência do que o sinal B.
- Opção (B)…………. 8 pontos
3. Galileu e Newton contribuíram decisivamente para o estudo e compreensão dos movimentos.
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
3.1. Lançou-se, verticalmente, para cima, uma bola, com velocidade inicial de módulo 6,0 m s−1, em condições nas quais a resistência do ar pode ser considerada desprezável.
Determine a altura máxima atingida pela bola, em relação ao nível de lançamento.
Considere um referencial, Oy, de eixo vertical, com origem no ponto de lançamento e sentido de baixo para cima e recorra exclusivamente às equações que traduzem o movimento, y(t ) e v(t ).
Apresente todas as etapas de resolução.
⇒ A altura máxima é atingida no instante em que a velocidade da bola é nula.
⇒ Como a resistência do ar é desprezável, a aceleração do movimento é constante e igual à aceleração gravítica.
⇒ De acordo com o referencial definido, as equações que traduzem o movimento da bola são:
- y = y0 + v0 t – ½ g t2 ⇒ y = 6,0 t – 5 t2 (SI)
- v = v0 – g t ⇒ v = 6,0 – 10 t (SI)
⇒ Para determinar o tempo de subida:
- 0 = 6,0 – 10 t ⇔ t = 0,60 s
⇒ Substituindo t = 0,60 s, na expressão (v), calcula-se a altura máxima:
- y = 6,0 x 0,60 – 5,0 x 0,602 = 1,8 m
⇒ A altura máxima atingida pela bola é igual a 1,8 m.
- A resolução deve apresentar, no mínimo, as seguintes etapas:
⇒ Calcula, a partir da equação 0 = 6,0 – 10t, o instante em que a bola atinge a altura máxima (t = 0,600 s).
⇒ Calcula, a partir da equação y = 6,0 t – 5,0 t2, a altura máxima atingida pela bola (y = 1,8 m).
A classificação da resposta a este item é feita em função do enquadramento da mesma num dos níveis de desempenho, de acordo com a tabela seguinte:

- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
3.2. Lançou-se um paralelepípedo de madeira, de modo a que ele subisse uma rampa, em condições nas quais a resistência do ar pode ser desprezada.
Seja Fg a força gravítica, Rn a força de reacção normal e Fa a força de atrito.
Seleccione a única opção que apresenta o diagrama das forças que actuam sobre esse paralelepípedo, ao longo da subida da rampa.
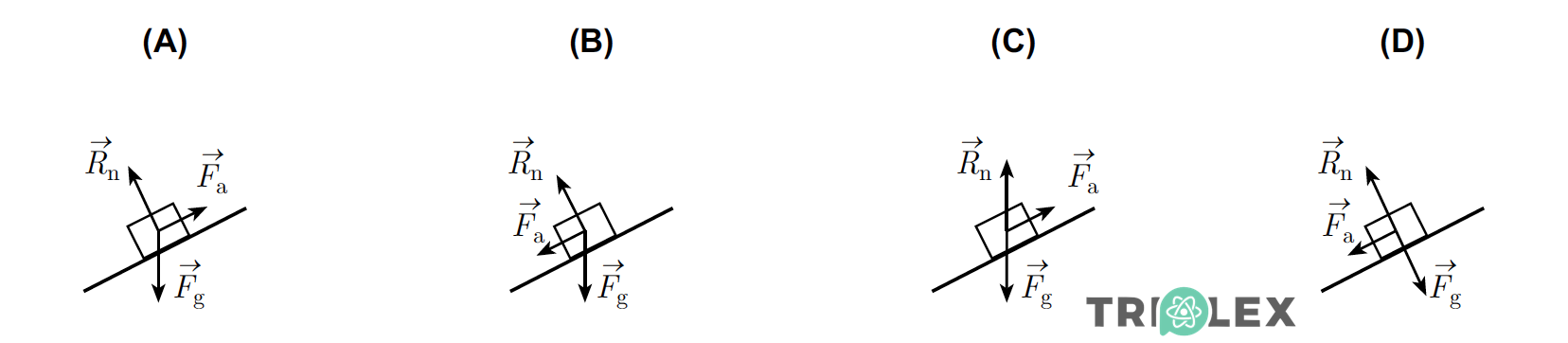
- Opção (B)
⇒ A força gravítica, Fg, é vertical e descendente.
⇒ A força de reação normal, Rn, é normal ou perpendicular à superfície de apoio, a rampa.
⇒ A força de atrito, Fa, que atua em sentido oposto ao do movimento, tem sentido descendente, pois o paralelepípedo está a subir a rampa.
- Opção (B)…………. 8 pontos
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
3.3. Considere que se mediu a intensidade da resultante das forças aplicadas a um conjunto corpo+sobrecarga, que descreve, em diversos ensaios, uma mesma trajectória circular, de raio r, com velocidade angular constante.
Na tabela seguinte encontram-se registados os valores medidos nos diversos ensaios, nos quais se fez variar a massa do conjunto corpo+sobrecarga.

Obtenha o valor da aceleração do conjunto corpo+sobrecarga, a partir da equação da recta que melhor se ajusta ao conjunto de pontos experimentais.
Utilize a calculadora gráfica.
Apresente o valor obtido com três algarismos significativos.
⇒ A resultante das forças que atuam sobre o conjunto é radial e centrípeta.
⇒ Como a velocidade angular, ω, é constante bem como o raio da trajetória, então o módulo da aceleração centrípeta é constante, pois:
- a = v2/r
- v = ω r
- a = ω2 r
⇒ Assim, de acordo com a 2.ª lei de Newton:
- Fr = m a
⇒ A equação da reta que melhor se ajusta ao conjunto de pontos experimentais, recorrendo à calculadora gráfica, é:
- y = 1,78 x + 0,004
⇒ Dado que y representa a força resultante F e x representa a massa m, então:
- F= 1,78 m + 0,004 (SI)
Desta equação conclui-se que o declive da reta, 1,78, representa a aceleração do movimento.
- 1,78 m s-2 …………. 8 pontos
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
4. O amoníaco, NH3, é uma substância inorgânica importante, sendo um dos compostos de azoto melhor conhecidos.
Obtém-se industrialmente através do processo de Haber-Bosch, fazendo reagir, em condições apropriadas, hidrogénio e azoto gasosos.
A síntese do amoníaco pode ser representada por:
3 H2 (g) + N2 (g) ⇋ 2 NH3 (g)
O gráfico apresentado na Figura 4 traduz o modo como varia a constante de equilíbrio Kc , daquela reacção, em função da temperatura, T.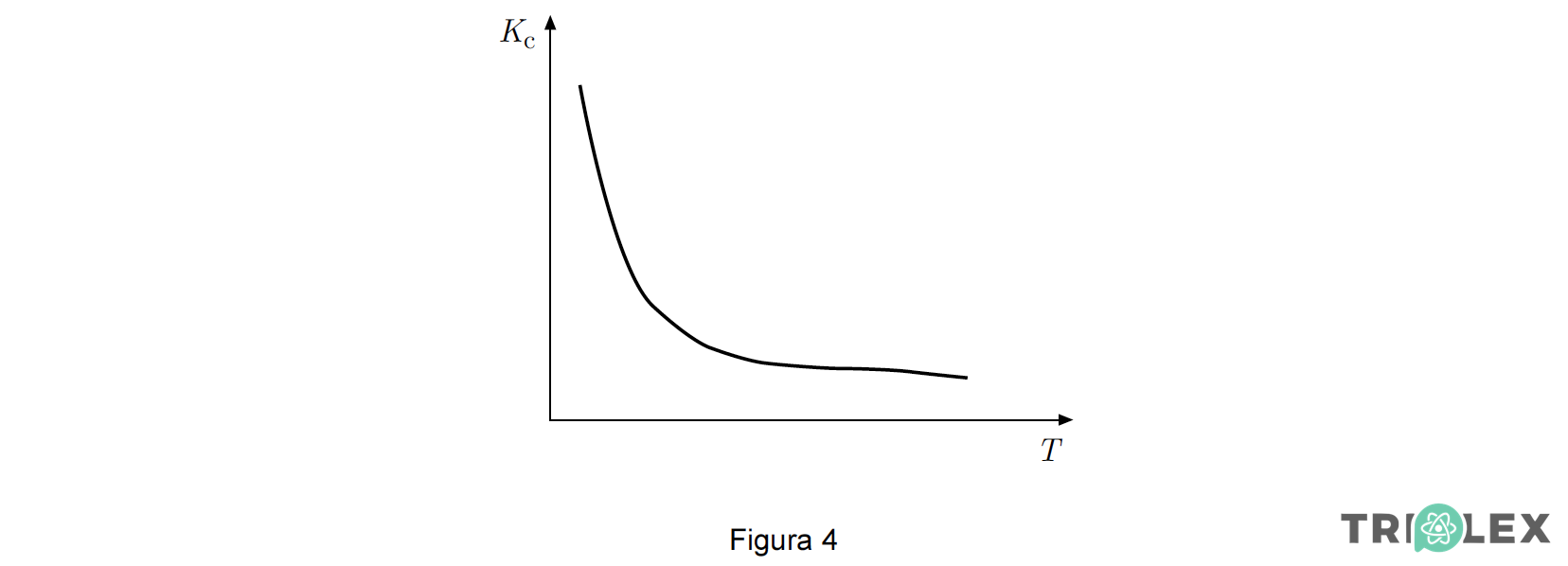
Para a reacção em causa, compare a energia envolvida na ruptura e na formação das ligações químicas, fundamentando a sua resposta a partir da informação fornecida pelo gráfico.
⇒ A figura 4 mostra que a constante de equilíbrio da reação diminui com o aumento da temperatura.
⇒ De acordo com o Princípio de Le Chatelier, pode-se concluir que a reação é exotérmica no sentido direto.
⇒ O calor posto em jogo numa reação química resulta de um balanço entre a energia consumida para se romperem as ligações dos reagentes (Edis) e a energia libertada na formação das ligações dos produtos (Elig).
⇒ Se a reação é exotérmica a energia libertada na formação das ligações nas moléculas dos produtos é maior do que a energia consumida para quebrar as ligações nas moléculas dos reagentes.
- A resposta deve abordar os seguintes tópicos:
⇒ O gráfico traduz uma diminuição da constante de equilíbrio à medida que a temperatura aumenta.
⇒ De acordo com esta variação, a reacção em causa é exotérmica no sentido directo.
⇒ Considerando a energia de reacção como o balanço entre a energia absorvida na ruptura das ligações químicas nos reagentes e a energia libertada na formação das ligações químicas nos produtos, conclui-se que, para a reacção em causa, a energia libertada na formação das ligações químicas nos produtos será maior.
A classificação da resposta a este item é feita em função do enquadramento da mesma num dos níveis de desempenho, de acordo com a tabela seguinte:

5. O amoníaco é um composto molecular que se encontra em fase gasosa à temperatura e pressão ambientes.
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
5.1. Atendendo apenas à estequiometria do composto, a molécula NH3 poderia assumir uma geometria triangular plana.
No entanto, aquela molécula apresenta uma geometria piramidal trigonal.
Apresente uma explicação para o facto de a molécula de amoníaco adoptar uma geometria piramidal trigonal.
⇒ A geometria de uma molécula é aquela que conduz à máxima estabilidade do sistema molecular.
⇒ Segundo o método da repulsão dos pares eletrónicos de valência estes dispõem-se no espaço o mais afastados possível, de modo a conduzir às menores repulsões eletrónicas possíveis.
⇒ No caso da molécula NH3, os pares eletrónicos de valência que rodeiam o átomo central são três pares de eletrões ligantes, correspondentes às três ligações covalentes N – H e o par eletrónico não ligante localizado no azoto.
⇒ O maior afastamento possível destes quatro pares obtém-se quando eles se dispõem no espaço de modo, aproximadamente, tetraédrico, conferindo à molécula NH3 uma geometria piramidal trigonal.
- A resposta deve abordar os seguintes tópicos:
⇒ Na molécula NH3 existe um par de electrões de valência não ligante no átomo de azoto.
⇒ As repulsões que se estabelecem entre este par de electrões e os restantes três pares de electrões de valência ligantes forçam a molécula a assumir uma geometria piramidal trigonal.
A classificação da resposta a este item é feita em função do enquadramento da mesma num dos níveis de desempenho, de acordo com a tabela seguinte:

- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
5.2. Considere que a densidade do amoníaco, à pressão de 0,989 atm e a 55 ºC, é 0,626 g dm−3.
Calcule o número de moléculas de amoníaco que existem numa amostra de 500 cm3 desse gás, naquelas condições de pressão e de temperatura.
Apresente todas as etapas de resolução.
- A resolução deve apresentar, no mínimo, as seguintes etapas:
⇒ Determina o volume molar do NH3 (g), nas condições de pressão e de temperatura referidas (Vm = 27,22 dm3 mol−1).
ou
- Determina a massa de NH3 (g) existente em 500 cm3 desse gás, nas condições de pressão e de temperatura referidas (m = 0,3130 g).
⇒ Determina o número de moléculas que existem numa amostra de 500 cm3 daquele gás, nas condições de pressão e de temperatura referidas (N = 1,11 x 1022).
A classificação da resposta a este item é feita em função do enquadramento da mesma num dos níveis de desempenho, de acordo com a tabela seguinte:

5.3. Admita que dispunha de uma solução aquosa de amoníaco de concentração mássica 2,50 x 102 g dm−3, e que pretendia preparar, a partir daquela solução concentrada, 500 cm3 de uma solução diluída, de concentração 0,400 mol dm−3.
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
5.3.1. Calcule o volume de solução concentrada que teria de medir para preparar a solução pretendida.
Apresente todas as etapas de resolução.
⇒ Cálculo da concentração molar da solução aquosa de amoníaco:
⇒ A concentração mássica de 2,50 x 102 g dm-3 corresponde à concentração molar de
⇒ Cálculo do volume de solução concentrada de amoníaco necessária para preparar a solução pretendida:
⇒ Numa diluição, a quantidade de soluto mantém-se.
⇒ Assim, n(NH3) na solução concentrada = n(NH3) na solução diluída
⇒ Como
- n = c x V
temos:
- cc x Vc = cd x Vd ⇔ 14,67 x Vc = 0,400 x 0,500 ⇔ Vc = 1,36 x 10-2 dm3
- A resolução deve apresentar, no mínimo, as seguintes etapas:
⇒ Determina a quantidade de NH3 (aq) necessária à preparação da solução diluída (n = 0,200 mol).
⇒ Determina o volume de solução concentrada de NH3 que corresponde àquela quantidade (V = 1,36 x 10−2 dm3).
A classificação da resposta a este item é feita em função do enquadramento da mesma num dos níveis de desempenho, de acordo com a tabela seguinte:

- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
5.3.2. Na diluição efectuada utilizou água destilada, de pH igual a 7,04.
Seleccione a única opção que refere o valor correcto da concentração de iões H3O+ na referida água.
(A) 9,12 x 10−8 mol dm−3
(B) 1,00 x 10−7 mol dm−3
(C) 1,10 x 107 mol dm−3
(D) 8,48 x 10−1 mol dm−3
- Opção (A)
⇒ É a única alternativa que está de acordo com a relação:
- pH = – log [H+ (aq)] ou [H+ (aq)] = 10-7,04 = 9,12 x 10-8
- Opção (A)…………. 8 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
5.3.3. Seleccione a única opção que contém os termos que preenchem, sequencialmente, os espaços seguintes, de modo a obter uma afirmação correcta.
Na solução aquosa diluída de NH3, a 25 ºC, a concentração de iões OH− (aq) é 2,7 x 10−3 mol dm−3 e a concentração de iões H3O+ (aq) é _______ mol dm−3 , o que permite concluir que essa solução é _______.
(A) 3,7 x 10−12 … ácida
(B) 2,7 x 1011 … ácida
(C) 2,7 x 1011 … básica
(D) 3,7 x 10−12 … básica
- Opção (D)
⇒ Se [HO¯] = 2,7 x 10-3 mol dm-3, dada a relação:
- [HO¯ (aq)] x [H+ (aq)] = 1,00 x 10-14 ⇔ [H+ (aq)] = 3,7 x 10-12 mol dm-3
⇒ Como [HO¯(aq)] > [H+ (aq)], a solução é básica.
- Opção (D)…………. 8 pontos
6. O amoníaco é utilizado na síntese do sulfato de tetraaminocobre (II) mono-hidratado, um sal complexo que é usado em estamparia têxtil.
A reacção de síntese pode ser traduzida por:
CuSO4 . 5 H2O (aq) + 4 NH3 (aq) → [Cu (NH3)4] SO4 . H2O (aq) + 4 H2O (l)
- 11ºano – Química – Domínio 1 – subdomínio 1 (Aspetos quantitativos das reações químicas)
6.1. Numa síntese laboratorial de sulfato de tetraaminocobre (II) mono-hidratado (M = 245,8 g mol−1), utilizou-se uma amostra impura de sulfato de cobre penta-hidratado, CuSO4 . 5 H2O (M = 249,7 g mol−1), de massa 6,10 g , contendo 5% (m/m) de impurezas inertes, e solução aquosa de amoníaco em excesso.
Obteve-se 3,92 g de sal complexo.
Determine o rendimento da síntese efectuada.
Apresente todas as etapas de resolução.
⇒ Cálculo da massa de CuSO4 . 5 H2O existente na amostra:
- m (CuSO4 . 5 H2O) = 0,95 x 6,10 g = 5,80 g (5% são impurezas)
⇒ Cálculo da massa de sal complexo que se obteria a partir desta massa de reagente limitante:
⇒ A equação química mostra que 1 mol de CuSO4 . 5 H2O (massa molar = 249,7 g mol-1) pode originar 1 mol de sal complexo (massa molar = 245,8 g mol-1), ou seja, a proporção estequiométrica é de 1:1.
⇒ n (CuSO4 . 5 H2O) = n[Cu(NH3)4] SO4 .H2O
- n = m/M = n(CuSO4 . 5 H2O) = 5,80/249,7 = 2,32 x 10-2 mol
n([Cu(NH3)4] SO4.H2O) = 2,32 x 10-2 mol
m([Cu(NH3)4] SO4.H2O) = 2,32 x 10-2 x 245,8 = 5,70 g
⇒ Cálculo do rendimento da síntese efetuada:
O rendimento (quociente entre a quantidade/massa de produto obtido e a quantidade/massa máxima que seria possível obter) é:
- η = 3,92/5,70 = 68,8%
⇒ O rendimento da síntese realizada é 68,8%.
- A resolução deve apresentar, no mínimo, as seguintes etapas:
⇒ Calcula a massa de CuSO4 . 5 H2O existente na amostra (m = 5,795 g).
⇒ Calcula a massa de sal complexo que se obteria a partir daquela massa de reagente limitante (m = 5,704 g).
⇒ Calcula o rendimento da s ntese efectuada (η = 68,7%).
A classificação da resposta a este item é feita em função do enquadramento da mesma num dos níveis de desempenho, de acordo com a tabela seguinte:

6.2. Para obter os cristais de sulfato de tetraaminocobre (II) mono-hidratado é necessário separá-los da solução sobrenadante.
Seleccione a única opção que apresenta a sequência dos procedimentos para efectuar aquela separação.
(A) Decantação, filtração e secagem.
(B) Decantação, secagem e filtração.
(C) Filtração, decantação e secagem.
(D) Filtração, secagem e decantação.
*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
- Opção (A)
- Opção (A)…………. 8 pontos
FIM