2014 – 1ª Fase – Prova Escrita de Física e Química A
Voltar a: Física e Química
- Prova Escrita de Física e Química A – versão 1
- Prova 715: 1.ª Fase – 2014
GRUPO I
Em 1831, Michael Faraday (1791-1867), um dos mais extraordinários homens do século XIX, descobriu a indução eletromagnética. Este fenómeno, na sua impressionante simplicidade, pode ser observado com uma montagem semelhante à representada na Figura 1: liga-se um galvanómetro G (aparelho que indica a passagem de corrente elétrica) a uma bobina B (fio condutor enrolado em espiral) e introduz-se, ao longo dessa bobina, uma barra magnetizada M. Imediatamente a agulha do galvanómetro se desloca, provando, assim, que o fio é percorrido por uma corrente elétrica, embora na montagem não exista nem pilha, nem gerador de qualquer espécie. O simples movimento da barra magnetizada dá origem à corrente elétrica.
Só existe corrente elétrica no fio enquanto a barra se move. Se a barra parar, a agulha do galvanómetro regressa imediatamente a zero.
Rómulo de Carvalho, História do Telefone, 2.ª ed., Coimbra, Atlântida, 1962, pp. 67-69 (adaptado)
- 11ºano – Física – Domínio 2 – subdomínio 2 (Eletromagnetismo)
1. A partir da experiência descrita no texto, conclui-se que
(A) um campo elétrico origina sempre um campo magnético.
(B) um campo magnético origina sempre uma corrente elétrica.
(C) uma corrente elétrica pode originar um campo magnético.
(D) uma barra magnetizada em movimento pode originar uma corrente elétrica.
- Opção (D)
⇒ Faraday descobriu que o movimento da barra magnetizada, aproximação ou afastamento da bobina, altera a intensidade do campo magnético no interior da bobina e, assim, também o fluxo do campo magnético.
⇒ A variação do fluxo do campo magnético que atravessa a bobina B origina a corrente elétrica detetada pelo galvanómetro G.
- Opção (D) …………. 5 pontos
- 11ºano – Física – Domínio 2 – subdomínio 2 (Eletromagnetismo)
2. Na experiência descrita no texto, enquanto a barra magnetizada M estiver parada em relação à bobina B, a agulha do galvanómetro G estará no zero, porque, nesse intervalo de tempo,
(A) a força eletromotriz induzida nos terminais da bobina é elevada.
(B) o campo magnético criado pela barra magnetizada é uniforme.
(C) o fluxo magnético através da bobina é pequeno.
(D) a variação do fluxo magnético através da bobina é nula.
- Opção (D)
⇒ Uma barra magnética cria um campo magnético. Se ela estiver parada, o fluxo do campo magnético através da bobina é constante (|ΔΦ| = 0), não originando, assim, força eletromotriz induzida
- |εi| =|ΔΦ|/Δt = 0
⇒ Há corrente elétrica induzida se existir variação do fluxo do campo magnético.
- Opção (D) …………. 5 pontos
- 11ºano – Física – Domínio 2 – subdomínio 2 (Eletromagnetismo)
3. Numa experiência semelhante à descrita no texto, o módulo da força eletromotriz induzida nos terminais da bobina será tanto maior quanto
(A) menor for o número de espiras da bobina e menor for a área de cada espira.
(B) menor for a área de cada espira da bobina e mais rápido for o movimento da barra magnetizada.
(C) maior for o número de espiras da bobina e mais rápido for o movimento da barra magnetizada.
(D) maior for o número de espiras da bobina e menor for a área de cada espira.
- Opção (C)
⇒ O fluxo magnético que atravessa uma bobina depende do número de espiras, da sua área, da intensidade do campo magnético e do ângulo entre a normal às espiras o campo magnético.
- Φ = N B A cos α
⇒ O módulo da força eletromotriz além de depender dos fatores já referidos, varia também com a maior ou menor rapidez com que varia o fluxo magnético.
- |εi| =|ΔΦ|/Δt
⇒ Quanto maior for o número de espiras da bobina e quanto mais rápido (menor intervalo de tempo) for a variação do fluxo, maior será o módulo da força eletromotriz gerada.
- Opção (C) …………. 5 pontos
- 11ºano – Física – Domínio 2 – subdomínio 2 (Eletromagnetismo)
4. Qual é o nome da unidade do Sistema Internacional em que se exprime a força eletromotriz?
- Volt (a força eletromotriz é uma energia por unidade de carga)
- Volt …….. 5 pontos
GRUPO II
O alumínio é um metal que tem diversas aplicações tecnológicas.
Na tabela seguinte, estão registados os valores de algumas propriedades físicas do alumínio.
 Considere que uma barra de alumínio, de massa 700 g e, inicialmente, a 25,0 °C, é aquecida.
Considere que uma barra de alumínio, de massa 700 g e, inicialmente, a 25,0 °C, é aquecida.
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)

- Opção (B)
⇒ Recorrer à expressão E = m c ΔT para calcular a energia que é necessário fornecer à barra de alumínio, para que a sua temperatura aumente de 25,0 ºC para 27,0 ºC.
- mbarra de Al = 700 g ⇔ mbarra de Al = 0,700 kg
⇒ Ao substituir o valor da massa da barra de alumínio na expressão, E = m c ΔT, esta deve expressa estar em kg devido às unidades da capacidade térmica mássica.
- E = m c ΔT ⇔ E = m c (Tfinal−Tinicial) ⇔ E = 0,700 × 897 × (27,0 – 25,0) ⇔ E = 0,700 × 897 × (2,0) ⇔ E = (1,4 × 897) J
- Opção (B) …………. 5 pontos
2. Considere que a área e a emissividade da superfície da barra se mantêm constantes, durante o aquecimento.
Quantas vezes é que a potência da radiação emitida pela superfície da barra à temperatura de 200 °C (473 K) é superior à potência da radiação emitida pela superfície da barra à temperatura de 25 °C (298 K)?
(A) Cerca de 1,6 vezes.
(B) Cerca de 6,3 vezes.
(C) Cerca de 8,0 vezes.
(D) Cerca de 4,1 × 103 vezes.
*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
- Opção (B) …………. 5 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
3. Admita que é transferida energia para a barra de alumínio considerada a uma taxa temporal constante de 1,1 kW.
Determine o tempo que a barra demora a fundir completamente, a partir do instante em que atinge a temperatura de 660 °C, admitindo que a totalidade da energia transferida contribui para o aumento da energia interna da barra.
Apresente todas as etapas de resolução.
- Etapas de resolução:
A) Cálculo da energia que é necessário transferir para a barra de alumínio, à temperatura de 660 ºC, para esta fundir completamente (E = 2,80 × 105 J) …….. 5 pontos
B) Cálculo do tempo que a barra demora a fundir completamente (Δt = 2,5 × 102 s) …….. 5 pontos
GRUPO III
Com o objetivo de investigar a dissipação de energia em colisões de bolas com o solo, um grupo de alunos realizou uma atividade laboratorial, na qual deixou cair bolas de diferentes elasticidades.
Os alunos consideraram o solo como nível de referência da energia potencial gravítica.
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
- 10ºano – Física – A.l. – 1.2 – Movimento vertical de queda e ressalto de uma bola
1. A tabela seguinte apresenta a altura máxima atingida por uma dessas bolas, após o primeiro ressalto no solo, em três ensaios consecutivos, nos quais a bola foi abandonada sempre de uma mesma altura.

Apresente o resultado da medição da altura máxima atingida pela bola, após o primeiro ressalto, em função do valor mais provável e da incerteza relativa (em percentagem).
Apresente todas as etapas de resolução.
- Etapas de resolução:
A) Determinação do valor mais provável da altura máxima atingida pela bola, após o primeiro ressalto (h = 0,53 m) (ver nota 1) …….. 3 pontos
B) Cálculo da incerteza relativa do valor experimental da altura máxima atingida pela bola, após o primeiro ressalto (2% ou 2 × 10-2) (ver nota 2) …….. 4 pontos
C) Apresentação do resultado da medição da altura máxima atingida pela bola, após o primeiro ressalto, em função do valor mais provável e da incerteza relativa (em percentagem) (0,53 m ± 2%) …….. 5 pontos
Notas:
1. A apresentação do valor mais provável da altura máxima atingida pela bola com um arredondamento incorreto, ou com um número incorreto de algarismos significativos, implica a pontuação desta etapa com zero pontos.
2. A apresentação da incerteza relativa com um arredondamento incorreto, ou com um número incorreto de algarismos significativos, nesta etapa, não implica qualquer desvalorização.
2. O coeficiente de restituição, e, na colisão de uma bola com o solo pode ser calculado pela raiz quadrada do quociente da altura máxima atingida pela bola após um ressalto, hapós , e da altura da qual a bola caiu, hqueda :

- 10ºano – Física – subdomínio 1 (Energia e movimentos)
- 10ºano – Física – A.l. – 1.2 – Movimento vertical de queda e ressalto de uma bola
2.1. Na tabela seguinte, estão registadas as alturas máximas atingidas, em sucessivos ressaltos, por uma bola que foi inicialmente abandonada a 1,20m do solo.

Para determinar o coeficiente de restituição, e, na colisão da bola com o solo, comece por apresentar uma tabela, na qual registe, para cada um dos ressaltos, a altura de queda, hqueda , e a altura máxima atingida pela bola após o ressalto, hapós .
Calcule o coeficiente de restituição, e, na colisão da bola com o solo, a partir da equação da reta que melhor se ajusta ao conjunto de valores registados nessa tabela.
Apresente todas as etapas de resolução.

⇒ Equação de regressão linear do gráfico de dispersão da altura máxima após o ressalto em função da altura de queda:
- hqueda = 0,675 hapós + 8 × 10–3 (SI)
⇒ No modelo teórico, a altura de ressalto é nula para uma altura de queda nula.
⇒ Na expressão determinada, o valor 8 × 10–3 é aproximadamente zero, e resulta do modelo matemático usado no tratamento com os dados.
⇒ Cálculo do coeficiente de restituição (o declive do gráfico é igual ao quadrado do coeficiente de restituição):

- Etapas de resolução:
A) Apresentação da tabela com o registo, para cada um dos ressaltos, da altura de queda, hqueda , e da altura máxima atingida pela bola após o ressalto, hapós (ver nota 1) …….. 5 pontos
B) Determinação, para hapós em função de hqueda , da equação da reta que melhor se ajusta ao conjunto de valores registados na tabela (hapós = 0,675 hqueda + 0,008 (SI) ou y = 0,675x + 0,008 (SI)) (ver notas 2 e 3) …….. 5 pontos
C) Cálculo do coeficiente de restituição na colisão da bola com o solo (e = 0,82) (ver nota 3) …….. 5 pontos
Notas:
1. A apresentação de duas séries de valores sem identificação das grandezas a que se referem (hqueda e hapós) será considerada um erro de tipo 2.
2. A apresentação da equação da reta com um valor diferente de ordenada na origem, mas da mesma ordem de grandeza, nesta etapa, não implica qualquer desvalorização.
3. A apresentação de valores calculados com arredondamentos incorretos, ou com um número incorreto de algarismos significativos, nesta etapa, não implica qualquer desvalorização.
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
- 10ºano – Física – A.l. – 1.2 – Movimento vertical de queda e ressalto de uma bola
2.2. Os alunos determinaram um coeficiente de restituição de 0,76 na colisão de uma bola X com o solo e um coeficiente de restituição de 0,65 na colisão de uma bola Y com o solo.
Estes resultados permitem concluir que, em cada ressalto,
(A) cerca de 76% da energia mecânica do sistema bola X +Terra é dissipada na colisão com o solo.
(B) a energia mecânica inicial é menor no caso do sistema bola Y +Terra.
(C) cerca de 35% da energia mecânica do sistema bola Y +Terra é dissipada na colisão com o solo.
(D) a percentagem da energia mecânica dissipada na colisão com o solo é menor no caso do sistema bola X + Terra.
- Opção (D)
⇒ Um menor coeficiente de restituição significa uma menor altura máxima de ressalto para uma determinada altura de queda e, portanto, uma maior percentagem de energia dissipada.
⇒ Sendo desprezável a força de resistência do ar durante a descida e a subida da bola, há conservação da energia mecânica: a energia mecânica da bola imediatamente antes da colisão com o solo é igual à energia potencial gravítica do sistema bola-Terra para a altura de queda e imediatamente após à colisão é igual à energia potencial para a altura máxima de ressalto.
⇒ Assim, a razão entre a energia dissipada na colisão e a energia antes da colisão é:
⇒ Um aumento do coeficiente de restituição implica uma menor percentagem de energia dissipada.
⇒ Para o sistema bola X-Terra a percentagem de energia dissipada é
- (1 – 0,762) × 100% = 42%
⇒ Para o sistema bola Y-Terra é
- (1 – 0,652) × 100% = 58%
- Opção (D) …………. 5 pontos
GRUPO IV
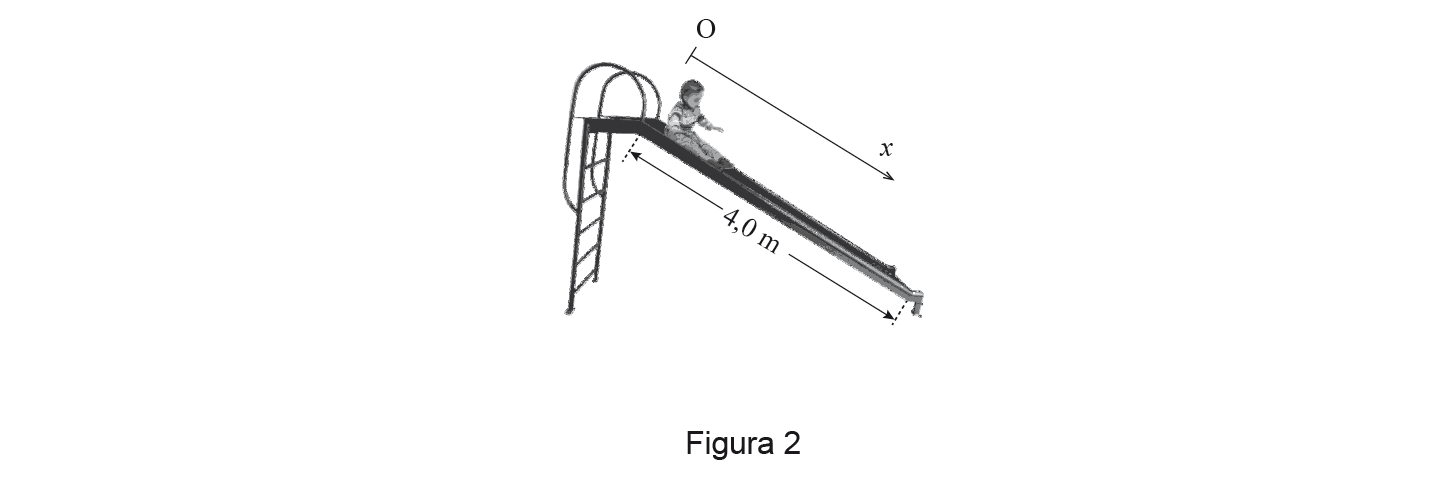
1. A Figura 2 (que não está à escala) representa uma criança a descer um escorrega cuja secção inclinada tem um comprimento de 4,0 m.
Considere que a criança desce o escorrega partindo do repouso, e que a sua aceleração se mantém constante durante a descida.
Admita que a criança pode ser representada pelo seu centro de massa (modelo da partícula material).
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
1.1. Considere duas situações distintas:
– Situação I: a resultante das forças dissipativas que atuam na criança é desprezável;
– Situação II: a resultante das forças dissipativas que atuam na criança não é desprezável.
Nos esquemas seguintes, o vetor aI representa a aceleração da criança na situação I.
Em qual dos esquemas o vetor aII pode representar a aceleração da criança na situação II ?

- Opção (C)
⇒ Quer existam ou não forças dissipativas, a criança parte do repouso e aumenta a sua velocidade. Então, as acelerações em ambas as situações apontam no sentido do movimento.
⇒ A aceleração menor é a da situação II, uma vez que é também menor a resultante das forças (as forças de atrito têm sentido oposto à componente do peso segundo o eixo dos xx).
- Opção (C) …………. 5 pontos
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
1.2. Considere que a criança, de massa 30 kg, demora 2,1s a percorrer a secção inclinada do escorrega.
Calcule a intensidade da resultante das forças que atuam na criança, na situação considerada.
Apresente todas as etapas de resolução.
- Etapas de resolução:
A) Determinação do módulo da aceleração da criança, na situação considerada (a = 1,81 m s-2) …….. 5 pontos
B) Determinação da intensidade da resultante das forças que atuam na criança, na situação considerada (F = 54 N) …….. 5 pontos
2. Na Figura 3, está representado um carrossel. Quando o carrossel está em movimento, cada um dos cavalinhos move-se com movimento circular uniforme.

- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)

- Opção (A) …………. 5 pontos
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
2.2. Quando o carrossel está em movimento, os cavalinhos A e B descrevem circunferências de raios diferentes.
Conclua, justificando, qual dos cavalinhos, A ou B, tem maior aceleração.
⇒ Ambos os cavalinhos dão uma volta completa no mesmo tempo e, por isso, têm a mesma velocidade angular (ωA = ωB = ω).
⇒ O raio da circunferência descrita pelo cavalinho A é maior do que o raio da circunferência descrita por B (rA > rB), logo, o cavalinho A terá maior aceleração
ou
⇒ Ambos os cavalinhos dão uma volta completa no mesmo tempo, ou seja, têm o mesmo período (TA = TB = T).
⇒ O raio da circunferência descrita pelo cavalinho A é maior do que o raio da circunferência descrita por B (rA > rB), portanto, o cavalinho A terá maior aceleração

- Tópicos de referência:
A) Os cavalinhos A e B movem-se com velocidades angulares iguais.
ou
- Os períodos dos movimentos dos cavalinhos A e B são iguais.
B) Sendo [, para o movimento circular uniforme, ac = w2 r ( ou ac = (2π/T)2 r, a aceleração será tanto maior quanto maior for o raio da circunferência descrita.
C) Sendo o raio da circunferência descrita pelo cavalinho A maior do que o raio da circunferência descrita pelo cavalinho B, conclui-se que a aceleração do cavalinho A é maior do que a aceleração do cavalinho B.

GRUPO V
1. Considere a configuração eletrónica do átomo de nitrogénio no estado fundamental.
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
1.1. Quantos valores diferenciados de energia apresentam os eletrões desse átomo?
(A) Sete.
(B) Cinco.
(C) Três.
(D) Dois.
- Opção (C)
⇒ A configuração eletrónica do nitrogénio no estado fundamental é 1s2 2s2 2p3.
⇒ Há três energias diferenciadas para os eletrões:
- E1s < E2s < E2p
⇒ A energia das orbitais, em átomos polieletrónicos, depende de n e de l (as orbitais 2p, em que l = 1, e 2s, em que l = 0, têm energias diferentes).
- Opção (C) …………. 5 pontos
1.2. Quantos eletrões se encontram em orbitais caracterizadas pelo número quântico secundário l = 0, nesse átomo?
(A) Dois.
(B) Três.
(C) Quatro.
(D) Cinco.
*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
- Opção (C)
- As orbitais com l = 0 são as orbitais do tipo s. São 2 eletrões na 1s e mais 2 na 2s.
- Opção (C) …………. 5 pontos
2. A tabela seguinte apresenta os valores de energia dos níveis n = 1, n = 2, n = 3 e n = 4 do átomo de hidrogénio.

- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
2.1. Qual é a energia mínima necessária para remover o eletrão de um átomo de hidrogénio no estado fundamental?
⇒ A energia mínima necessária para remover o eletrão de um átomo de hidrogénio (isolado) no estado fundamental, Erem, pode ser determinada pela expressão:
Erem = E∞ – E1 que muitas vezes surge de forma simplificada Erem = – E1 dado que E∞ → 0
E∞ – energia do eletrão quando se encontra fora da ação do núcleo
E1 – energia do eletrão no estado fundamental
- Erem = E∞ – E1 ⇔ Erem = 0 – (–2,18 × 10–18) = 2,18 × 10–18 J
⇒ A energia mínima necessária para remover o eletrão de um átomo de hidrogénio (isolado) no estado fundamental é 2,18 ×10-18 J.
- 2,18 × 10-18 J …….. 5 pontos
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
2.2. Considere um átomo de hidrogénio no estado fundamental, no qual incide radiação de energia 1,80 × 10-18 J.
Conclua, justificando, se ocorre, ou não, transição do eletrão.
Processo 1:
⇒ Determinar a energia necessária para ocorrer a transição do nível a que corresponde n = 1 para o nível a que corresponde n = 2.
- ΔE = En=2 – En=1 ⇔ ΔE = −5,54 ×10-19 –(−2,18 ×10-18) ⇔ ΔE = 1,63 ×10-18 J
⇒ Determinar a energia necessária para ocorrer a transição do nível a que corresponde n = 1 para o nível a que corresponde n = 3.
- ΔE = En=3 – En=1 ⇔ ΔE = −2,42 ×10-19 –(−2,18 ×10-18 ) ⇔ ΔE = 1,94 ×10-18 J
⇒ Não vai ocorrer transição do eletrão porque a energia da radiação incidente é maior que a energia necessária para que ocorra transição do nível a que corresponde n = 1 para o nível a que corresponde n = 2 ( 1,80 ×10-18 J >1,63 ×10-18 J) e é menor que a energia necessária para que ocorra transição do nível a que corresponde n=1 para o nível a que corresponde n = 3 ( 1,80 ×10-18 J < 1,94 ×10-18 J)
Processo 2:
⇒ Determinar a energia do nível para o qual o eletrão transitaria se ocorresse absorção da energia incidente.
⇒ Se ocorrer a transição do eletrão este transitará para um nível energético (que corresponderá a um estado excitado) que terá a energia do estado fundamental mais a energia incidente)
- En=? = En=1 + ERadiação ⇔ En=? = −2,18 ×10-18 + 1,80 ×10-18 ⇔ En=? = −3,80 ×10-19 J
⇒ Este valor não corresponde à energia de qualquer nível do átomo de hidrogénio, pois esta energia é maior que a energia do nível a que corresponde n = 2 e menor que a energia do nível a que corresponde n=3, concluindo-se assim que não ocorre transição do eletrão.
Processo 3:
⇒ Determinar a energia do nível para o qual o eletrão transitaria se ocorresse absorção da energia incidente
⇒ Se ocorrer a transição do eletrão este transitará para um nível energético (que corresponderá a um estado excitado) que terá a energia do estado fundamental mais a energia incidente)
- En=? = En=1 + Eincidente ⇔ En=? = −2,18 ×10-18 +1,80 ×10-18 ⇔ En=? = −3,80 ×10-19 J
⇒ Determinar, através da expressão de Bohr para o átomo de hidrogénio, o número quântico principal, n, que caraterizaria esse nível.
- En = – 2,18 x 10-18/n2
n – número quântico principal
En – Energia do nível que possui número quântico n

- o que é impossível pois o número quântico principal, n, só pode assumir valores inteiros naturais (n=0, 1, 2, 3, 4, …) concluindo-se assim que não ocorre transição do eletrão.
- Tópicos de referência:
A) Verifica-se que, somando a energia da radiação incidente à energia do nível n = 1, se obtém um valor de energia (-3,8 × 10-19 J) que não corresponde à energia de qualquer nível do átomo de hidrogénio ou equivalente.
B) Conclui-se, assim, que não ocorre transição do eletrão.

- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
2.3. As transições eletrónicas no átomo de hidrogénio originam riscas diferenciadas nos espectros atómicos deste elemento.
O espectro de emissão do átomo de hidrogénio na região do visível apresenta, entre outras riscas, uma risca a uma energia de 4,84 × 10-19 J.
Considerando a transição que origina essa risca, a energia do nível em que o eletrão se encontrava inicialmente pode ser calculada pela expressão
(A) (-5,45 × 10-19 + 4,84 × 10-19) J
(B) (-5,45 × 10-19 – 4,84 × 10-19) J
(C) (-2,18 × 10-18 + 4,84 × 10-19) J
(D) (-2,18 × 10-18 – 4,84 × 10-19) J
- Opção (A)
⇒ As radiações visíveis (série de Balmer) de emissão resultam de transições do eletrão, no átomo de hidrogénio, de níveis caraterizados por número quântico principal, n, maior que 2 e inferior a 8, para o nível caraterizado pelo número quântico principal, n, igual a 2.
⇒ Calcular a energia do nível em que o eletrão se encontrava, En>2 :
- ΔE = Eestado final − Eestado inicial
⇒ Onde a variação de energia, ΔE, corresponde à energia da radiação emitida, Eemitida, a energia do estado final, Eestado final, corresponde à energia do nível caraterizado pelo número quântico principal, n, maior que 2, En>2 e a energia do estado inicial, Eestado inicial, corresponde à energia do nível caraterizado pelo número quântico principal, n, igual a 2, En=2.
- Eemitida = En>2 − En=2 ⇔ En>2 = Eemitida + En=2 ⇔ En>2= 4,84 ×10-19 − 5,45 ×10-19 ⇔ En>2 = (−5,45 ×10-19 + 4,84 ×10-19)J
- Opção (A) …………. 5 pontos
GRUPO VI
A reação de síntese do amoníaco pode ser traduzida por
N2 (g) + 3 H2 (g) ⇋ 2 NH3 (g) ΔH = -92 kJ mol-1
Considere que se introduziu, num reator com a capacidade de 1,00L, uma mistura de nitrogénio, hidrogénio e amoníaco, em fase gasosa, em diferentes concentrações.
O gráfico da Figura 4 representa a evolução, ao longo do tempo, t, das concentrações, c, dessas substâncias, à temperatura T.

- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
1. Qual foi a variação da concentração de H2(g) no intervalo de tempo [0, t1] ?
⇒ Por leitura gráfica verifica-se que:
- [H2]inicial = [H2]0 ⇔ [H2]0 = 0,500 mol dm-3
- [H2]final = [H2]t1 ⇔ [H2]t1 = 0,400 mol dm-3
⇒ Determinar a variação da concentração:
- Δ[H2] = [H2]final – [H2]inicial ⇔ Δ[H2] = [H2]t1 – [H2]0 ⇔ Δ[H2] = 0,400 – 0,500 ⇔ Δ[H2] = – 0,100 mol dm−3
⇒ A variação da concentração de H2 (g) no intervalo de tempo [0, t1] foi de – 0,100 mol dm−3 .
- -0,100 mol dm-3 ou [a concentração de H2(g)] diminui 0,100 mol dm-3. …….. 5 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
2. A fração molar de NH3, na mistura gasosa inicialmente introduzida no reator, é
(A) 7,1 × 10-2
(B) 6,7 × 10-2
(C) 3,6 × 10-1
(D) 2,1 × 10-1
- Opção (B)
⇒ Determinar a quantidade de cada constituinte do sistema na mistura gasosa inicialmente introduzida no reator
n(NH3) = [NH3] x V = 0,050 x 1,0 = 0,050 mol
n(N2) = [N2] x V = 0,500 x 1,0 = 0,500 mol
n(H2) = [H2] x V = 0,200 x 1,0 = 0,200 mol
⇒ Calcular a fração molar de NH3 na mistura gasosa inicial

- Opção (B) …………. 5 pontos
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
3. Calcule o rendimento da reação de síntese do NH3 (g), nas condições consideradas.
Apresente todas as etapas de resolução.
⇒ Determinar a quantidade de cada reagente:
- n(H2) = [H2] x V = 0,500 x 1,0 = 0,500 mol
- n(N2) = [N2] x V = 0,200 x 1,0 = 0,200 mol
⇒ Determinar o reagente limitante:
- De acordo com a estequiometria da reação 1 mol de N2 reage com 3 mol de H2, assim, 0,200 mol de (0,200 mol dm–3 x 1,00 dm3) reagiriam com 0,200 mol x 3 = 0,600 mol de H2.
- Estando disponíveis, inicialmente, apenas 0,500 mol de H2 (0,500 mol dm–3 x 1,00 dm3), este é o reagente limitante.
⇒ Determinar a quantidade de NH3 teoricamente prevista, n(NH3)p., a que se formaria se a reação fosse completa:
- Tendo em consideração a estequimetria da reação e o reagente limitante, H2, verifica-se que por cada três mol de H2 que reage formar-se-iam duas de NH3.
- n(NH3)p. = (2/3) n(H2)utilizado = (2/3) x 0,500 = 0,333 mol
⇒ Determinar a quantidade de NH3 obtida:
- n(NH3)obtido = n(NH3)eq – n(NH3)inicio = 0,139 mol dm-3 x 1,00 dm3 – 0,050 mol dm-3 x 1,00 dm3 = 0,089 mol
⇒ Determinar o rendimento da reação de síntese do amoníaco:

- Etapas de resolução:
A) Determinação da quantidade de NH3(g) que se formaria, de acordo com a estequiometria da reação, a partir da quantidade inicial do reagente limitante, H2(g) (n = 0,333 mol) …….. 6 pontos
B) Determinação da quantidade de NH3(g) que se forma, nas condições consideradas (n = 0,089 mol) …….. 4 pontos
C) Determinação do rendimento da reação de síntese, nas condições consideradas (26,7% ou 0,267) …….. 5 pontos
- 10ºano – Química – Domínio 2 – subdomínio 3 (Transformações químicas)
4. Na reação de síntese do NH3 (g) considerada
(A) libertam-se 92 kJ por cada mole de NH3 (g) que se forma.
(B) libertam-se 92 kJ por cada duas moles de NH3 (g) que se formam.
(C) são absorvidos 92 kJ por cada mole de NH3 (g) que se forma.
(D) são absorvidos 92 kJ por cada duas moles de NH3 (g) que se formam.
- Opção (B)
⇒ A reação de síntese do amoníaco apresenta uma variação de entalpia negativa, o que significa haver libertação de energia.
⇒ O coeficiente estequiométrico do amoníaco, NH3, na equação química indica que é por cada duas moles de NH3 formadas.
- Opção (B) …………. 5 pontos
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
5. Preveja, justificando, como variará a composição da mistura reacional se ocorrer um aumento da temperatura do sistema em equilíbrio.
⇒ De acordo com o Princípio de Le Châtelier, um aumento de temperatura favorece a transformação em que ocorre absorção de energia (reação endotérmica), que neste caso é a reação inversa (sendo negativa a variação de entalpia, a reação direta ocorre com libertação de energia).
⇒ Prevê-se que as concentrações de reagentes, hidrogénio e nitrogénio, irão aumentar e a do produto, amoníaco, irá diminuir em relação aos valores em equilíbrio antes do aumento de temperatura.
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
6. A representação da molécula de NH3 através da notação de Lewis evidencia
(A) a geometria da molécula.
(B) apenas os eletrões de valência partilhados da molécula.
(C) a orientação espacial da molécula.
(D) todos os eletrões de valência da molécula.
- Opção (D)
⇒ Na notação de Lewis apenas se representam os eletrões de valência (ligantes e não ligantes).
- Opção (D) …………. 5 pontos
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
7. Qual das opções seguintes pode representar um modelo tridimensional da molécula de NH3 que evidencie as ligações que se estabelecem entre os átomos?

- Opção (A)
⇒ Na molécula de amoníaco cada um dos três átomos de hidrogénio liga-se ao nitrogénio.
⇒ A molécula assume uma geometria piramidal triangular, ocupando o nitrogénio um dos vértices da pirâmide.
- Opção (A) …………. 5 pontos
GRUPO VII
A ionização do amoníaco em água pode ser traduzida por
NH3 (aq) + H2O (l) ⇋ OH– (aq) + NH4+ (aq)
1. Considere uma solução aquosa de amoníaco, de concentração 0,10 mol dm-3, cujo pH, a 25 ºC, é 11,1.
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
1.1. Verifique que a ordem de grandeza da constante de basicidade do NH3 (aq), à mesma temperatura, é 10-5.
Apresente todas as etapas de resolução.
- [H3O+] = 10-pH = 10-11.1 = 7,943 x 10-12 mol dm-3
⇒ Cálculo da concentração do ião hidróxido:
⇒ De acordo com a estequiometria da reação e, desprezando a contribuição da autoionização da água, conclui-se que [OH–] = [NH4+] cuja ordem de grandeza é 10–3 mol dm–3.
⇒ Como a ionização do amoníaco é pouco extensa (a concentração do ião amónio é cerca de 102 vezes menor do que a do amoníaco), [NH3]eq é da mesma ordem de grandeza que [NH3]inicial: 10–1 mol dm–3.
⇒ A ordem de grandeza da constante de basicidade

- Etapas de resolução:
A) Cálculo da concentração de OH–(aq) (c = 1,259 × 10-3 mol dm-3) …….. 3 pontos
B) Identificação da concentração de NH4+ (aq) com a concentração de OH–(aq) …….. 2 pontos
C) Determinação da ordem de grandeza da constante de basicidade do NH3 (aq) (10-5) …….. 5 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
1.2. Retiraram-se 50,0 cm3 da solução aquosa de amoníaco referida e transferiu-se esse volume de solução para um balão volumétrico de 250,0mL, adicionando-se, em seguida, água destilada até ao traço de referência do balão.
A concentração da solução de amoníaco obtida será
(A) 2,0 × 10-2 mol dm-3
(B) 2,5 × 10-2 mol dm-3
(C) 4,0 × 10-2 mol dm-3
(D) 5,0 × 10-2 mol dm-3
- Opção (A)
⇒ Determinar a quantidae de NH3 existente em 50, 0 cm3 de solução aquosa de NH3 0,10 mol dm-3
- [NH3] = n/V ⇔ n = [NH3] x V = 0,10 x 5,00 x 10-3 ⇔ n = 5,00 x 10-3 mol
⇒ Calcular a concentração de NH3 nos 250,0 cm3 de solução aquosa de NH3 obtida
- [NH3] = n/V ⇔ [NH3] = 5,00 x 10-3/0,250 = 2,0 x 10-2 mol dm-3
ou
⇒ O volume aumenta 5 vezes:
⇒ Uma vez que a quantidade de amoníaco é constante (apenas se adiciona água), a concentração diminui 5 vezes:

- Opção (A) …………. 5 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
2. Escreva a equação que traduz a reação da espécie NH4+ com a água.
⇒ A espécie é o ácido conjugado do amoníaco pelo que em água vai apresentar comportamento ácido de acordo com a equação
- NH4+ (aq) + H2O (l) ⇋ NH3 (aq) + H3O+ (aq)
NH4+ (aq) + H2O (l) ⇋ NH3 (aq) + H3O+ (aq)
Notas:– A omissão da indicação do(s) estado(s) físico(s) de uma ou mais espécies não implica qualquer desvalorização.
– A apresentação de → (em vez de ⇋) implica uma desvalorização de 2 pontos.
FIM







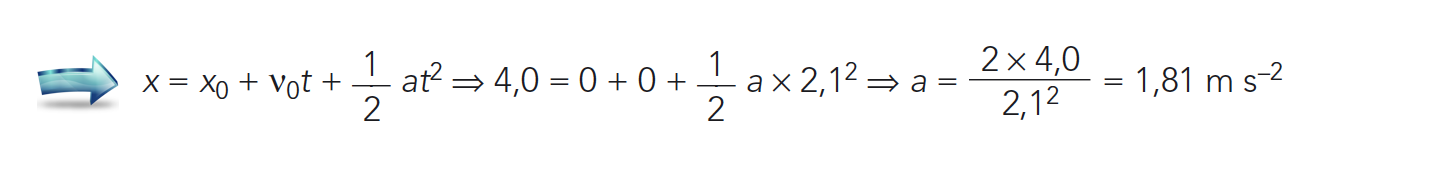






Adorei o facto de poder resolver os exame e ter as soluções explicadas na hora, muito mais prático. Porém acho que encontrei um erro na correção, posso estar enganado, mas é na pergunta 2.1 do grupo III. acho que trocou o hqueda com o hapós na equação da reta mas foi apenas esse. De uma forma geral, como já disse, adorei o facto de as soluções estarem explicadas por tópicos e serem muito fáceis de usar. Irei continuar a usar 🙂