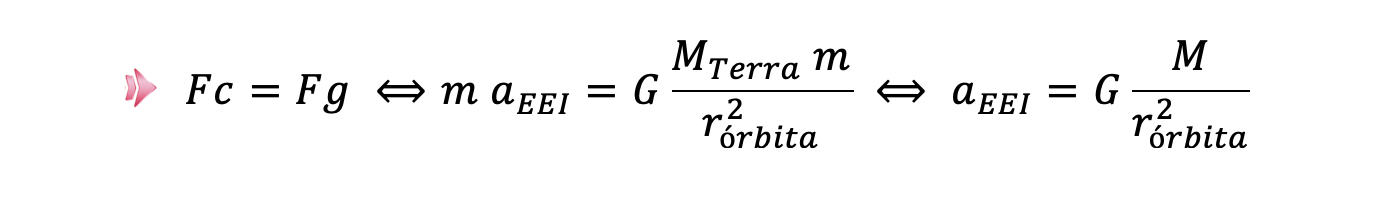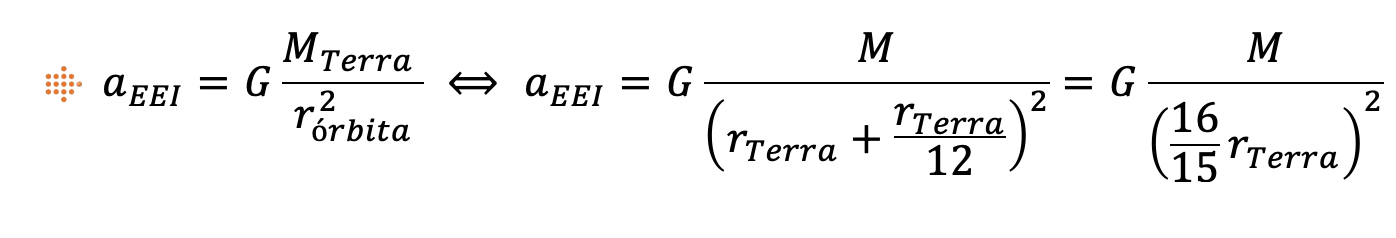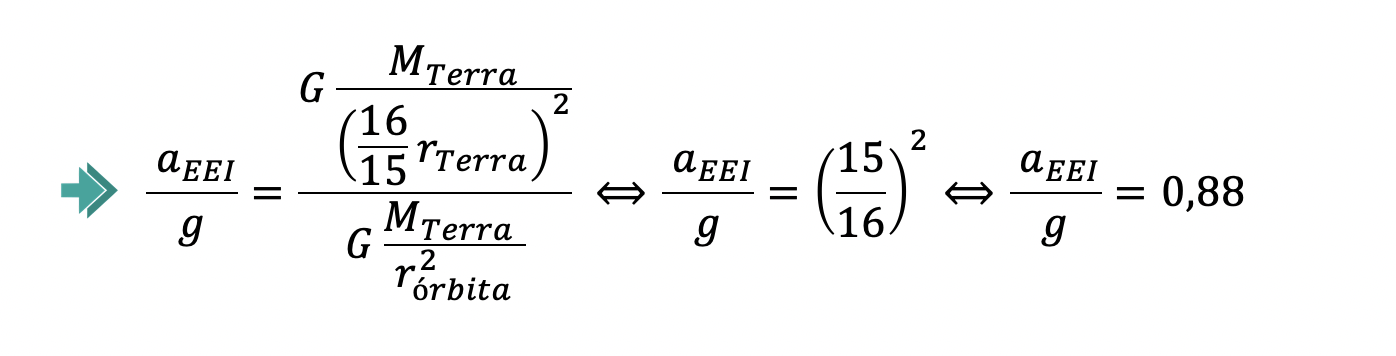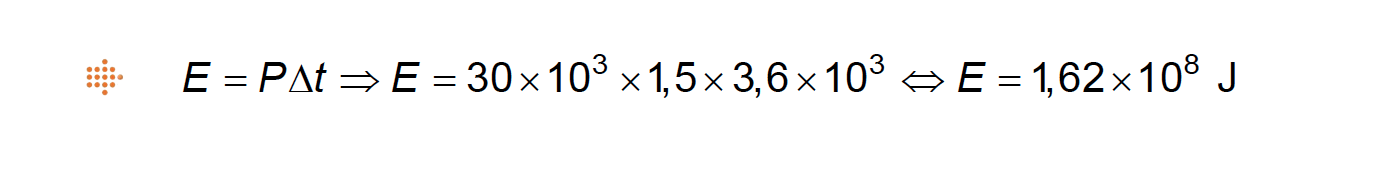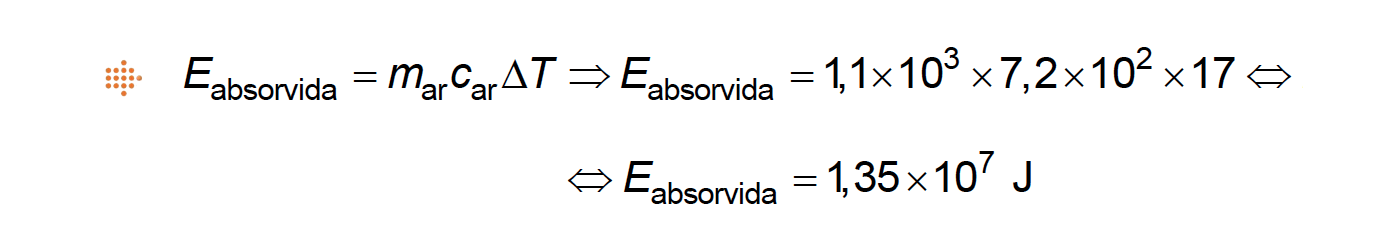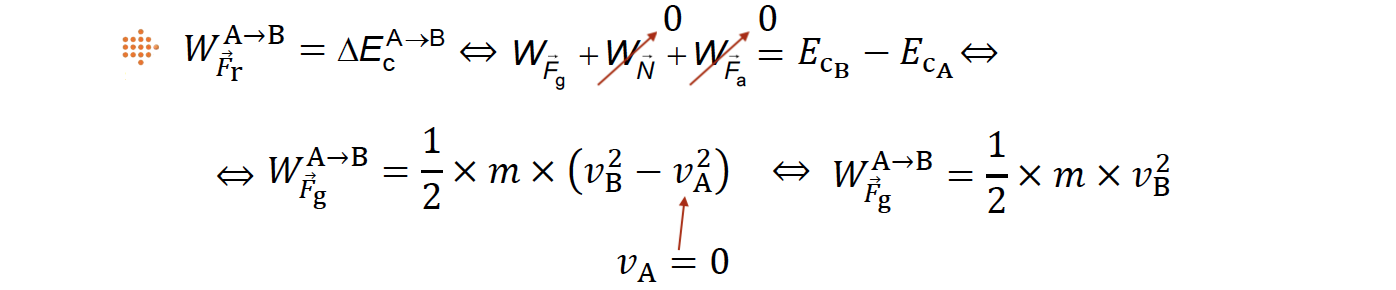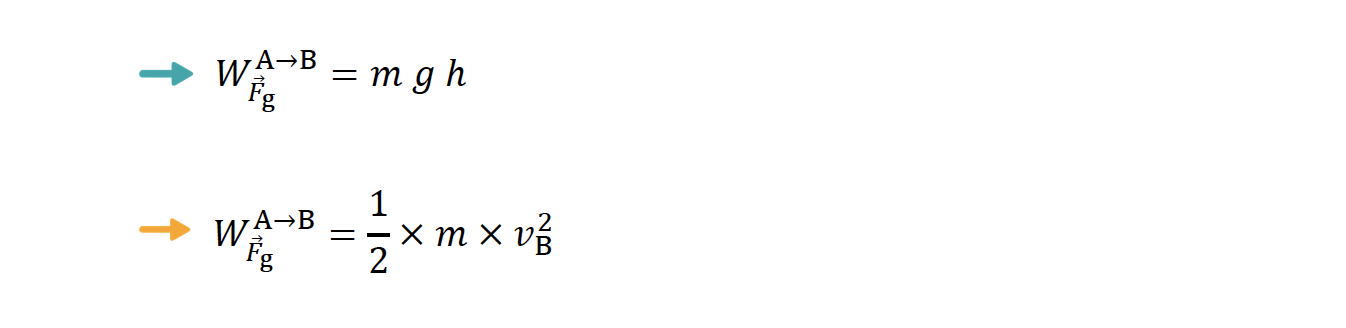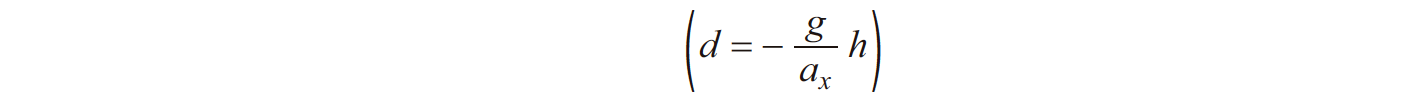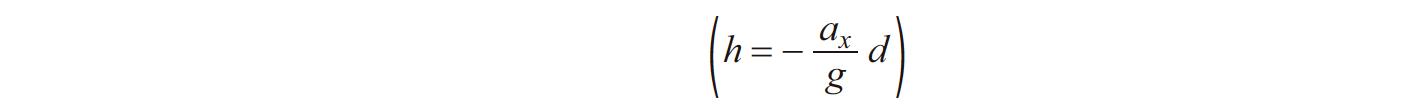2021 – 2ªFase – Prova Escrita de FQ A
Voltar a: Física e Química
Prova Escrita de Física e Química A – versão 1
Prova 715: 2.ª Fase – 2021
A prova inclui 16 itens, devidamente identificados no enunciado, cujas respostas contribuem obrigatoriamente para a classificação final.
Dos restantes 8 itens da prova, apenas contribuem para a classificação final os 4 itens cujas respostas obtenham melhor pontuação.
1. Considere os elementos químicos cloro e bromo, que pertencem ao mesmo grupo da tabela periódica.
- 10ºano – Química – Domínio 1 – subdomínio 3 (Tabela periódica)
1.1. Explique por que razão a energia de ionização dos átomos destes elementos tem tendência a diminuir ao longo do grupo.
Escreva um texto estruturado, utilizando linguagem científica adequada.
- Os elementos cloro (17Cl) e bromo (35Br) estão localizados, na Tabela Periódica, no grupo 17 e nos períodos 3 e 4, respetivamente.
⇒ O número de eletrões de valência dos átomos desses elementos é o mesmo (7), mas o número de níveis de energia aumenta ao longo do grupo.
⇒ No estado fundamental, os átomos de cloro têm 3 níveis de energia ocupados e os de bromo têm 4.
⇒ Por existir maior número de eletrões internos no átomo de bromo do que no de cloro, a atração efetiva entre o núcleo e um dos eletrões mais externos é menor no bromo do que no cloro, porque surgem maiores repulsões entre os eletrões interiores do bromo que contrariam o efeito atrativo do núcleo (que se diz blindado ou protegido).
- Prevê-se que, ao longo do grupo, diminua a energia mínima necessária para remover um eletrão de valência de um átomo isolado, no estado fundamental, isto é, que a primeira energia de ionização vá diminuindo com o aumento do número atómico ao longo do grupo.
- Elementos de resposta:
⇒ [ao longo do grupo,] os eletrões de valência encontram-se em níveis [de energia] sucessivamente mais elevados;
⇒ [ao longo do grupo,] há diminuição da atração entre os eletrões de valência e os respetivos núcleos [uma vez que há um maior afastamento destes em relação aos núcleos];
⇒ [ao longo do grupo,] há diminuição da energia mínima necessária para remover um dos eletrões de valência.

- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
1.2. Duas das riscas do espectro de emissão atómico do cloro são originadas por fotões de energias 14,7 x 10-19 J e 2,4 x 10-19 J.
Desta afirmação pode concluir-se que, no átomo de cloro,
(A) existe um nível cuja energia é – 12,3 x 10-19 J.
(B) existe um nível cuja energia é – 14,7 x 10-19 J.
(C) existem níveis cuja diferença de energia é 12,3 x 10-19 J.
(D) existem níveis cuja diferença de energia é 14,7 x 10-19 J.
- Opção (D)
- Os átomos excitados, no estado gasoso, podem perder o excesso de energia (desexcitação) sob a forma de radiação.
⇒ Cada uma das riscas do espetro de emissão atómico corresponde à emissão de fotões com determinada energia.
⇒ Quando um átomo passa de um estado de energia para um estado de menor energia, E2, emite um fotão de energia igual à diferença dessas duas energias:
- ΔE = E2 – E1
⇒ Podemos concluir-se que no átomo de cloro existem níveis cuja diferença de energia é 2,4 x 10-19 J.
⇒ Como uma das riscas do espetro de emissão atómico do cloro é originada por fotões de energia 14,7 x 10-19 J, pode concluir-se que, no átomo de cloro, existem níveis cuja diferença de energia é 14,7 x 10-19 J.
- Opção (D) ……………. 10 pontos
1.3. Num reator com a capacidade de 1,0 L, contendo uma mistura gasosa de bromo, Br2 (g), cloro, Cl2 (g), e cloreto de bromo, BrCl (g), à temperatura T, ocorre a reação exotérmica traduzida por
Br2 (g) + Cl2 (g) 2 BrCl (g)
A constante de equilíbrio, Kc , da reação é 7,7 , à temperatura T.
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
1.3.1. Admita que a quantidade inicial de BrCl (g), na mistura gasosa existente no reator, é 1,11 mol.
Quando o sistema atinge um estado de equilíbrio, à temperatura T, as quantidades de Cl2 (g) e de BrCl (g) na mistura gasosa são, respetivamente, 0,25 mol e 0,80 mol.
Determine a quantidade inicial de Br2 (g) na mistura gasosa.
Apresente todos os cálculos efetuados.

⇒ A quantidade de BrCl que reagiu até atingir o estado de equilíbrio foi:
- n(BrCl)consumida = 1,11 – 0,80 = 0,31 mol
⇒ De acordo com a estequiometria da reação, 1 (Br2) : 2 (BrCl), a quantidade de formado até atingir o estado de equilíbrio foi 0,31/2 = 0,155 mol.
- n (Br2)inicial = n(Br2)equilibrio – 0,155 = 0,332 – 0,155 = 0,177 mol = 0,18 mol
ou
Br2 (g) + Cl2 (g) 2 BrCl (g) ΔH < 0 Kc = 7,7 (à temperatura T)
⇒ Seja a quantidade formada de Br2 (e a de Cl2) e 2x a quantidade gasta de BrCl:

- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a concentração de Br2 (g) no estado de equilíbrio (0,332 mol dm-3) …….. 4 pontos
⇒ Calcula a quantidade de BrCl (g) que reagiu até atingir o estado de equilíbrio ( 0,310 mol) …….. 3 pontos
⇒ Calcula a quantidade inicial de Br2 (g) (0,180 mol) …….. 3 pontos
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
1.3.2. Admita que, uma vez atingido o estado de equilíbrio, à temperatura T, ocorre um aumento de temperatura.
Até ser atingido um novo estado de equilíbrio, prevê-se que a concentração de Br2 (g) ____ e que a variação das concentrações de Br2 (g) e de Cl2 (g) seja ____.
(A) diminua … diferente
(B) aumente … diferente
(C) diminua … igual
(D) aumente … igual
- Opção (D)
⇒ A temperatura só tem efeito sobre a posição de equilíbrio do sistema reacional se a reação for exotérmica ou endotérmica.
⇒ Como a reação é exotérmica, ΔH < 0, de acordo com o princípio de Le Châtelier, o aumento de temperatura provoca o deslocamento do equilíbrio no sentido em que contraria essa elevação de temperatura, favorecendo a reação que absorve calor, ou seja, deslocando o equilíbrio no sentido endotérmico (sentido inverso).
⇒ Consequentemente, até ser atingido um novo estado de equilíbrio, prevê-se que a concentração de Br2 (g) aumente.
⇒ Como, de acordo com a estequiometria da reação, 1 Br2 (g) : 1 Cl2 (g), a variação das concentrações de Br2 (g) e Cl2 (g) de são iguais.
- Opção (D) ……………. 10 pontos
2. A Estação Espacial Internacional (EEI; em inglês, International Space Station – ISS) move-se em torno da Terra, numa órbita aproximadamente circular.
Admita que a região em que a EEI se move pode ser considerada como vácuo.
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
2.1. A EEI orbita a uma altitude cerca de 15 vezes inferior ao raio da Terra.
Qual das expressões seguintes traduz corretamente a relação entre o módulo da aceleração da EEI, aEEI, e o módulo da aceleração gravítica à superfície da Terra, g ?
(A) aEEI = 0,94 g
(B) aEEI = 0,88 g
(C) aEEI = 6,7 x 10-2 g
(D) aEEI = 4,4 x 10-3 g
- Opção (B)
⇒ O módulo da aceleração gravítica à superfície da Terra é dado por:
⇒ Uma vez que a região em que a EEI se move pode ser considerada como vácuo, a resultante das forças que atuam na EEI coincide com a força que a Terra exerce sobre a EEI em órbita. Logo,
⇒ Como 𝑟órbita=𝑟Terra+ℎ, em que a altitude, ℎ, é cerca de 15 vezes inferior ao raio da Terra, vem:
⇒ Comparando o módulo da aceleração da EEI com o módulo da aceleração gravítica à superfície da Terra, tem-se:
⇒ A expressão que traduz corretamente a relação entre o módulo da aceleração da EEI, 𝑎EEI, e o módulo da aceleração gravítica, 𝑔, à superfície da Terra é 𝑎EEI = 0,88 𝑔.
- Opção (B) ……………. 10 pontos
2.2. As paredes da EEI são revestidas por uma superfície refletora e são constituídas por materiais de baixa condutividade térmica.
A estação dispõe ainda de um sistema de controlo de temperatura que permite regular a transferência de energia para o espaço.
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
2.2.1. A superfície refletora permite ____ a absorção da radiação solar, e a transferência de energia da estação para o espaço ocorre, essencialmente, por ____.
(A) minimizar … radiação
(B) maximizar … radiação
(C) minimizar … condução
(D) maximizar … condução
- Opção (A)
⇒ A superfície refletora permite minimizar a absorção da radiação solar, e a transferência de energia da estação para o espaço ocorre, essencialmente, por radiação.
Notas:
⇒ Sendo as paredes da EEI revestidas por uma superfície refletora, o que significa que a fração de radiação incidente que é refletida é elevada, ou seja, é minimizada a absorção de radiação solar.
⇒ A condução térmica é explicada através da interação das partículas constituintes dos sistemas (o mesmo pode ser referido para a convecção). Uma vez que se admitiu que a região em que a EEI se move pode ser considerada como vácuo, a condução térmica não é possível.
⇒ Resta, portanto, como mecanismo de transferência de energia, a radiação.
- Opção (A) ……………. 10 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
2.2.2. O período orbital da EEI é 1,5 horas.
Admita que, numa dada zona da EEI:
– para manter a temperatura do ar, é necessário que a potência transferida para o espaço seja, em média, 30 kW por cada órbita;
– a massa de ar nessa zona é 1,1 x 103 kg, e a capacidade térmica mássica do ar é 7,2 x 102 J kg-1 ºC-1.
Devido a uma avaria, verificou-se que a temperatura do ar naquela zona aumentou 17 ºC, no intervalo de tempo que a EEI leva a descrever uma órbita.
Calcule a percentagem da energia absorvida pelo ar existente naquela zona da EEI, em relação à energia que deveria ter sido transferida para o espaço.
Apresente todos os cálculos efetuados.
⇒ Cálculo da energia da radiação emitida pela EEI durante uma órbita, em média, para o espaço na ausência de avaria:
⇒ Cálculo da variação de energia interna da amostra de ar (energia absorvida pelo ar, 𝐸abs.) existente numa dada zona no interior da EEI:
⇒ Cálculo da percentagem da energia absorvida pelo ar existente naquela zona no interior da EEI, em relação à energia que deveria ter sido transferida para o espaço:

- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a energia absorvida pelo ar existente na zona considerada da EEI, naquele intervalo de tempo (1,35 x 107 J) …….. 5 pontos
⇒ Calcula a percentagem da energia absorvida pelo ar existente na zona considerada da EEI, em relação à energia que deveria ter sido transferida para o espaço ( 8,3 %) …….. 5 pontos
- 11ºano – Química – Domínio 1 – subdomínio 1 (Aspetos quantitativos das reações químicas)
2.3. Na EEI é possível, a partir do dióxido de carbono, CO2 (g), expirado, obter oxigénio, O2 (g), que é utilizado na zona habitável da estação.
A formação de O2 (g) pode ser traduzida por
CO2 (g) + 4 H2 (g) → CH4 (g) + 2 H2O (g) (1)
2 H2O (l) → 2 H2 (g) + O2 (g) (2)
2.3.1. O hidrogénio, H2 (g), produzido na reação (2) é reutilizado na reação (1).
Que quantidade de H2 pode ser reutilizada, no máximo, por cada mole de H2 consumida?
- Opção (C)
⇒ As duas equações (1) e (2) mostram que se consomem 4 moles de para originar 2 moles de (que vão regenerar 2 moles de H2). No final, teremos o consumo efetivo de 2 moles de H2, ou seja, por cada mole de consumida podem reutilizar-se 0,5 moles.
ou
⇒ De acordo com a estequiometria da reação (1), 2 H2 (g) : 1 H2O (l), a quantidade de H2O (l) produzida é metade da quantidade de H2 (g) consumido.
⇒ De acordo com a estequiometria da reação (2), 1 H2O (l) : 1 H2 (g), conclui-se que a quantidade de H2 (g) produzido é igual à quantidade de H2O consumida.
- A quantidade de H2 (g) que, no máximo, pode ser reutilizada por cada mole de H2 (g) consumido será 0,5 mol.
- Apresenta o valor solicitado (0,50 mol) ……………. 10 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
2.3.2. Considere que, na zona habitável da EEI, existem 4,1 x 10-2 mol de moléculas por cada dm3 de ar, sendo 7,0 x 10-3 a fração molar de CO2 .
Admita que se consegue recuperar uma quantidade de O2 igual a 2/5 da quantidade de CO2 .
Determine o volume de ar necessário para se conseguir recuperar 1,0 g de O2 .
Apresente todos os cálculos efetuados.
- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a quantidade de CO2 que existe por cada dm3 de ar (2,87 x 10-4 mol) …….. 3 pontos
⇒ Calcula a quantidade de O2 que se recupera por cada dm3 de ar (1,15 x 10-4 mol) …….. 3 pontos
⇒ Calcula o volume de ar necessário para se conseguir recuperar 1,0 g de O2 (2,7 x 102 dm3) …….. 4 pontos
ou
⇒ Calcula a quantidade de CO2 que permite recuperar 1,0 g de O2 (7,81 x 10-2 mol) …….. 3 pontos
⇒ Calcula a quantidade total de moléculas no ar necessária para se conseguir recuperar 1,0 g de O2 (11,2 mol) …….. 3 pontos
⇒ Calcula o volume de ar necessário para se conseguir recuperar 1,0 g de O2 (2,7 x 102 dm3) …….. 4 pontos
3. O ácido hipobromoso, HBr O (aq ), usado como antimicrobiano, é um ácido cuja ionização em água se pode traduzir por
HBrO (aq) + H2O (l) BrO– (aq) + H3O+ (aq) Ka = 2,8 x 10-9 , a 25 ºC
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
3.1. A espécie HBrO (aq) tem uma ação antimicrobiana mais eficaz do que a espécie BrO– (aq).
Um aumento de pH favorece a reação
(A) direta, aumentando a eficácia antimicrobiana do ácido hipobromoso.
(B) inversa, aumentando a eficácia antimicrobiana do ácido hipobromoso.
(C) direta, diminuindo a eficácia antimicrobiana do ácido hipobromoso.
(D) inversa, diminuindo a eficácia antimicrobiana do ácido hipobromoso.
- Opção (C)
HBrO (aq) + H2O (l) BrO– (aq) + H3O+ (aq)
⇒ Com um aumento de pH (pH = – log [H3O+]) conduz a uma diminuição de [H3O+].
⇒ De acordo com o princípio de Le Châtelier, uma diminuição da [H3O+] provoca o deslocamento do equilíbrio no sentido em que contraria essa diminuição, ou seja, no sentido direto.
⇒ A evolução do sistema no sentido direto provoca uma diminuição da concentração da espécie HBrO (aq) e um aumento da espécie BrO– (aq), e como a espécie HBrO (aq) tem uma ação antimicrobiana mais eficaz do que a espécie BrO–, conclui-se que a eficácia antimicrobiana do ácido hipobromoso diminui.
- Opção (C) ……………. 10 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
3.2. Adicionando algumas gotas de uma solução concentrada de uma base forte a uma solução aquosa de HBr O, obteve-se uma solução cujo pH, a 25 oC, é 8,25.
Verifique que, na solução resultante, 1/3 do ácido hipobromoso está ionizado.
Explicite o seu raciocínio.
⇒ Considerando que a “solução concentrada de uma base forte” se trata de uma “solução aquosa concentrada de um hidróxido que se comporta como uma base forte”, se pH = 8,25, a concentração hidrogeniónica da solução, após adição da solução de base forte:
- pH = – log [H3O+] ⇔ [H3O+(aq)] = 10-8,25 mol dm3 = 5,62 x 10-9 mol dm-3
Por adição da “solução concentrada de uma base forte” à solução aquosa de HBrO, ocorre a reação:
HBrO (aq) + H2O (l) BrO– (aq) + H3O+ (aq)
Como o grau de ionização, α, é a razão entre a quantidade de ácido ionizado e a quantidade inicial de ácido.
⇒ Na solução resultante, 1/3 do ácido hipobromoso está ionizado.
4. Um corpo sobre um plano inclinado, abandonado de uma altura h, acaba por parar após percorrer uma distância d num plano horizontal.
Na Figura 1 (que não está à escala), está esquematizado o percurso do corpo entre a posição inicial (posição A) e a posição final (posição C).
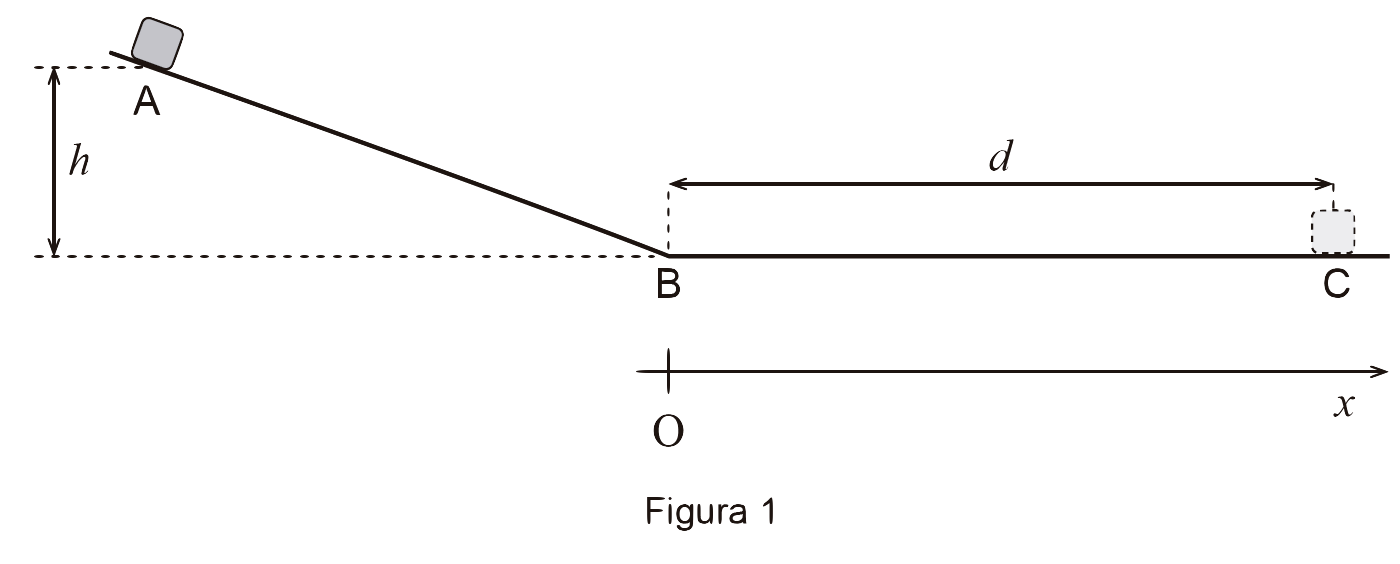
Considere o referencial Ox, representado na figura, e admita que:
– o corpo pode ser representado pelo seu centro de massa (modelo da partícula material);
– no plano inclinado, as forças de atrito que atuam no corpo são desprezáveis;
– no plano horizontal, a resultante das forças que atuam no corpo é constante.
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
4.1. Entre as posições A e C, o módulo do trabalho realizado pela força gravítica que atua no corpo, |WFg|, é igual ao módulo do trabalho realizado pela resultante das forças de atrito que atuam no corpo, |WFa|.
Comprove esta afirmação, explicitando o seu raciocínio.

⇒ Trabalho realizado pela força gravítica que atua no corpo entre as posições A e B e Teorema da Energia Cinética.
- Considera-se que, no plano inclinado, as forças dissipativas que atuam no corpo são desprezáveis. Logo, sendo a reação normal perpendicular ao plano inclinado, no percurso de A até B a única força que realiza trabalho é a força gravítica.
⇒ Usando o Teorema da Energia Cinética, tem-se:
⇒ Trabalho realizado pela força gravítica que atua no corpo entre as posições B e C e Teorema da Energia Cinética.
- No percurso de B até C, a única força que realiza trabalho é a força de atrito.
⇒ Usando o Teorema da Energia Cinética, tem-se:
⇒ Como se queria comprovar, entre as posições A e C, o módulo do trabalho realizado pela força gravítica que atua sobre o corpo é igual ao módulo do trabalho realizado pela resultante das forças de atrito que atuam sobre o corpo.

- Comprova que |WFg| = |WFa| entre A e C, apresentando os seguintes elementos de resposta:
⇒ reconhecimento de que a variação da energia cinética entre A e C é nula;
ou
- reconhecimento de que a variação da energia cinética entre A e B é simétrica da variação da energia cinética entre B e C;
⇒ referência a que, entre A e C, a variação da energia cinética seja igual à soma de WFg e WFa;
ou
- referência a que, entre A e B, a variação da energia cinética seja igual a WFg e a que, entre B e C, a variação da energia cinética seja igual a WFa .

- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
- 11ºano – Física – A.l. – 1.3 – Movimento uniformemente retardado
4.2. Numa experiência, o corpo foi abandonado de cinco alturas diferentes, sobre o plano inclinado, tendo percorrido, para cada uma das alturas, uma determinada distância no plano horizontal.
A tabela apresenta, para cada uma das alturas, h, das quais o corpo foi abandonado, a distância, d , que o corpo percorreu no plano horizontal até parar.

Determine a componente escalar da aceleração, ax , do corpo, em relação ao referencial Ox considerado, no seu movimento no plano horizontal.
Na resposta:
– deduza uma expressão que mostre que d varia linearmente com h;
– apresente a equação da reta de ajuste a um gráfico adequado;
– calcule o valor solicitado com dois algarismos significativos, a partir da equação da reta de ajuste.
Apresente todos os cálculos efetuados.
- Dedução da expressão que relaciona 𝑑 com ℎ
⇒ Trabalho realizado pela força gravítica que atua no corpo entre as posições A e B:
- A força gravítica é uma força conservativa, pelo que o trabalho por ela realizado é igual ao simétrico da variação de energia potencial gravítica.
- Enquanto o corpo se move no plano inclinado, considera-se que a única força que realiza trabalho é a força gravítica.
- O corpo abandonado em A.
⇒ Trabalho realizado pela força de atrito que atua no corpo entre as posições B e C:
- No percurso de B até C, a força de atrito é a única força que realiza trabalho.
- O corpo acaba por parar em C.
- Sendo a força de atrito a resultante das forças (e admitindo que o corpo é representado pelo seu centro de massa).
- Apresentação da equação da linha de ajuste ao gráfico 𝑑 =𝑓(ℎ)
⇒ Cálculo da componente escalar da aceleração, 𝑎𝑥

- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Deduz a expressão que relaciona d com h (ver notas 1) …….. 4 pontos
⇒ Apresenta a equação de ajuste ao gráfico d = f (h) ( d = 4,12 h – 0,02) (ver notas 2 e 3) …….. 3 pontos
⇒ Calcula a componente escalar da aceleração do corpo (-2,4 m s-2) …….. 3 pontos
ou
⇒ Deduz a expressão que relaciona d com h (ver notas 1) …….. 4 pontos
⇒ Apresenta a equação de ajuste ao gráfico h = f (d) ( h = 0,24 d + 0,01) (ver notas 2 e 3) …….. 3 pontos
⇒ Calcula a componente escalar da aceleração do corpo (-2,4 m s-2) …….. 3 pontos
Notas:
1. A omissão do sinal «−» na expressão deduzida não implica qualquer desvalorização nesta etapa.
2. Na equação da reta de ajuste, a omissão da ordenada na origem não implica qualquer desvalorização.
3. A ordem das etapas 1 e 2 é arbitrária.
5. Na Figura 2, está esquematizado um feixe fino, L1, de luz laser, que incide na superfície curva de uma placa semicilíndrica de um vidro, originando um feixe fino, L2. Este, ao passar do vidro para o ar, origina o feixe fino L3.

- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
5.1. Considere a mudança de meio de propagação da luz, na qual o feixe L1 origina o feixe L2 .
Qual é a amplitude do ângulo de refração?
- Apresenta o valor solicitado duas fórmulas químicas solicitadas (0º) ……………. 10 pontos
Nota: A ausência de unidade não implica qualquer desvalorização.
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
5.2. O feixe L3 está desviado 13,2º relativamente à direção do feixe incidente.
Determine o módulo da velocidade de propagação da luz no vidro.
Apresente todos os cálculos efetuados.

⇒ Determinação do ângulo de incidência, 𝛼inc (ângulo que o feixe L2 faz com a normal à superfície de separação dos meios óticos vidro e ar no ponto de incidência):
- αinc = 90,0º – 66,0º = 24,0º
⇒ Cálculo do ângulo de refração, 𝛼ref (ângulo que o feixe L3 faz com a normal à superfície de separação dos meios óticos vidro e ar no ponto de incidência):
- αinc = 24,0º + 13,2º = 37,2º
⇒ Usando a expressão da Lei de Snell-Descartes, vem:

- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a amplitude do ângulo de refração (37,2º) …….. 3 pontos
⇒ Calcula o índice de refração do vidro ( 1,486) …….. 4 pontos
⇒ Calcula o módulo da velocidade de propagação da luz no vidro (2,02 x 108 m s-1) …….. 3 pontos
6. Considere um corpo que desce ao longo de um plano inclinado, em condições tais que as forças dissipativas são desprezáveis.
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
6.1. O aumento da energia cinética do corpo é diretamente proporcional à ____ corpo, sendo ____ diminuição da energia potencial gravítica do sistema corpo + Terra.
(A) distância percorrida pelo … igual à
(B) distância percorrida pelo … diferente da
(C) velocidade do … diferente da
(D) velocidade do … igual à
- Opção (A)
⇒ O aumento da energia cinética do corpo é diretamente proporcional à distância percorrida pelo corpo, sendo igual à diminuição da energia potencial gravítica do sistema corpo + Terra.
Notas:
⇒ Se as forças dissipativas são desprezáveis, enquanto o corpo desce o plano inclinado, a única força que realiza trabalho é a força gravítica. Usando o Teorema da Energia Cinética, tem-se:
- 𝑊𝐹⃗g = Δ𝐸c
⇒ A força gravítica é uma força conservativa, pelo que o trabalho por ela realizado é igual ao simétrico da variação de energia potencial gravítica,
- 𝑊𝐹⃗g = − Δ𝐸pg
⇒ Conclui-se, assim, que Δ𝐸c = − Δ𝐸pg, ou seja, o aumento de 𝐸c é igual à diminuição de 𝐸pg.
⇒ Sendo as forças dissipativas desprezáveis, a componente da força gravítica na direção paralela à rampa é igual à resultante das forças, sendo o trabalho realizado por essa componente igual ao trabalho realizado pela força gravítica. Assim, Δ𝐸c = 𝑚 𝑔 sin 𝜃 𝑑, pelo que Δ𝐸c é diretamente proporcional à distância percorrida pelo corpo.
- Opção (A) ……………. 10 pontos
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
6.2. Em qual dos esquemas seguintes está representada a força, F, que o corpo exerce no plano inclinado?

- Opção (B) ……………. 10 pontos
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
6.3. Considere que o corpo desce várias vezes o plano inclinado, com sobrecargas de massas sucessivamente maiores.
Qual dos esboços de gráfico seguintes pode traduzir o módulo da aceleração, a, do conjunto corpo + sobrecarga em função da respetiva massa, m ?

- Opção (D)
⇒ O esboço de gráfico que pode traduzir o módulo da aceleração, 𝑎, do conjunto corpo + sobrecarga em função da respetiva massa, 𝑚, para sobrecargas de massas sucessivamente maiores é :
Notas:
⇒ Sendo as forças dissipativas desprezáveis, a componente da força gravítica na direção paralela à rampa é igual à resultante das forças.
⇒ Assim, 𝑚 𝑎 = 𝑚 𝑔 sin 𝜃 ⇔ 𝑎 = 𝑔 sin 𝜃, o que significa que a aceleração é independente da massa e constante para uma dada inclinação do plano.
- Opção (D) ……………. 10 pontos
7. As baterias e as pilhas são geradores de tensão contínua.
- 10ºano – Física – subdomínio 2 (Energia e fenómenos elétricos)
7.1. Considere duas baterias ideais (baterias cujas resistências internas podem ser consideradas nulas) idênticas e dois componentes puramente resistivos, P e Q , de resistências 8 kΩ e 24 kΩ , respetivamente.
Uma das baterias é ligada a P e a outra é ligada a Q.
A energia fornecida a P, relativamente à energia fornecida a Q , num mesmo intervalo de tempo, é
(A) 9 vezes menor.
(B) 3 vezes menor.
(C) 3 vezes maior.
(D) 9 vezes maior.
- Opção (C)
⇒ A energia fornecida a P, relativamente à energia fornecida a Q, num mesmo intervalo de tempo, é 3 vezes maior.
Notas:
⇒ Para uma bateria real:
- 𝑈 = 𝜀 − 𝑟 𝐼
⇒ Considerando que as duas baterias são ideais (baterias cujas resistências internas podem ser consideradas nulas) idênticas e cada uma delas está ligada só a um dos dois recetores, conclui-se que as diferenças de potencial elétrico nos terminais desses recetores são iguais:
- 𝑈P = 𝑈Q = 𝑈 = 𝜀
⇒ A energia elétrica fornecida a um recetor num dado intervalo de tempo está relacionada com a diferença de potencial elétrico nos terminais pela expressão:
- 𝐸el. = 𝑈 𝐼 Δ𝑡
⇒ Sendo os recetores puramente resistivos, essa energia também pode ser obtida a partir da expressão:
- 𝐸el = 𝑅 𝐼2 Δ𝑡
⇒ Usando a equação de definição de resistência elétrica e substituindo na última expressão, obtém-se:
- concluindo-se que para a mesma diferença de potencial elétrico e para o mesmo intervalo de tempo, a energia elétrica fornecida a um recetor é inversamente proporcional à sua resistência elétrica.
⇒ Assim:

- Opção (C) ……………. 10 pontos
- 10ºano – Física – subdomínio 2 (Energia e fenómenos elétricos)
7.2. Considere duas pilhas novas, X e Y, com as mesmas características.
A pilha X foi utilizada para alimentar um circuito elétrico durante um intervalo de tempo significativo.
A pilha Y não foi utilizada.
Qual dos esboços de gráfico seguintes pode traduzir as diferenças de potencial elétrico, U, nos terminais das pilhas X e Y, em função da corrente elétrica, I, fornecida?

- Opção (A)
⇒ O esboço de gráfico que pode traduzir as diferenças de potencial elétrico, 𝑈, nos terminais das pilhas X e Y, em função da corrente elétrica, 𝐼, fornecida, é:
Notas:
⇒ A curva característica de uma pilha é dada pela expressão:
- 𝑈 = 𝜀 − 𝑟 𝐼
⇒ Quando uma pilha é utilizada para alimentar um circuito elétrico durante um intervalo de tempo significativo, constata-se que há diminuição da diferença de potencial elétrico nos seus terminais (numericamente igual à ordenada na origem da curva característica) e aumento da sua resistência interna (numericamente igual ao simétrico do declive da curva característica).
- Opção (A) ……………. 10 pontos
8. Dois átomos de nitrogénio ligam-se entre si por uma ligação covalente tripla, formando uma molécula de N2.
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
8.1. Os eletrões de valência do átomo de nitrogénio, no estado fundamental, apresentam energias diferenciadas, todos os eletrões emparelhados.
(A) duas … estando
(B) duas … não estando
(C) três … estando
(D) três … não estando
- Opção (B)
⇒ A configuração eletrónica do átomo de nitrogénio no estado fundamental é:
- 7N – 1s2 2s2 2px1 2py1 2pz1
⇒ Os 5 eletrões de valência do átomo de nitrogénio, no estado fundamental (2 eletrões na orbital 2s e 3 eletrões nas orbitais 2p), apresentam duas energias diferentes, correspondentes às energias das orbitais 2s e 3p.
⇒ As três orbitais 2p (2px , 2py , 2pz) têm a mesma energia, ou seja, são orbitais degeneradas. De acordo com a regra de Hund, para preencher orbitais degeneradas com eletrões, estes distribuem-se de modo a ocupar, parcialmente, as orbitais vazias até ficarem todas semipreenchidas e só depois se faz o emparelhamento de eletrões. Assim, o átomo de nitrogénio tem três eletrões desemparelhados.
- Opção (B) ……………. 10 pontos
- 10ºano – Química – Domínio 1 – subdomínio 1 (Massa e tamanho dos átomos)
8.2. Qual é, em média, a massa de uma molécula de N2 ?
(A) 4,65 x 10-23 g
(B) 28,0 g
(C) 14,0 g
(D) 2,33 x 10-23 g
- Opção (A) ……………. 10 pontos
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
9. A Figura 3 representa a molécula de tricloreto de fósforo, PCl3 , utilizando a notação de Lewis.
Prevê-se que esta molécula apresente geometria
(A) triangular plana e que seja apolar.
(B) triangular plana e que seja polar.
(C) piramidal trigonal e que seja apolar.
(D) piramidal trigonal e que seja polar.
- Opção (D)
⇒ A geometria de uma molécula é aquela que conduz à sua máxima estabilidade. Segundo a teoria da repulsão dos pares eletrónicos de valência, estes dispõem-se no espaço com o maior afastamento possível, de modo a conduzir às menores repulsões eletrónicas.
⇒ Na molécula PH3, os pares eletrónicos de valência que rodeiam o átomo central, P, são três pares de eletrões ligantes, correspondentes às três ligações covalentes P – H, e um par eletrónico não ligante localizado no fósforo. O maior afastamento possível destes quatro pares obtém-se quando eles se dispõem no espaço de modo aproximadamente tetraédrico, conferindo ao conjunto PH3 uma geometria piramidal trigonal.
⇒ A polaridade das moléculas poliatómicas depende da polaridade das ligações e da geometria da molécula. A molécula PCl3, como tem ligações polares e geometria piramidal trigonal, tem uma distribuição de carga elétrica assimétrica entre os átomos, sendo, portanto, uma molécula polar.
- Opção (D) ……………. 10 pontos
- 11ºano – Química – Domínio 2 – subdomínio 2 (Reações de oxidação redução)
10. O ião ClO3– pode transformar-se na espécie ClO2 em reações que envolvem transferência de eletrões.
Numa reação em que o ião ClO3– origina a espécie ClO2 , a variação do número de oxidação do Cl é
(A) +1, prevendo-se que o ião ClO3– atue como oxidante.
(B) -1, prevendo-se que o ião ClO3– atue como oxidante.
(C) +1, prevendo-se que o ião ClO3– atue como redutor.
(D) -1, prevendo-se que o ião ClO3– atue como redutor.
- Opção (B)
⇒ n.o. (Cl) em ClO3– :
- x + 3 x (-2) = -1 ⇔ x = + 5
⇒ n.o. (Cl) em ClO2 :
- x + 2 x (-2) = 0 ⇔ x = + 4
⇒ Numa reação em que o ião ClO3– origina a espécie ClO2, o número de oxidação do elemento diminui.
⇒ Variação do seu número de oxidação:
- Δn.o. (Cl) = +4 – (+5) = -1
Houve captação de eletrões, o que significa que ocorreu uma redução. Portanto, a espécie ClO3– atua como oxidante.
- Opção (B) ……………. 10 pontos
FIM

 2 BrCl (g)
2 BrCl (g)