2019 – 1ªFase – Prova Escrita de FQ A
Voltar a: Física e Química
- Prova Escrita de Física e Química A – versão 1
- Prova 715: 1.ª Fase – 2019
GRUPO I
Uma tina de ondas é um tanque de pequena profundidade que contém água e onde é possível, utilizando um gerador adequado, produzir ondas na superfície da água. O gerador pode ser ajustado de modo a produzir ondas de frequências diferentes.
As imagens dessas ondas apresentam zonas mais claras, que correspondem a cristas , e zonas mais escuras, que correspondem a vales.
1. A Figura 1 apresenta uma imagem das ondas obtidas numa tina de ondas , numa determinada experiência.
Na figura, estão ainda representados dois pontos, A e B, à superfície da água.
- 11ºano – Física – Domínio 2 – subdomínio 1 (Sinais e ondas)
1.1. Considere que o gerador de ondas está ajustado para 5,0 Hz e que a imagem é obtida num instante t.
Quanto tempo decorrerá, no mínimo , entre o instante t e um instante no qual o ponto A se encontre num vale?
(A) 0,15 s
(B) 0,20 s
(C) 0,050 s
(D) 0,10 s
- Opção (D)
⇒ Sendo a frequência f = 5,0 Hz, o período vem dado por T=1/f = 1/5,0 = 0,20 s.
⇒ Como o ponto A está assinalado numa zona clara, o que corresponde a uma crista, o tempo mínimo que terá de decorrer até que o ponto A se encontre num vale corresponderá a meio período, T/2 = 0,10 s.
- Opção (D) ……………. 7 pontos
- 11ºano – Física – Domínio 2 – subdomínio 1 (Sinais e ondas)
1.2. Se a distância entre os pontos A e B for 15,6 cm, o comprimento de onda das ondas que se propagam na superfície da água será
(A) 1,30 cm
(B) 2,23 cm
(C) 2,60 cm
(D) 3, 12 cm
- Opção (C)
⇒ A distância entre A e B corresponde a 6 comprimentos de onda.
⇒ O comprimento de onda é, assim, dado por λ = 15,6/6 = 2,60 cm.
- Opção (C) ……………. 7 pontos
- 11ºano – Física – Domínio 2 – subdomínio 1 (Sinais e ondas)
- 11ºano – Física – A.l. – 2.2 – Velocidade de propagação do som
2. Com o objetivo de determinar a velocidade de propagação das ondas produzidas na superfície da água contida numa tina, mediu-se o comprimento de onda, λ, dessas ondas para várias frequências, f.
Na tabela seguinte, estão registados os valores de f e de λ medidos e ainda os inversos desses valores.
Determine a velocidade de propagação das ondas, em cm s-1, nas condições em que decorreu a experiência, a partir da equação da reta de ajuste a um gráfico adequado.
Na sua resposta:
– identifique as variáveis independente e dependente a considerar nos eixos do gráfico;
– apresente a equação da reta de ajuste ao gráfico;
– obtenha o valor solicitado, com um número correto de algarismos significativos.
Apresente todas as etapas de resolução, explicitando todos os cálculos efetuados.
⇒ Sendo o módulo da velocidade de propagação de uma onda dado pela expressão: v = λ f , é possível determiná-lo, a partir de um conjunto de medições e fazendo um ajuste linear aos valores dessas medições.
⇒ Considerando que λ =v/f, o comprimento de onda será a variável dependente e 1/f a variável independente a considerar nos eixos do gráfico seguinte:
⇒ Nesta situação, obtém-se por regressão linear a seguinte equação da reta:
⇒ O declive da reta é o módulo da velocidade de propagação das ondas produzidas, v = 20 cm s-1.
⇒ O menor número de algarismos significativos dos dados é dois, consequentemente o resultado final não poderá ter um número de algarismos significativos superior a esse.
⇒ O valor da ordenada na origem pode ser considerado nulo dentro das incertezas das medidas, como seria de esperar atendendo à expressão v = λ f .
⇒ O módulo da velocidade de propagação pode ser obtido de modo idêntico, considerando a relação:
- em que a frequência será a variável independente e 1/λ a variável dependente a considerar nos eixos do gráfico.
⇒ Nesta opção, o módulo da velocidade será o inverso do declive obtido.
- Etapas de resolução:
⇒ Apresentação da equação da reta de ajuste
ou
⇒ Apresentação da equação da reta de ajuste (ver nota) …….. 5 pontos
⇒ Determinação da velocidade de propagação das ondas, com um número correto de algarismos significativos (v = 20 cm s-1) …….. 5 pontos
Nota ‒ A omissão da ordenada na origem não implica qualquer desvalorização
GRUPO II
1. Num ensaio laboratorial, adicionou-se uma amostra de água, a uma temperatura T, a uma outra amostra de água, de massa 350,0 g e inicialmente a 5,2 ºC.
Verificou-se que, após um determinado intervalo de tempo, o sistema resultante daquela adição ficou à temperatura de 27,9 ºC.
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
1.1. Calculou-se a energia total cedida pela amostra de água inicialmente à temperatura T, tendo-se obtido 3,85 x 104 J.
Conclua em que sentido terá ocorrido a transferência de energia entre o sistema resultante daquela adição e o exterior, até ser atingida a temperatura de 27,9 ºC.
Mostre como chegou à conclusão solicitada.
⇒ Neste ensaio laboratorial verifica-se que uma dada amostra de água a uma temperatura inicial de 5,2 ºC vai aumentar a sua temperatura até 27,9 ºC, ou seja, vai receber energia na forma de calor.
⇒ É possível conhecer a energia recebida através da expressão: Erecebida = mcΔT, em que m é a massa da amostra de água, c a sua capacidade térmica mássica e ΔT a elevação da temperatura.
- Erecebida = 0,3500 x 4,18 x 103 x (27,9 – 5,2) = 3,32 x 104 J
⇒ Como a energia cedida pela amostra de água à temperatura T (3,85 x 104 J) foi superior à recebida, pode-se concluir que o sistema transfere energia para o exterior.
ou
⇒ Admitindo que o sistema está isolado, a energia cedida pela amostra inicialmente à temperatura T, Ecedida = 3,85 x 104 J, é igual à energia recebida pela segunda amostra, inicialmente à temperatura de 5,2 ºC.
⇒ Nesta situação a temperatura final de equilíbrio do sistema, Tf, será dada por:
- 3,85 x 104 = 0,3500 x 4,18 x 103 x (Tf – 5,2)
⇒ Obtém-se Tf = 31,5 ºC, que é superior ao valor real de 27,9 ºC, o que significa que houve transferência de energia para o exterior.
- A resposta deve incluir os seguintes passos:
A) Cálculo da energia recebida pela amostra de água inicialmente a 5,2 ºC (E = 3,32 x 104 J).
B) Comparação da energia cedida pela amostra de água inicialmente à temperatura T com a energia recebida pela amostra de água inicialmente a 5,2 ºC (a energia cedida é superior à energia recebida).
C) Conclusão (terá ocorrido transferência de energia do sistema para o exterior).
ou
A) Cálculo da temperatura a que ficaria o sistema resultante se fosse isolado (t = 31,5 ºC).
B) Comparação da temperatura do sistema com a temperatura prevista se o sistema fosse isolado (a temperatura do sistema é inferior à temperatura prevista).
C) Conclusão (terá ocorrido transferência de energia do sistema para o exterior).
- 10ºano – Física – subdomínio 2 (Energia e fenómenos elétricos)
- 10ºano – Física – A.l. – 3.1 – Variação e potência elétrica de um painel fotovoltaico
1.2. As temperaturas foram medidas com um termómetro digital, cujo funcionamento se baseia na variação da resistência elétrica de um fio condutor (constituinte do termómetro) com a temperatura.
Para que o termómetro funcione adequadamente, a variação da potência dissipada por efeito Joule, no fio, deve ser desprezável.
Considere que a resistência elétrica do fio aumenta 3,85 Ω por cada 10 ºC de aumento de temperatura e que, na experiência realizada, o fio foi percorrido por uma corrente constante de 9,0 x 10-4 A.
Verifique que, entre 5,2 ºC e 27,9 ºC, o aumento da potência dissipada naquele fio foi inferior a 10-5 W, sendo, por isso, desprezável.
Apresente todas as etapas de resolução, explicitando todos os cálculos efetuados.
⇒ Como existiu uma variação de temperatura de 22,7 ºC, pode-se considerar que a resistência elétrica aumentou de forma proporcional à variação de temperatura:
⇒ A potência dissipada pode ser calculada pela Lei de Joule, Pdiss = R I2, o que significa que uma variação de resistência, ΔR, corresponde a uma variação de potência dissipada,
ΔPdiss = ΔR I2 , ou seja, ΔPdiss = 8,74 x (9,0 x 10−4)2 W = 7,1 x 10-6 W
- Como o valor calculado é inferior a 10-5 W, pode ser considerado desprezável.
- Etapas de resolução:
⇒ Cálculo do aumento da resistência do fio (ΔR = 8,74 Ω) …….. 5 pontos
⇒ Cálculo do aumento da potência dissipada no fio (ΔP = 7,1 x 106 W ) …….. 4 pontos
⇒ Comparação do aumento da potência dissipada no fio com 10-5 W (ΔP < 10-5 W) …….. 1 pontos
2. Para determinar experimentalmente a variação de entalpia (mássica) de fusão do gelo, adicionou-se gelo fundente a água previamente aquecida.
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
- 10ºano – Física – A.l. – 3.2 – Capacidade térmica mássica
2.1. Para minimizar o erro nesta determinação, o gelo adicionado deve estar dividido em
(A) pequenos fragmentos e vir diretamente do congelador.
(B) pequenos fragmentos e ter sido colocado previamente em água a 0 ºC.
(C) grandes fragmentos e vir diretamente do congelador.
(D) grandes fragmentos e ter sido colocado previamente em água a 0 ºC.
- Opção (B)
⇒ O gelo que vem diretamente do congelador está a uma temperatura inferior a 0 ºC.
⇒ Para determinar a entalpia de fusão são necessários pedaços de gelo à temperatura de fusão de 0 ºC, o que se consegue colocando-o previamente em água a essa temperatura.
⇒ Os pedaços devem ser pequenos para evitar uma diferença de temperatura entre a superfície e o interior do gelo.
- Opção (B) ……………. 7 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
2.2. Na experiência realizada, mediu-se a massa do gelo fundente, a massa e a temperatura inicial da água, e a temperatura à qual o sistema resultante daquela adição atingiu o equilíbrio térmico.
O que é necessário ainda conhecer para calcular a variação de entalpia (mássica) de fusão do gelo, considerando que o sistema é isolado?
(A) Apenas a capacidade térmica mássica da água líquida.
(B) A capacidade térmica mássica da água líquida e a capacidade térmica mássica do gelo.
(C) A energia necessária à fusão de 1 kg de gelo e a capacidade térmica mássica da água líquida.
(D) Apenas a energia necessária à fusão de 1 kg de gelo.
- Opção (A)
⇒ A energia cedida pela amostra de água de massa mágua, à temperatura inicial Ti, será usada para a fusão do gelo de massa mgelo e para o aquecimento da água líquida resultante.
Como o sistema é isolado, a variação da energia interna do sistema será nula:
- Ecedida + Efusão + Eaquecimento = 0
ou seja, 𝑚água × 𝑐 ×(𝑇f−𝑇i)+ 𝑚gelo × Δℎfusão+ 𝑚gelo × 𝑐 ×(𝑇f − 0) = 0
- onde Tf é a temperatura de equilíbrio final.
⇒ Uma vez que se mediu mágua, mgelo, Tf e Ti apenas é necessário conhecer a capacidade térmica mássica da água líquida para obter Δhfusão.
- Opção (A) ……………. 7 pontos
GRUPO III
- 11º – Química – Domínio II
Considere a reação traduzida por
2 H2O (l) ⇋ H3O+ (aq ) + OH– (aq )
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
1. Na reação anterior, moléculas de água cedem
(A) protões a iões OH– (aq).
(B) protões a moléculas de água.
(C) eletrões a iões OH– (aq).
(D) eletrões a moléculas de água.
- Opção (B)
⇒ A reação apresentada designa-se por autoionização da água.
⇒ É uma reação entre moléculas de água, em que moléculas de água cedem iões H+ (protões) a outras moléculas de água (reação de transferência de protões).
⇒ É originado um ião H3O+ (aq) (ião hidrónio), quando uma molécula de água recebe um protão, e, ao mesmo tempo, um ião OH− (aq) (ião hidróxido) quando uma molécula de água cede um protão.
- Opção (B) ……………. 7 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
2. O produto iónico da água é 3,80 x 10-14 , a uma temperatura T.
Se, à temperatura T, o pH de uma água engarrafada for 6,90, essa água
(A) será neutra, uma vez que as concentrações de H3O+ (aq ) e de OH– (aq) serão iguais.
(B) não será neutra, uma vez que o seu pH será diferente de 7.
(C) não será neutra, uma vez que a concentração de H3O+ (aq ) será inferior à de OH– (aq ).
(D) será neutra, uma vez que o seu pH será próximo de 7.
- Opção (C)
⇒ O produto iónico da água é dado por 𝐾w = |H3O+|e |OH−|e.
⇒ Como a água quimicamente pura é neutra e como os iões H3O+ (aq) e OH− (aq) resultam da autoionização da água, em igual proporção estequiométrica, numa solução aquosa neutra verificam-se sempre as igualdades
- |H3O+| = |OH−| e [H3O+] = √𝐾w , qualquer que seja a temperatura.
⇒ À temperatura 𝑇, a solução será neutra quando [H3O+] = √3,80 x 10−14 mol dm−3 = 1,95 x 10−7 mol dm−3, o que se traduz num pH = −log (1,95 x 10−7) = 6,71.
⇒ À temperatura 𝑇, o pH da água engarrafada é 6,90, ou seja, superior ao pH de uma solução neutra sendo por isso uma solução alcalina.
⇒ Como quando o pH aumenta a concentração de H3O+ (aq) diminui, implicando uma concentração de H3O+ (aq) na solução inferior à concentração de OH− (aq) e, consequentemente, essa água não será neutra.
- Opção (C) ……………. 7 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
3. Dissolvendo em água, a temperatura constante, uma certa quantidade de uma base, a concentração de OH- (aq)
(A) diminui, e o produto iónico da água mantém-se constante.
(B) aumenta, e o produto iónico da água não se mantém constante.
(C) diminui, e o produto iónico da água não se mantém constante.
(D) aumenta, e o produto iónico da água mantém-se constante.
- Opção (D)
⇒ Quando se dissolve uma base em água, algumas moléculas de água cedem iões H+ à base transformando-se em iões OH− (aq), pelo que a concentração de OH− (aq) aumenta.
⇒ Em qualquer solução aquosa verifica-se sempre que |H3O+|e |OH−|e = 𝐾w, logo, se a temperatura for mantida constante, o produto iónico da água mantém-se constante.
- Opção (D) ……………. 7 pontos
GRUPO IV
A reação de síntese do amoníaco pode ser traduzida por
N2 (g) + 3 H2 (g) ⇋ 2 NH3 (g) ΔH < 0
- 11ºano – Química – Domínio 2 – subdomínio 2 (Reações de oxidação redução)
1. Nesta reação, a variação do número de oxidação do elemento que se reduz é
(A) +3
(B) +1
(C) -3
(D) -1
- Opção (C)
⇒ Para o nitrogénio no estado livre, N2, o número de oxidação do nitrogénio é zero, e na molécula de amoníaco, NH3, o número de oxidação do nitrogénio é −3.
⇒ Na reação considerada, o número de oxidação do nitrogénio diminui, logo, o nitrogénio é o elemento que se reduz, sendo a variação do seu número de oxidação
- Δn. o. (N) = −3 − 0 = −3
- Opção (C) ……………. 7 pontos
- 11ºano – Química – Domínio 1 – subdomínio 1 (Aspetos quantitativos das reações químicas)
2. Que volume de H2 (g) terá de reagir, no mínimo, para se obter 35,0 dm3 de NH3 (g), em condições de pressão e de temperatura constantes?
(A) 52,5 dm3
(B) 35,0 dm3
(C) 23,3 dm3
(D) 105 dm3
- Opção (A)
⇒ Nas mesmas condições de pressão e temperatura, o volume ocupado por um gás é diretamente proporcional à quantidade desse gás.
Assim, a quantidade de NH3 (g) correspondente a 35,0 dm3 é dada por
⇒ De acordo com a estequiometria da reação, 3 mol de H2 (g) é estequiometricamente equivalente a 2 mol de NH3 (g), por isso, nas mesmas condições de pressão e temperatura, para produzir 35,0 dm3/𝑉m de NH3 (g) reagiram
- de H2 (g), cujo volume é:
- Opção (A) ……………. 7 pontos
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
3. Considere um sistema fechado onde se encontram, em equilíbrio, as espécies envolvidas na reação considerada.
Na Figura 2, apresentam-se os esboços dos gráficos da quantidade de equilíbrio, n, de uma daquelas espécies, em função da pressão, P, para duas temperaturas, TA e TB.
Conclua qual das temperaturas, TA ou TB, é menor, começando por verificar se a espécie a que o gráfico se refere é um reagente ou um produto da reação.
Apresente, num texto estruturado e com linguagem científica adequada, a fundamentação da conclusão solicitada.
⇒ Na reação considerada, o aumento de pressão, por diminuição de volume do sistema em equilíbrio, desloca o equilíbrio no sentido em que a quantidade total das substâncias no estado gasoso seja menor.
- Como por 1 mol de N2 e 3 mol de H2 (4 mol no total) que reagem são produzidos 2 mol de NH3, o aumento de pressão favorece a reação direta.
⇒ Para as temperaturas 𝑇A e 𝑇B a quantidade de equilíbrio da espécie a que se refere o gráfico diminui à medida que a pressão aumenta, assim, conclui-se que o gráfico se refere a um reagente.
⇒ A variação de entalpia da reação, Δ𝐻, é negativa, deduz-se que a reação direta é exotérmica a qual se torna mais extensa com a diminuição de temperatura.
⇒ Dado que à mesma pressão a quantidade de equilíbrio do reagente a que o gráfico se refere é menor à temperatura 𝑇A do que à temperatura 𝑇B, conclui-se que a temperatura 𝑇A é menor do que a temperatura 𝑇B.
- A resposta deve apresentar os seguintes elementos:
A) Na reação considerada, o aumento da pressão favorece a reação direta. Como a quantidade de equilíbrio da espécie a que o gráfico se refere diminui à medida que a pressão aumenta, conclui-se que o gráfico se refere a um reagente.
B) A reação direta é exotérmica, sendo favorecida por uma diminuição de temperatura. Como, para cada pressão, a quantidade de equilíbrio do reagente a que o gráfico se refere é menor à temperatura TA do que à temperatura TB , conclui-se que a temperatura TA é menor do que a temperatura TB.
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
4. Num reator com a capacidade de 0,50 L, foram introduzidas 6,00 mol de NH3 (g). Quando o sistema químico atingiu o estado de equilíbrio, à temperatura T, verificou-se que existia no reator 86,6% da quantidade inicial daquele gás.
Calcule a constante de equilíbrio, Kc , da reação de decomposição do amoníaco, à temperatura T.
Apresente todas as etapas de resolução, explicitando todos os cálculos efetuados.
- A quantidade de equilíbrio de NH3 é:
A quantidade de NH3 que reagiu é: n(NH3)reagiu = (6,00 − 5,196) mol = 0,804 mol.
⇒ De acordo com a estequiometria da reação, por reação de 2 mol de NH3 formam-se 1 mol de N2 e 3 mol de H2.
Como reagiram 0,804 mol de NH3, formaram-se
- 0,804/2 mol = 0,402 mol de N2
- 3 x 0,804/2 = 1,206 mol de H2.
Assim, as concentrações de equilíbrio de NH3, N2 e H2 são:
⇒ A constante de equilíbrio, 𝐾c, da reação de decomposição do amoníaco,
2 NH3 (g) ⇌ N2 (g) + 3 H2 (g)
à temperatura 𝑇, é
- Etapas de resolução:
⇒ Cálculo da quantidade de equilíbrio de N2 (g) (nN2 = 0,4020 mol) …….. 3 pontos
⇒ Cálculo da quantidade de equilíbrio de H2 (g) (nH2 = 1,206 mol) …….. 3 pontos
⇒ Cálculo das concentrações de equilíbrio de N2 (g), H2 (g) e NH3 (g) ([N2] = 0,804 mol dm-3 ; [H2] = 2,41 mol dm-3 ; [NH3] = 10,4 mol dm-3 ; ) …….. 2 pontos
⇒ Cálculo da constante de equilíbrio da reação de decomposição do amoníaco, à temperatura T (Kc = 0,10) …….. 2 pontos
GRUPO V
A Figura 3 representa, à escala, um diagrama de níveis de energia do átomo de hidrogénio, no qual são apresentados apenas os três primeiros níveis de energia.
1. A energia do nível n = 4 é -1,36 x 10-19 J.
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
1.1. A que distância do nível n = 3 deveria estar o nível n = 4 no diagrama representado na figura?
Mostre como chegou ao valor solicitado.
⇒ A distância medida entre dois níveis de energia representados na figura é diretamente proporcional ao módulo da diferença de energia entre esses mesmos níveis.
⇒ À distância 3,20 cm, medida entre o nível 𝑛 = 2 e o nível 𝑛 = 1, corresponde uma diferença de energia de
- (−5,45 x 10−19 − (−2,18 x 10−18)) J = 1,64 x 10−18 J.
⇒ A diferença de energia entre o nível 𝑛 = 4 e o nível 𝑛 = 3 é
- (−1,36 x 10−19 − (−2,42 x 10−19)) J = 1,06 x 10−19 J.
⇒ A distância 𝑑 a que o nível 𝑛 = 4 deverá estar do nível 𝑛 = 3 pode calcular-se com base na seguinte proporção:
- A resposta deve incluir os seguintes passos:
A) Determinação da escala utilizada no diagrama
- (-2,42 x 10-19 + 5,45 x 10-19) J : 0,60 cm
ou
- (-5,45 x 10-19 + 2,18 x 10-18) J : 3,20 cm
ou
- (-2,42 x 10-19 + 2,18 x 10-18) J : 3,80 cm
B) Cálculo da distância a que o nível n = 4 deveria estar do nível n = 3 (0,21 cm).
* Devem ser aceites distâncias que apresentem desvios, em módulo, não superiores a 0,05 cm em relação às distâncias indicadas.
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
1.2. As riscas do espectro de emissão do átomo de hidrogénio, na região do visível, são originadas por transições eletrónicas para o nível n = 2.
Conclua se, no espectro de emissão do átomo de hidrogénio, na região do visível, poderá existir uma risca a 3,45 x 10-19 J.
Mostre como chegou à conclusão solicitada.
⇒ O aparecimento de uma risca no espectro de emissão do átomo de hidrogénio é consequência de uma transição eletrónica, que segundo o modelo de Bohr, só ocorrerá por emissão de uma quantidade bem definida de energia, igual ao módulo da diferença entre as energias dos níveis entre os quais ocorre a transição.
⇒ A energia do fotão emitido pelo eletrão do átomo de hidrogénio ao transitar do nível 𝑛 = 3 para 𝑛 = 2 é:
- 𝐸fotão = |Δ𝐸eletrão| = |−5,45 x 10−19 J − (−2,42 x 10−19) J| = 3,03 x 10−19 J.
⇒ A energia do fotão emitido pelo eletrão do átomo de hidrogénio ao transitar diretamente do nível 𝑛 = 4 para o nível 𝑛 = 2 é:
- 𝐸fotão = |Δ𝐸eletrão| = |−5,45 x 10−19 J − (−1,36 x 10−19) J| = 4,09 x 10−19 J.
⇒ 3,45 x 10−19 J é um valor de energia que está compreendido entre os valores correspondentes às transições eletrónicas de 𝑛 = 3 ⟶ 𝑛 = 2 e 𝑛 = 4 ⟶ 𝑛 = 2, assim, conclui-se que não poderá existir uma risca a 3, 45 x 10−19 J.
- A resposta deve incluir os seguintes passos:
A) Cálculo das energias a que se situam as duas primeiras riscas do espectro de emissão do átomo de hidrogénio na região do visível (E = 3,03 x 10-19 J e E = 4,09 x 10-19 J ).
B) Comparação de 3,45 x 10-19 J com os valores de energia calculados (3,45 x 10-19 J situa-se entre 3,03 x 10-19 J e 4,09 x 10-19 J).
C) Conclusão (não poderá existir uma risca a 3,45 x 10-19 J).
ou
A) Cálculo da energia de um nível hipotético em que o eletrão se encontraria inicialmente se ocorresse uma transição eletrónica que desse origem a uma risca a 3,45 x 10-19 J (-2,00 x 10-19 J).
B) Comparação da energia do nível hipotético com as energias dos níveis n = 3 e n = 4 (-2,00 x 10-19 J situa-se entre as energias dos níveis n = 3 e n = 4).
C) Conclusão (não poderá existir uma risca a 3,45 x 10-19 J).
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
2. Qual é a energia mínima necessária para ionizar o átomo de hidrogénio no primeiro estado excitado?
⇒ A energia mínima necessária para ionizar o átomo de hidrogénio no primeiro estado excitado (no nível de energia 𝑛 = 2) é a energia mínima que é necessário fornecer para lhe remover o eletrão, ou seja, a energia da transição do átomo de hidrogénio entre os níveis 𝑛 = 2 e 𝑛 = ∞.
- Δ𝐸 = 𝐸𝑛=∞ − 𝐸𝑛=2 = 0 − (− 5,45 x 10−19) J = 5,45 x 10−19 J.
- 5,45 x 10-19 J ……………. 7 pontos
GRUPO VI
A 14 de outubro de 2012, Felix Baumgartner (FB), um paraquedista austríaco, subiu num balão de hélio até à estratosfera. A partir desse balão, FB realizou um salto até à superfície da Terra.
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
1. Um balão, cheio com 0,750 mol de hélio (He), tem um volume de 70,0 dm3, a uma determinada altitude.
A essa altitude recolheu-se uma amostra de 1,0 dm3 de ar, medido em condições de pressão e de temperatura idênticas às existentes no interior do balão.
A percentagem em volume de nitrogénio, N2, na amostra de ar recolhida é 78%.
Determine a massa de nitrogénio nessa amostra de ar.
Apresente todas as etapas de resolução, explicitando todos os cálculos efetuados.
- O volume de N2 existente na amostra de ar recolhido é
⇒ Nas mesmas condições de pressão e de temperatura, o volume ocupado por um gás é diretamente proporcional à quantidade desse gás, e a constante de proporcionalidade, o volume por unidade de quantidade de matéria, designa-se volume molar, 𝑉m.
⇒ Aplicando esta proporcionalidade à amostra de nitrogénio, a quantidade existente em 0,780 dm3 é
- massa de N2 existente na amostra é:
𝑚N2 = 8,36 x 10−3 mol x 28,02 g mol−1 = 0,23 g .
- Etapas de resolução:
⇒ Cálculo do volume de N2 na amostra de ar (VN2 = 0,780 dm3) …….. 2 pontos
⇒ Cálculo do volume ocupado por 1 mol de gás nas condições de pressão e de temperatura consideradas (V = 93,3 dm3 ) …….. 4 pontos
⇒ Cálculo da massa de nitrogénio na amostra de ar (mN2 = 0,23 g) …….. 4 pontos
ou
⇒ Cálculo da quantidade de gás existente na amostra de ar nas condições de pressão e de temperatura consideradas (n = 1,07 x 10-2 mol)
ou
Cálculo da quantidade de N2 existente em 100 dm3 de ar (mN2 = 8,35 x 10-1 mol) …….. 4 pontos
⇒ Cálculo da quantidade de N2 existente na amostra de ar (nN2 = 8,35 x 10-3 mol ) …….. 2 pontos
⇒ Cálculo da massa de nitrogénio na amostra de ar (mN2 = 0,23 g) …….. 4 pontos
2. Na estratosfera existe uma camada de ozono, O3 (g), que absorve parte da radiação ultravioleta proveniente do Sol.
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
2.1. Qual é a quantidade de ozono existente numa amostra de ar, de massa 5 × 102 g , numa zona da estratosfera na qual o ar contém 10 ppm (em massa) de ozono?
(A) 1 x 10-5 mol
(B) 1 x 10-4 mol
(C) 5 x 10-3 mol
(D) 5 x 10-4 mol
- Opção (B) ……………. 7 pontos
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
2.2. A molécula de ozono, O3, é menos estável do que a molécula de oxigénio, O2.
Na Figura 4, está representado um modelo tridimensional da molécula de ozono.
Na molécula de ozono, o átomo central eletrões de valência não ligantes, e o comprimento da ligação oxigénio-oxigénio é do que na molécula de oxigénio.
(A) apresenta … menor
(B) apresenta … maior
(C) não apresenta … maior
(D) não apresenta … menor
- Opção (B)
⇒ Do modelo tridimensional apresentado constata-se que os três átomos de oxigénio da molécula de ozono não se encontram alinhados, assim o átomo central contém eletrões não ligantes, pois se não existissem os três átomos estariam alinhados (geometria linear).
⇒ Sendo a molécula de ozono menos estável que a molécula de oxigénio, significa que a ligação oxigénio- oxigénio na molécula de ozono é mais fraca, logo tem menor energia de ligação e consequentemente maior comprimento de ligação.
- Opção (B) ……………. 7 pontos
3. No salto que realizou desde a estratosfera até à Terra, Felix Baumgartner (FB) foi o primeiro homem a quebrar a barreira do som sem qualquer veículo propulsor.
Considere que a queda de FB em direção à Terra foi aproximadamente vertical.
Na Figura 5, apresentam-se, para os primeiros 100 s de queda, os gráficos do módulo da velocidade, vFB , e da altitude, h , de FB, em função do tempo, t. Na figura, está também representada uma linha a tracejado, que traduz o modo como variou o módulo da velocidade do som, vsom , ao longo da trajetória percorrida, durante aquele intervalo de tempo.
Considere que o conjunto FB + equipamento pode ser representado pelo seu centro de massa (modelo da partícula material) e que a variação da aceleração gravítica com a altitude é desprezável.
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
3.1. Qual foi o sentido da resultante das forças que atuaram sobre o conjunto FB + equipamento, nos primeiros 40 s de queda?
⇒ O sentido da resultante das forças que atuaram sobre o conjunto FB + equipamento é o sentido de cima para baixo.
⇒ O sentido da resultante das forças é o sentido da aceleração do conjunto FB + equipamento.
⇒ Uma vez que nos primeiros 40 s de queda o módulo da velocidade aumenta, a aceleração terá de ter o mesmo sentido da velocidade.
⇒ Estando a altura a diminuir no intervalo de tempo considerado, a velocidade terá o sentido de cima para baixo. Assim, tanto a aceleração como a força resultante terão o sentido do movimento, ou seja, de cima para baixo.
- Sentido de cima para baixo ou sentido do movimento ……………. 7 pontos
- 11ºano – Física – Domínio 1 – subdomínio 1 (Tempo, posição e velocidade)
3.2. Qual foi, aproximadamente, a distância percorrida pelo conjunto FB + equipamento, no intervalo de tempo em que o módulo da sua velocidade aumentou?
(A) 19 km
(B) 11 km
(C) 23 km
(D) 28 km
- Opção (B)
⇒ De acordo com os gráficos da Figura 5, o módulo da velocidade aumenta no intervalo de tempo [0, 50] s, o que corresponde a uma variação de altura de (39,0 – 28,0) km = 11,0 km.
- Opção (B) ……………. 7 pontos
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
3.3. No intervalo de tempo [50, 60] s, o módulo da aceleração do conjunto FB + equipamento, e a intensidade da resultante das forças que nele atuaram.
(A) aumentou … aumentou
(B) aumentou … diminuiu
(C) diminuiu … diminuiu
(D) diminuiu … aumentou
- Opção (A)
⇒ No movimento retilíneo, o módulo da aceleração é dado pelo módulo do declive da reta tangente à curva no gráfico v =f(t).
⇒ A t = 50 s a velocidade atinge o máximo e depois, entre t = 50 s e t = 60 s, o seu módulo diminui. O conjunto FB + equipamento trava neste intervalo de tempo.
⇒ Verifica-se, assim, que entre t = 50 s e t = 60 s, o módulo do declive do gráfico v = f(t) está a aumentar, logo o módulo da aceleração aumenta.
⇒ Assim, tanto o módulo da aceleração do conjunto FB + equipamento como a intensidade da resultante das forças aumentam no intervalo de tempo considerado, uma vez que são grandezas diretamente proporcionais, de acordo com a segunda lei de Newton.
- Opção (A) ……………. 7 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
3.4. No intervalo de tempo [50, 100] s, a energia potencial gravítica do sistema FB + equipamento + Terra, e a energia mecânica do sistema
(A) aumentou … diminuiu
(B) aumentou … permaneceu constante
(C) diminuiu … diminuiu
(D) diminuiu … permaneceu constante
- Opção (C)
⇒ A energia potencial gravítica do sistema FB + equipamento + Terra, de massa m, situado à altitude h, é dada por Ep = m g h. Uma vez que de acordo com o gráfico da Figura 5, h = f(t), a altitude diminui no intervalo de tempo [50, 60] s, a energia potencial do sistema também diminui neste intervalo.
⇒ Do mesmo modo, de acordo com o gráfico v = f(t), o módulo da velocidade diminui no intervalo de tempo [50, 60] s, pelo que a energia cinética, Ec = ½ m v2 , também diminui.
⇒ Assim, tanto a energia potencial gravítica, Ep , como a energia mecânica, Em = Ep + Ec , diminuem no mesmo intervalo de tempo.
- Opção (C) ……………. 7 pontos
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
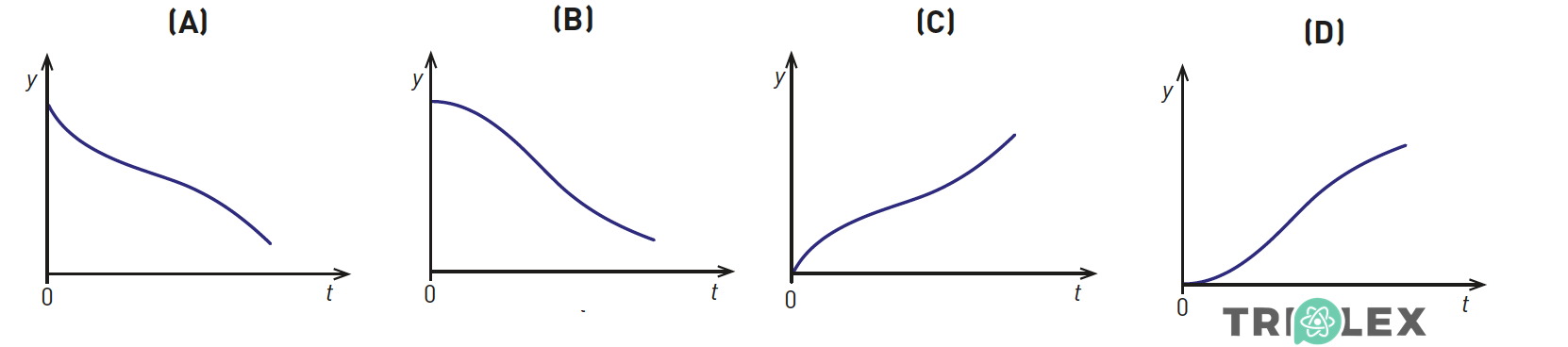
3.5. Considere um referencial unidimensional Oy vertical, com sentido de cima para baixo.
Qual dos esboços de gráfico seguintes poderá representar a componente escalar da posição, y , do conjunto FB + equipamento, em relação ao referencial Oy, em função do tempo, t , nos primeiros 100 s de queda?
- Opção (D)
⇒ O referencial Oy vertical é definido com sentido de cima para baixo. Assim enquanto FB cai y aumenta.
⇒ A curva y = f(t) deve ser a imagem no espelho da curva h = f(t).
- Opção (D) ……………. 7 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
3.6. Considere que a massa do conjunto FB + equipamento era 118 kg.
Determine o trabalho realizado pela força de resistência do ar que atuou sobre o conjunto, no intervalo de tempo em que este se moveu com velocidade superior à velocidade do som.
Apresente todas as etapas de resolução, explicitando todos os cálculos efetuados.
⇒ De acordo com os gráficos da Figura 5, o intervalo de tempo em que o conjunto FB + equipamento se move com velocidade superior à do som é [34, 64] s.
- No instante t = 34 s, a altitude é h = 33,5 km e o módulo da velocidade é v =310 m s-1.
- No instante t = 64 s, a altitude é h = 23,0 km e o módulo da velocidade é v =290 m s-1.
⇒ O trabalho realizado pela força da resistência do ar, Wresist, é igual à variação de energia mecânica, Wresist = ΔEm.
⇒ Tem-se ΔEm = ΔEp + ΔEc , onde ΔEp e ΔEc são, respetivamente, as variações da energia potencial gravítica e da energia cinética.
Assim:
- ΔEp = m g (hf – hi) = 118 x 10 x (23,0 x 103 – 33,5 x 103) J = -1,24 x 107 J e
- ΔEc = ½ m (vf2– vi2) = ½ x 118 x (2902 -3102) J = -7,08 x 105 J .
Finalmente, Wresist = ΔEm. = (-1,24 x 107 – 7,08 x 105 ) J = -1,3 x 107 J.
- Etapas de resolução:
⇒ Cálculo da variação de energia potencial gravítica do sistema FB + equipamento + Terra, no deslocamento considerado
- (ΔEpg = 118 x 10 x (23,0 x 103 – 33,5 x 103) J = -1,24 x 107 J) (ver nota) …….. 4 pontos
⇒ Cálculo da variação de energia cinética do conjunto FB + equipamento, no deslocamento considerado ( ΔEc = ½ x 118 x (2902 – 3102) = -7,08 x 105 J) …….. 3 pontos
⇒ Cálculo do trabalho realizado pela força de resistência do ar que atuou sobre o conjunto FB + equipamento, no deslocamento considerado (W = -1,3 x 107 J) …….. 3 pontos
Nota ‒ Devem ser aceites valores no intervalo [33,0; 34,0] km para a altitude de FB no instante t = 34 s e valores no intervalo [22,5; 23,5] km para a altitude de FB no instante t = 64 s.
FIM