2020 – 2ªFase – Prova Escrita de FQ A
Voltar a: Física e Química
Prova Escrita de Física e Química A – versão 1
Prova 715: 2.ª Fase – 2020
Nota: A prova inclui 8 itens, devidamente identificados no enunciado, cujas respostas contribuem obrigatoriamente para a classificação final (itens I ‒ 2., I ‒ 4., I ‒ 5.1., I ‒ 5.2., I ‒ 6.3., II ‒ 2., II ‒ 4.2. e III ‒ 2.).
Dos restantes 18 itens da prova, apenas contribuem para a classificação final os 12 itens cujas respostas obtenham melhor pontuação.
GRUPO I
A atmosfera terrestre, constituída maioritariamente por nitrogénio, N2 , e oxigénio, O2 , contém também outros gases, como o árgon, Ar, o dióxido de carbono, CO2 , e a água, H2O.
- 10ºano – Química – Domínio 1 – subdomínio 1 (Massa e tamanho dos átomos)
1. Na Terra, praticamente todos os átomos de nitrogénio têm número de massa 14 ou 15.
A massa de um átomo de nitrogénio será, em média, _____ vezes maior do que a massa de um átomo de carbono-12, sendo o isótopo mais abundante do nitrogénio o ______.
(A) 14,01 … 14N
(B) 1,17 … 15N
(C) 1,17 … 14N
(D) 14,01 … 15N
- Opção (C)
⇒ A massa atómica relativa média do nitrogénio é 14,01, o que significa que a massa de um átomo de nitrogénio será, em média, 14,01 vezes maior do que 1/12 da massa de um átomo de carbono-12, ou seja, 14,01/12 =1,17 vezes maior do que a massa de um átomo de carbono-12.
⇒ A massa atómica relativa média de um elemento resulta da média ponderada das massas isotópicas (ponderada com as abundâncias dos isótopos), ficando, assim, mais próxima da do isótopo mais abundante, o nitrogénio-14, uma vez que o este contribui mais para a média.
- Opção (C) ……………. 10 pontos
- 10ºano – Química – Domínio 1 – subdomínio 3 (Tabela periódica)
2. O raio atómico do oxigénio é menor do que o raio atómico do nitrogénio, uma vez que, comparando estes dois átomos, o de oxigénio tem _____ carga nuclear, distribuindo-se os seus eletrões, no estado fundamental, _____ número de níveis de energia.
(A) maior … por um menor
(B) maior … pelo mesmo
(C) menor … por um menor
(D) menor … pelo mesmo
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (B)
⇒ O átomo de nitrogénio possui 7 protões no núcleo e o de oxigénio 8, por isso o oxigénio tem maior carga nuclear.
⇒ As configurações eletrónicas do nitrogénio, 7N – 1s2 2s2 2p3, e do oxigénio, 8O – 1s2 2s2 2p4, no estado fundamental, têm os eletrões distribuídos pelo mesmo número de níveis de energia, 2.
⇒ Comparando o oxigénio com o nitrogénio, o raio atómico do oxigénio é menor, uma vez que a força atrativa exercida pelo núcleo sobre os eletrões é, em média, maior, no átomo de oxigénio, dado que apresenta maior carga nuclear.
- Opção (B) ……………. 10 pontos
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
- Geometria linear

⇒ A geometria de uma molécula é aquela que conduz à máxima estabilidade do sistema molecular.
⇒ Segundo o método da repulsão dos pares eletrónicos de valência, estes dispõem-se no espaço o mais afastados possível, de modo a conduzir às menores repulsões eletrónicas.
⇒ No caso da molécula de CO2, os pares eletrónicos de valência que rodeiam o átomo central e que constituem as duas ligações duplas afastam-se o mais possível; por isso, a molécula CO2 é linear.
- Indica a geometria da molécula (geometria linear) ……………. 10 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
4. Considere uma amostra de ar que contém, no total, 3,0 mol de moléculas.
A fração molar de CO2 nessa amostra é 4,2 x 10-4 .
Quantas moléculas de CO2 existem nessa amostra?
(A) 8,4 x 1019
(B) 7,6 x 1020
(C) 4,8 x 1026
(D) 4,3 x 1027
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (B) ……………. 10 pontos
5. Considere várias amostras retiradas de uma mesma mistura gasosa constituída apenas por N2 (g) e por O2 (g).
As amostras têm massas diferentes, apresentando todas um teor de 21,2%, em volume, de O2 (g).
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
5.1. Admita que as amostras estão nas mesmas condições de pressão e de temperatura.
Qual dos esboços de gráfico pode representar a massa volúmica, ρ, das amostras em função da quantidade de matéria, n, existente nessas amostras?

A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (D)

⇒ Nas mesmas condições de pressão e temperatura, o mesmo volume de qualquer gás (ideal) contém o mesmo número de moléculas.
⇒ Sendo o número de moléculas diretamente proporcional ao volume, então, para uma dada composição, a massa, m, da amostra também será diretamente proporcional ao seu volume
- Opção (D) ……………. 10 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
5.2. Uma das amostras tem massa 4,0 g.
Determine a massa de N2 nessa amostra.
Explicite o seu raciocínio, indicando todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Relaciona a percentagem em volume com a percentagem em quantidade de um dos componentes da amostra (ou equivalente) …….. 3 pontos
⇒ Determina a quantidade total de moléculas na amostra a partir de uma relação equivalente a :
- 0,212 x ntotal x 32,00 + 0,788 x ntotal x 28,02 = 4,0 ⇔ ntotal = 0,139 mol
ou
⇒ Determina a quantidade de um dos componentes da amostra a partir de uma relação equivalente a:
- nO2 x 3,717 x 28,02 + nO2 x 32,00 = 4,0 ⇔ nO2 = 2,92 x 10-2 mol
ou
⇒ Relaciona a massa de N2 com a massa de O2
- m(N2) = 3,255 m(O2) ou m(O2) = 0,3072 m(N2) …….. 5 pontos
⇒ Calcula a massa de nitrogénio na amostra (m(N2) = 3,1 g ) …….. 2 pontos
6. A água, presente nos estados sólido, líquido e gasoso na atmosfera terrestre, é uma substância peculiar, pois as propriedades que a caracterizam, como a variação de entalpia de vaporização e a capacidade térmica mássica, apresentam valores muito diferentes dos que seriam expectáveis.
- 10ºano – Química – Domínio 2 – subdomínio 3 (Transformações químicas)
6.1. A condensação de vapor de água envolve de energia, uma vez que ocorre com de ligações intermoleculares.
(A) libertação … formação
(B) libertação … quebra
(C) absorção … formação
(D) absorção … quebra
- Opção (A)
⇒ Condensação é uma transformação física em que ocorre a passagem do estado físico gasoso para o estado físico líquido.
⇒ Como na passagem de vapor de água ao estado líquido ocorre a formação de ligações intermoleculares, particularmente ligações de hidrogénio, as opções B e D não são corretas.
- A formação de ligações envolve libertação de energia (ΔH < 0).
ou
⇒ A água condensa ao passar do estado gasoso ao estado líquido. Nessa transformação estabelecem-se ligações entre moléculas de água, por isso há libertação de energia.
- Opção (A) ……………. 10 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
6.2. Para vaporizar uma amostra de água que se encontre à temperatura de ebulição, à pressão atmosférica normal, é necessário 7,2 vezes mais energia do que para aquecer essa amostra de 25 ºC até 100 ºC.
A energia envolvida na vaporização de 1,0 g de água que se encontra à temperatura de ebulição será, aproximadamente,
(A) 3,0 x 103 J
(B) 2,3 x 103 J
(C) 3,0 x 106 J
(D) 2,3 x 106 J
- Opção (B)
⇒ A energia, Ea, envolvida na variação de temperatura ΔT de uma amostra de massa, m, é Ea = m c ΔT em que c é a capacidade térmica mássica do material da amostra.
⇒ Para a água, a energia, Evap, envolvida no processo de ebulição de uma dada amostra é 7,2 vezes maior:
- Ee = 7,2 Ea = 7,2 x 1,0 x 10-3 kg x 4,18 x 103 J kg-1 ºC-1 x (100 – 25) ºC = 2,3 x 103 J
- Opção (B) ……………. 10 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
6.3. Uma esfera metálica é aquecida e, a seguir, mergulhada em água fria contida num calorímetro.
Admita que o sistema esfera + água se comporta como um sistema isolado.
Considere que a massa da esfera é igual à massa da água contida no calorímetro e que a capacidade térmica mássica do metal constituinte da esfera é menor do que a capacidade térmica mássica da água.
Num mesmo intervalo de tempo, a energia cedida pela esfera será energia absorvida pela água, sendo a diminuição da temperatura da esfera do que o aumento da temperatura da água.
(A) menor do que a … maior
(B) menor do que a … menor
(C) igual à … maior
(D) igual à … menor
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (C)
⇒ mesfera = mágua = m
- cesfera < cágua
⇒ O sistema é isolado, logo, para o mesmo intervalo de tempo, a energia cedida pela esfera é igual à energia recebida pela água.
- Eesfera + Eágua = 0 ⇔ mcesfera ΔTesfera = – mcágua ΔTágua ⇔ cesfera |ΔTesfera| = cágua |ΔTágua|
⇒ Como cesfera < cágua , então a diminuição de temperatura da esfera é maior do que o aumento da temperatura da água. esfera água.
- Opção (C) ……………. 10 pontos
GRUPO II
Um automóvel encontrava-se estacionado no cimo de uma rampa, como se representa na Figura 1 (que não está à escala), quando, acidentalmente, se destravou. Deslizou ao longo da rampa, com aceleração constante, até colidir com um motociclo que se encontrava parado.
Considere que, no movimento considerado, a resultante das forças dissipativas que atuaram no automóvel não foi desprezável, e considere que o automóvel pode ser representado pelo seu centro de massa (modelo da partícula material).

- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
1. Considere a força F que constitui um par ação-reação com a força normal exercida pela rampa no automóvel.
A força F está aplicada ______, sendo a sua intensidade ______ intensidade da força gravítica que atua no automóvel.
(A) na rampa … menor do que a
(B) na rampa … igual à
(C) no automóvel … menor do que a
(D) no automóvel … igual à
- Opção (A)
⇒ O par da força normal exercida pela rampa no automóvel é a força normal exercida pelo automóvel na rampa, logo F está aplicada na rampa.
⇒ As forças de um par ação-reação têm a mesma intensidade.
⇒ Como o movimento do automóvel é retilíneo, a resultante das forças que nele atuam tem a direção do movimento.
⇒ Assim, as forças perpendiculares à direção do movimento anulam-se, o que implica que a intensidade da força normal que a rampa exerce no automóvel seja igual à intensidade da componente da força gravítica do automóvel na direção perpendicular à rampa.
⇒ A componente de uma força, numa direção diferente da direção dessa força, é menor do que a própria força, logo F é menor do que a força gravítica exercida no automóvel.
ou
⇒ De acordo com a 3.ª Lei de Newton, como a força F é um par ação-reação com a força normal, N, exercida pela rampa no automóvel, então a força F está aplicada na rampa.
⇒ A intensidade de F é igual à intensidade da componente normal da força gravítica (F = Fg cos α), sendo α o ângulo definido pela rampa com a superfície horizontal), logo menor do que a intensidade da força gravítica.
- Opção (A) ……………. 10 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
2. Para uma mesma distância percorrida sobre a rampa, o trabalho realizado pela força gravítica que atua no automóvel
(A) não depende da inclinação da rampa, mas depende da massa do automóvel.
(B) não depende da inclinação da rampa nem da massa do automóvel.
(C) depende da inclinação da rampa e da massa do automóvel.
(D) depende da inclinação da rampa, mas não depende da massa do automóvel.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (C)
⇒ A uma dada distância percorrida, d, pelo automóvel sobre a rampa corresponde uma variação de altura, Δℎ, que varia com a inclinação, θ, da rampa: Δℎ = −d sin θ.
⇒ O trabalho realizado pela força gravítica é simétrico da variação de energia potencial gravítica do sistema automóvel + Terra:
- WFg = -ΔEpg = – mg Δh = mg d sin θ
⇒ Assim, para uma dada distância, o trabalho realizado pela força gravítica depende da massa, m, do automóvel e da inclinação, θ, da rampa.
ou
⇒ O trabalho realizado pela força gravítica, para uma dada distância, d, é igual ao trabalho realizado pela sua componente tangencial, Fgt, cuja intensidade é Fgt = mg sin α.
⇒ Logo, o trabalho realizado pela força gravítica, WFg, que atua sobre o automóvel depende da inclinação da rampa (α) e da massa (m) deste.
- Opção (C) ……………. 10 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
3. Nas opções seguintes, apresenta-se o esboço do gráfico da energia potencial gravítica, Epg , do sistema automóvel + Terra (em relação a um determinado nível de referência) em função da distância, d, percorrida pelo automóvel sobre a rampa.
Em qual das opções está também representado o esboço do gráfico da energia cinética, Ec, do automóvel em função da distância, d, percorrida pelo automóvel sobre a rampa?

- Opção (A)
⇒ Considerando que a resultante das forças dissipativas é constante e com sentido oposto ao do movimento, tem-se que a resultante das forças que atuam sobre o automóvel também é constante e inferior à componente tangencial da força gravítica .
- Fr = mg sin α – Fdissipativas
⇒ Como ΔEc = WFr = Fr d e como o automóvel parte do repouso, tem-se Ec = Fr d (equação de uma reta);
⇒ Devido à ação das forças dissipativas, a energia cinética final é inferior à energia potencial gravítica inicial.
ou
⇒ A energia potencial gravítica do sistema automóvel + Terra diminui linearmente com a altura de descida, Ep = mgh, logo, a dependência com a distância percorrida é também linear.
⇒ À diminuição da energia potencial gravítica corresponde um aumento da energia cinética, mas, como existem forças dissipativas, a uma dada diminuição de energia potencial gravítica corresponde um menor aumento da energia cinética.
⇒ A energia cinética aumenta linearmente com a distância porque a resultante das forças que atuam no automóvel é constante (ΔEc = WFr = Fr d cos 0).
- Opção (A) ……………. 10 pontos
4. O automóvel, de massa 1,2 x 103 kg, deslizou 80 m ao longo da rampa até colidir com o motociclo.
A análise do acidente permitiu determinar que o módulo da velocidade do automóvel no instante da colisão era 7,5 m s-1.
Considere que o desnível entre as posições inicial e final do automóvel era 7,0 m.
- 11ºano – Física – Domínio 1 – subdomínio 1 (Tempo, posição e velocidade)
4.1. Determine o tempo que o automóvel demorou a percorrer aquela distância sobre a rampa, a partir de um esboço do gráfico do módulo da velocidade do automóvel em função do tempo (apresente esse esboço).
Mostre como chegou ao valor solicitado.
⇒ O automóvel tem aceleração constante, logo, o módulo da velocidade aumenta proporcionalmente com o tempo. A área entre a linha do gráfico e o eixo dos tempos até ao instante, td, em que ocorre a colisão é a distância percorrida pelo automóvel sobre a rampa:

ou
⇒ Como a aceleração é constante durante o percurso, então o esboço do gráfico v = f(t) é o de uma reta com vi = 0 m s-1

⇒ A área (de um triângulo) sob o gráfico v = f(t) é numericamente igual à distância percorrida pelo automóvel.

- O tempo que o automóvel levou a percorrer 80 m sobre a rampa é 21 s.
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
4.2. Determine, a partir de considerações energéticas, a intensidade da resultante das forças dissipativas que atuaram no automóvel paralelamente ao deslocamento.
Explicite o seu raciocínio, indicando todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
⇒ Na situação apresentada o trabalho realizado pelas forças dissipativas é igual à variação de energia mecânica.
Como
- ΔEm = ΔEc + ΔEp
tem-se:
- WFNC = ΔEm = ½ m x (vf2 – 0 ) + mg x (0 – hi) =½ x 1,2 x 103 x 7,52 – 1,2 x 103 x 10 x 7,0 = -5,0 x 104 J
mas
- WFNC = Fdissipativas x d x cos 180º ⇔ -5,0 x 104 = -80 x Fdissipativas ⇔ Fdissipativas = 6,3 x 102 J
⇒ A intensidade das forças dissipativas que atuam sobre o automóvel é igual a 6,3 x 102 J
- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a energia cinética do automóvel ao colidir com o motociclo …….. 2 pontos
- Ec = 3,38 x 104 J
⇒ Calcula a variação da energia potencial gravítica do sistema automóvel + Terra:
- ΔEpg = -8,40 x 104 J
ou
⇒ Calcula o trabalho realizado pela força gravítica que atua no automóvel …….. 2 pontos
- WFg = 8,40 x 104 J
⇒ Calcula o trabalho que seria realizado pela resultante das forças dissipativas …….. 3 pontos
- W = -5,02 x 104 J
⇒ Calcula a intensidade da resultante das forças dissipativas que atuaram no automóvel paralelamente ao deslocamento (F = 6,3 x 102 N) …….. 3 pontos
GRUPO III
- 11ºano – Física – Domínio 2 – subdomínio 2 (Eletromagnetismo)
1. Considere a agulha magnética, em equilíbrio, de uma bússola que se encontra num plano horizontal.
Em qual dos esquemas seguintes, nos quais o polo norte da agulha está assinalado a cinzento, está representada a componente horizontal do campo magnético, B , na posição em que a bússola se encontra?

- Opção (A)
⇒ Podendo a agulha mover-se livremente num plano horizontal, ela irá alinhar-se com a componente horizontal do campo magnético na posição em que se encontra.
⇒ O sentido dessa componente do campo magnético é do polo sul para o polo norte da agulha.
ou
⇒ Por convenção, as linhas de campo magnético saem do polo norte e entram no polo sul e o campo magnético, B, é tangente, em cada ponto, às linhas de campo e tem o sentido destas.
- Opção (A) ……………. 10 pontos
- 10ºano – Física – subdomínio 2 (Energia e fenómenos elétricos)
2. O circuito elétrico representado na Figura 2 é constituído por um gerador ideal (um gerador cuja resistência interna pode ser considerada nula), um reóstato T e um interruptor.

Conclua como varia a potência dissipada no reóstato T quando a resistência elétrica introduzida por esse reóstato aumenta.
Mostre como chegou à conclusão solicitada.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
⇒ Dado que o gerador é ideal (ri = 0), a diferença de potencial, U, nos seus terminais é constante, independente da corrente elétrica, I, e igual à sua força eletromotriz.
⇒ Considerando desprezável a energia dissipada nos fios de ligação e no interruptor, a diferença de potencial entre os terminais do reóstato é igual à diferença de potencial entre os terminais do gerador, logo constante.
⇒ O valor da diferença de potencial entre os terminais do reóstato é, para cada valor de resistência, R
- U = RI
Assim, quando a resistência aumenta, a corrente elétrica diminui, e como a potência dissipada neste dispositivo é
- P = UI
⇒ conclui-se que o valor desta diminui com o aumento da sua resistência.
ou
⇒ Sendo desprezável a resistência interna, r, do gerador, a diferença de potencial elétrico nos seus terminais é igual à sua força eletromotriz,
- ε (Ug = ε – I r ; r = 0 ⇒ Ug = ε)
constante, dado que o gerador é ideal.
⇒ Como apenas um reóstato está ligado ao gerador, pode considerar-se que estes componentes têm terminais comuns (os fios condutores que ligam o gerador ao reóstato têm resistências elétricas desprezáveis) e a diferença de potencial elétrico nos terminais do gerador, Ug, é a mesma que nos terminais do reóstato.
- UR (Ug = UR)
Assim, a diferença de potencial nos terminais do reóstato, UR, igual a ε, é também constante.
⇒ Com o aumento da resistência, R, do reóstato a corrente elétrica diminui (I = UR/R), logo, a potência dissipada, Pdiss = UR I, no reóstato, diminui.
3. As baleias comunicam através de sons que podem ser registados por hidrofones (sensores de pressão) e por sismómetros (sensores de velocidade) instalados no fundo do mar.
- 11ºano – Física – Domínio 2 – subdomínio 1 (Sinais e ondas)
3.1. Algumas baleias emitem um som com uma frequência praticamente constante, designado backbeat.

Na Figura 3, apresenta-se o registo de um sinal elétrico, obtido por um hidrofone, de parte de um backbeat.
No eixo horizontal representa-se o tempo em ms.
A frequência deste backbeat está contida no intervalo
(A) [36, 39] Hz
(B) [8, 11] Hz
(C) [53, 56] Hz
(D) [17, 20] Hz
- Opção (D)
⇒ A escala temporal apresenta 10 divisões entre os 200 ms e os 400 ms, assim cada divisão equivale a 20 ms.
⇒ Entre os 220 ms e os 300 ms decorre aproximadamente um período e meio.
Ou seja, a 4 divisões, 80 ms, corresponde aproximadamente 1,5 T donde se conclui que o período é próximo de 80 ms/1,5 = 53 ms e a frequência, f = 1/T, será próxima de 1/0,053 s = 19 Hz
ou
⇒ Na figura 3 do enunciado verifica-se que ao intervalo de tempo de 200 ms a 400 ms correspondem cerca de 3,5 períodos.
Assim,
- 400 – 200 = 3,5 T ⇔ T = 57,1 x 10-3 s

- Este valor, 17,5 Hz, está contido no intervalo [17, 20] Hz
- Opção (D) ……………. 10 pontos
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
3.2. As baleias podem ser localizadas a partir da refração dos sons por elas emitidos.
Considere um som emitido por uma baleia, que se propaga inicialmente na água do mar e que, depois, se passa a propagar nos sedimentos do fundo do mar.

Na Figura 4 (que não está à escala), representam-se as direções de propagação do som detetado pelo sismómetro S.
Considere que o índice de refração de um meio, para um som, é
em que k é uma constante e vmeio é o módulo da velocidade de propagação do som no meio considerado: 1,5 km s-1 na água do mar e 1,8 km s-1 nos sedimentos considerados.
Determine a distância a que a baleia se encontra do sismómetro S.
Explicite o seu raciocínio, indicando todos os cálculos efetuados.

⇒ Substituindo na Lei de Snell Descartes, n1 sin α1 = n2 sin α2, os índices de refração e a amplitude do ângulo de refração nos sedimentos.
⇒ Obtém-se o seno do ângulo de incidência sin α1 = 0,638, ao qual corresponde um ângulo de amplitude α1 = 39,7º
Da figura conclui-se:
- cos 39,7º = 4,0/d ⇔ d = 5,2 km
⇒ A baleia encontra-se a 5,2 km do sismómetro.
- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula o seno do ângulo de incidência (sin α = 0,638 ) …….. 6 pontos
⇒ Calcula a distância a que a baleia se encontra do sismómetro (d = 5,2 km) …….. 4 pontos
GRUPO IV
Io, Europa, Ganimedes e Calisto são satélites de Júpiter que foram descobertos por Galileu, no início do século XVII.
Considere o movimento de translação destes satélites em torno de Júpiter e admita que as órbitas por eles descritas são aproximadamente circulares.
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
1. A aceleração de um satélite no seu movimento de translação em torno de Júpiter
(A) depende do raio da órbita e da massa do satélite.
(B) depende do raio da órbita, mas não depende da massa do satélite.
(C) não depende do raio da órbita nem da massa do satélite.
(D) não depende do raio da órbita, mas depende da massa do satélite.
- Opção (B) ……………. 10 pontos
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
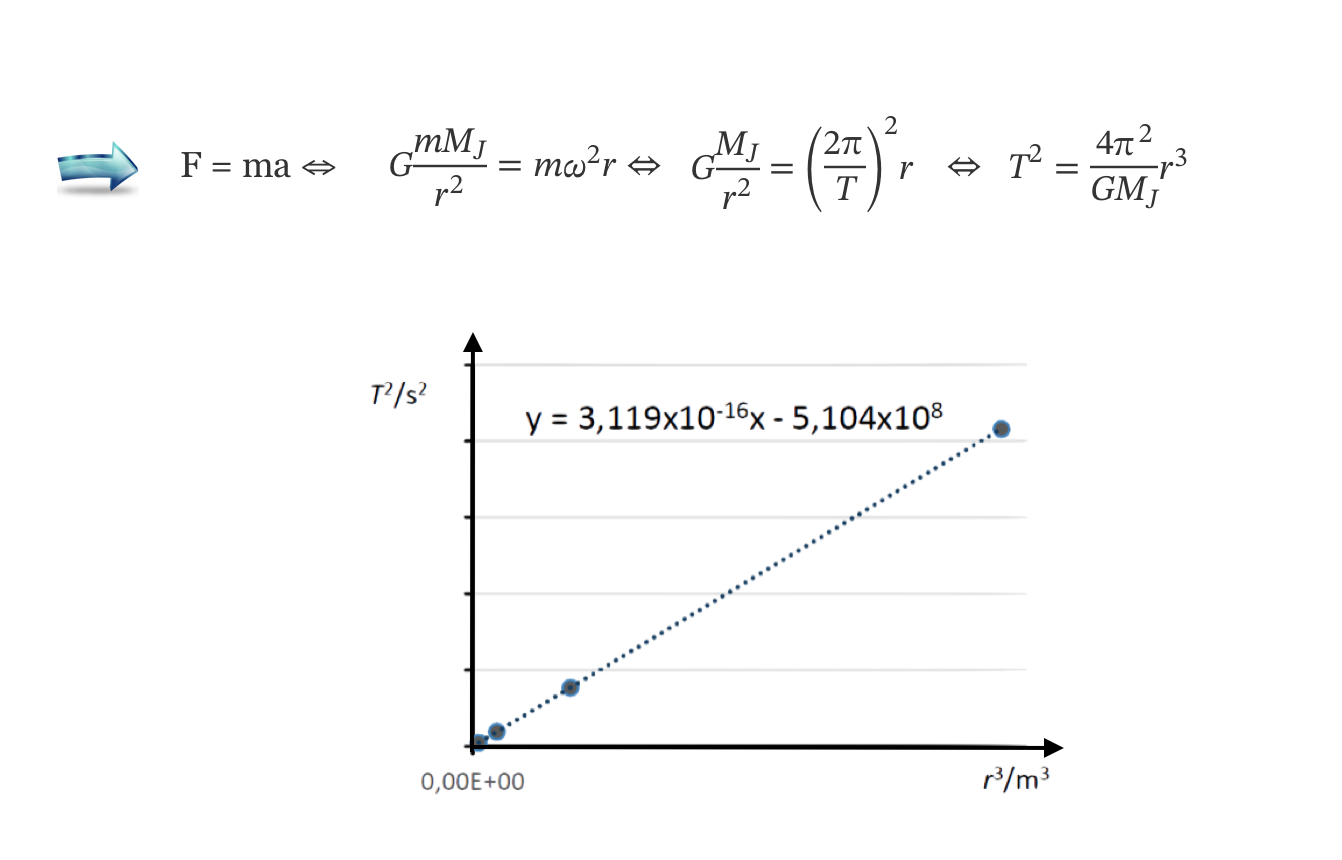
2. A massa de Júpiter pode ser determinada a partir de uma relação entre os períodos de translação, T, dos seus satélites e os raios, r, das órbitas por estes descritas, verificando-se que T2 varia linearmente com r3.
Na tabela seguinte, apresentam-se os valores de r3 e de T2 dos satélites de Júpiter descobertos por Galileu.
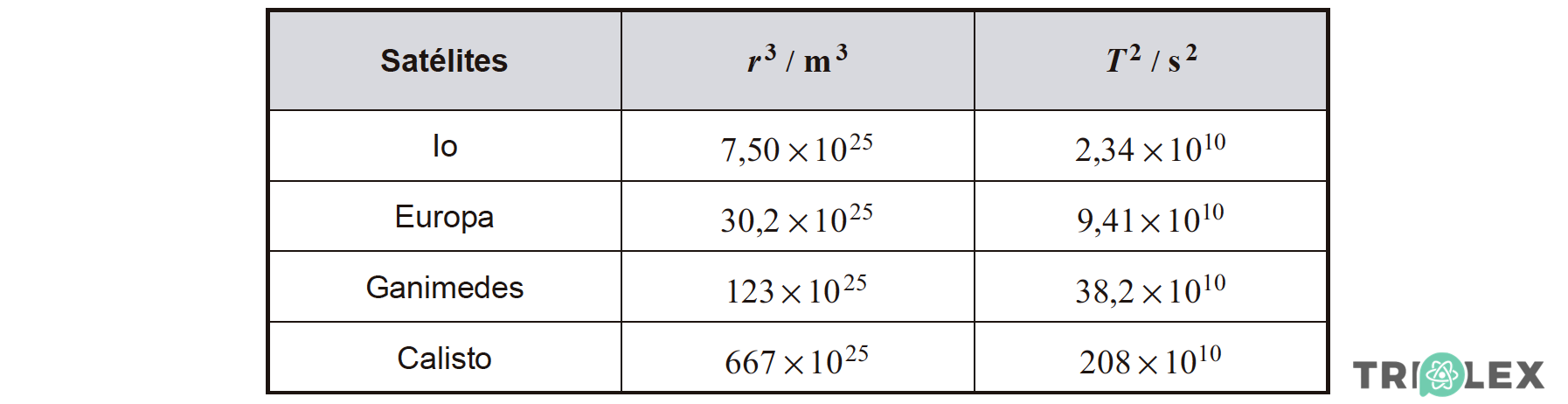 Determine a massa de Júpiter.
Determine a massa de Júpiter.
Na resposta:
- deduza a expressão de T2 em função de r3, a partir da segunda lei de Newton e da lei da gravitação universal;
- apresente a equação da reta de ajuste ao gráfico de T2 em função de r3 (despreze a ordenada na origem);
- calcule o valor solicitado.
Explicite o seu raciocínio, indicando todos os cálculos efetuados.
GRUPO V
O nitrogénio, N2 (g), e o hidrogénio, H2 (g), são utilizados na síntese do amoníaco, NH3 (g), traduzida por
N2 (g) + 3 H2 (g) ⇋ 2 NH3 (g)
Considere um sistema químico de volume variável que contém apenas estas três substâncias.
Na Figura 5, apresenta-se o gráfico da quantidade, n, de cada uma das substâncias em função do tempo, t, a uma temperatura constante, T.
O sistema químico foi perturbado num instante entre t1 e t2, tendo-se alterado a quantidade de uma das substâncias, a pressão constante. O sistema químico foi novamente perturbado num instante entre t3 e t4.

- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
1. Identifique a perturbação aplicada ao sistema químico considerado, no intervalo de tempo [t1 , t2], indicando a substância cuja quantidade foi alterada e se essa substância foi introduzida ou removida do sistema.
- Introdução de H2
⇒ No gráfico, observa-se o aumento das quantidades de H2 e de NH3 e a diminuição da quantidade de N2.
- De acordo com o princípio de Le Châtelier:
⇒ A introdução de H2 no sistema em equilíbrio provoca uma evolução do sistema no sentido em que contraria esta alteração, ou seja, no sentido direto. Assim, levaria ao consumo de N2 e à formação de NH3, o que é consistente com o observado no gráfico.
⇒ A remoção de N2 levaria ao consumo de NH3 e à formação de H2, o que é inconsistente.
⇒ A introdução de NH3 levaria à formação de N2 e de H2, o que é inconsistente.
- Identifica a perturbação aplicada ao sistema químico (introdução de H2 no sistema ou equivalente). ……………. 10 pontos
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
2. Conclua, fundamentando, se o quociente da reação no intervalo de tempo [t2 , t3] é superior, inferior ou igual ao quociente da reação no intervalo de tempo [t4 , t5].
Escreva um texto estruturado, utilizando linguagem científica adequada.
- É igual
⇒ Os dois intervalos de tempo correspondem a dois estados de equilíbrio sendo, então, Qr = Keq em ambos.
⇒ Como a Keq depende exclusivamente da temperatura, e não há alteração de temperatura, Keq é a mesma em ambos. Assim, conclui-se que o quociente da reação é o mesmo nos dois intervalos de tempo.
- Fundamentação:
⇒ identificação do quociente da reação com a constante de equilíbrio da reação, nos intervalos de tempo considerados;
⇒ não alteração da temperatura do sistema e uma mesma constante de equilíbrio da reação nos intervalos de tempo considerados.
Conclusão: o quociente da reação no intervalo de tempo [t2 ; t3] é igual ao quociente da reação no intervalo de tempo [t2 ; t3].

- 11ºano – Química – Domínio 2 – subdomínio 2 (Reações de oxidação redução)
3. A reação de síntese do amoníaco, sendo uma reação de
(A) ácido-base, ocorre com transferência de eletrões.
(B) oxidação-redução, ocorre com transferência de eletrões.
(C) ácido-base, ocorre com transferência de protões.
(D) oxidação-redução, ocorre com transferência de protões.
- Opção (B)
⇒ Reações de oxidação-redução são reações que ocorrem com transferência de eletrões.
⇒ Na reação de síntese do amoníaco, o número de oxidação do átomo de nitrogénio, N, diminui de zero, em N2 (g), para –3, em NH3 (g). Assim, a variação do número de oxidação do átomo de nitrogénio é:
- Δn.o. = -3 – 0 = -3 Ocorreu uma redução.
⇒ O número de oxidação do átomo de hidrogénio, H, aumenta de zero, em H2 (g), para +1, em NH3 (g).
Assim, a variação do número de oxidação do átomo de hidrogénio é:
- Δn.o. = +1 – 0 = +1 Ocorreu uma oxidação.
Cada átomo de nitrogénio capta três eletrões e cada átomo de hidrogénio cede um eletrão.
- Trata-se, portanto, de uma reação de oxidação-redução.
- Opção (B) ……………. 10 pontos
GRUPO VI
A emissão de óxidos de enxofre para a atmosfera, entre os quais o dióxido de enxofre, SO2 (g), dá origem ao ácido sulfúrico, H2SO4 (aq), presente nas chuvas ácidas.
- 11ºano – Química – Domínio 2 – subdomínio 2 (Reações de oxidação redução)
1. A formação de H2SO4 (aq) a partir de SO2 (g) pode ser globalmente traduzida por
2 SO2 (g) + 2 H2O (l) + O2 (g) → 2 H2SO4 (aq)
Nesta reação, o enxofre
(A) oxida-se, e o seu número de oxidação aumenta.
(B) oxida-se, e o seu número de oxidação diminui.
(C) reduz-se, e o seu número de oxidação aumenta.
(D) reduz-se, e o seu número de oxidação diminui.
- Opção (A)
⇒ n.o. (S) em SO2 : x + 2 x (-2) = 0 ⇒ x = +4
⇒ n.o. (S) em H2SO4 : 2 x (+1) + x + 4 x (-2) = 0 ⇒ x = +6
- O aumento do n.o. de S de +4 em para +6 em H2SO4 indica que cada átomo de enxofre cede dois eletrões, logo o enxofre oxida-se.
- Opção (A) ……………. 10 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
2. O ácido sulfúrico é um ácido diprótico que se ioniza em água em duas etapas sucessivas, traduzidas por
H2SO4 (aq) + H2O (l) → HSO4– (aq) + H3O+ (aq)
HSO4 – (aq) + H2O (l) ⇋ SO42- (aq) + H3O+ (aq)
O ião HSO4– , ao _______ um protão, transforma-se na sua base conjugada, a espécie _______.
(A) receber … H2SO4
(B) receber … SO42-
(C) ceder … H2SO4
(D) ceder … SO42-
- Opção (D)
⇒ Designa-se por par conjugado ácido-base o conjunto de duas partículas que diferem entre si em 1 H+.
⇒ A base conjugada de um ácido de Bronsted-Lowry é uma espécie que resulta do ácido por perda de um protão, ou seja, H+.
⇒ Na reação traduzida pela segunda equação, o anião hidrogenossulfato cede um protão à água, transformando-se na sua base conjugada, o ião sulfato.
- Opção (D) ……………. 10 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
- 11ºano – Química – A.l. – 2.1 – Titulação ácido-base
3. A Figura 6 apresenta a curva da titulação de 10,00 cm3 de uma solução de ácido sulfúrico, H2SO4 (aq ), com uma solução padrão de hidróxido de sódio, NaOH (aq), de concentração 5,00 x 10-2 mol dm-3.
A reação que ocorre pode ser traduzida por
H2SO4 (aq) + 2 NaOH (aq) → Na2SO4 (aq) + 2 H2O (l)

Determine a concentração da solução de ácido sulfúrico.
Explicite o seu raciocínio, indicando todos os cálculos efetuados.
⇒ V(H2SO4) = 10,00 cm3
⇒ c(NaOH) = 5,00 x 10-2 mol dm-3 ⇒ V(NaOH) = 15,2 cm3 (obtido por leitura no gráfico)Numa titulação, adiciona-se, gota a gota, titulante ao titulado até atingir o “ponto de equivalência”, isto é, até que seja adicionada a quantidade estequiométrica de titulante ao titulado.
De acordo com a equação química que traduz a reação da referida titulação, o ácido e a base reagem na proporção estequiométrica de 1:2.
Assim, a quantidade de ácido sulfúrico(aq) inicial é metade da quantidade de hidróxido de sódio adicionado até atingir o ponto de equivalência:
⇒ n(H2SO4) = ½ n (NaOH)
Até atingir o ponto de equivalência da titulação, (15,2 cm3 ; 7,00), a quantidade de NaOH adicionada é :
⇒ n(NaOH) = V x c = 15,2 x 10-3 x 5,00 x 10-2 = 7,600 x 10-4 mol
Como a proporção estequiométrica ácido:base é 1:2, a quantidade de H2SO4 presente na solução titulada será:
- n(H2SO4) = 3,800 x 10-4 mol

- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a quantidade de NaOH adicionada até ao ponto de equivalência da titulação (nNaOH = 7,600 x 10-4 mol ) (ver nota 1) …….. 5 pontos
⇒ Calcula a quantidade de H2SO4 presente na solução titulada (n(H2SO4) = 3,800 x 10-4 mol ) …….. 3 pontos
⇒ Calcula a concentração da solução de H2SO4 (aq) ( c = 3,80 x 10-2 mol dm-3 ) (ver nota 2) …….. 2 pontos
Notas:
1. A apresentação de um volume de titulante gasto até ao ponto de equivalência diferente de 15,2 cm3 ou de 15,3 cm3 contido no intervalo [15,1; 15,3] cm3 será considerado um erro de tipo 2. A apresentação de um volume de titulante gasto até ao ponto de equivalência superior a 22,2 cm3 implica que a resposta seja classificada com zero pontos.
2. A apresentação da concentração da solução de H2SO4 (aq) com um número incorreto de algarismos significativos deve ser considerada um erro de tipo 2.
FIM








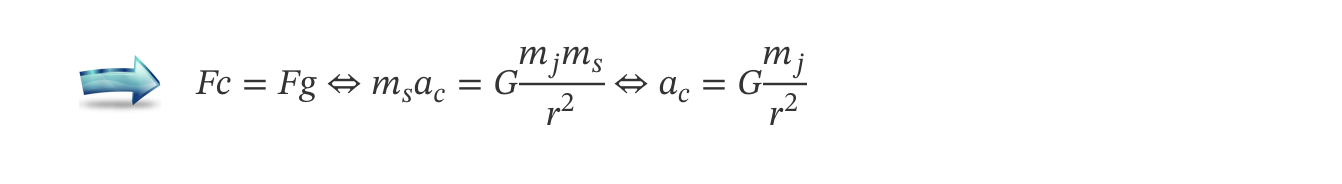
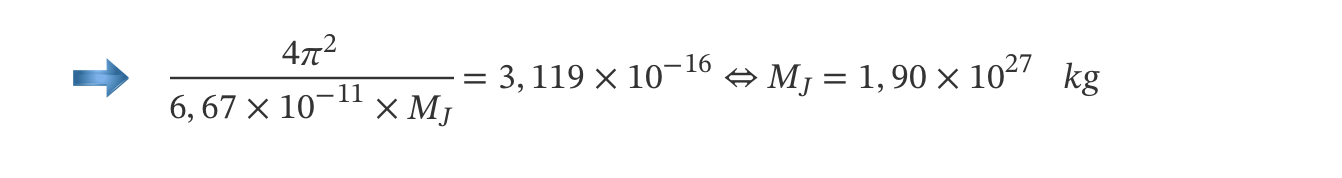
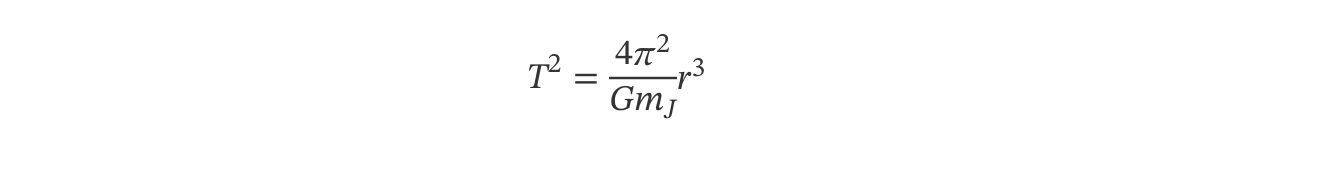

este achei um bocado chatão :/