2022– 2ªFase – Prova Escrita de FQ A
Voltar a: Física e Química
- Prova Escrita de Física e Química A – versão 1
- Prova 715: 2.ª Fase – 2022
A prova inclui 16 itens, devidamente identificados no enunciado, cujas respostas contribuem obrigatoriamente para a classificação final.
Dos restantes 8 itens da prova, apenas contribuem para a classificação final os 4 itens cujas respostas obtenham melhor pontuação.
1. O Sol emite luz, mas também fluxos de partículas que constituem o vento solar.
Estas partículas carregadas eletricamente, como protões, eletrões e iões de hélio, interagem com o campo magnético terrestre, deformando-o.
- 11ºano – Física – Domínio 2 – subdomínio 2 (Eletromagnetismo)
1.1. A Figura 1 ilustra a deformação do campo magnético terrestre por interação com o vento solar.

O módulo do campo magnético é maior
(A) em P1 do que em P4.
(B) em P3 do que em P2.
(C) em P2 do que em P4.
(D) em P1 do que em P2.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (C)
⇒ O módulo do campo magnético é tanto maior quanto maior for a densidade das linhas de campo.
⇒ Na figura 1 do enunciado, verifica-se que, dos pontos assinalados (P1 ,P2 , P3 e P4 ), as linhas de campo são mais densas na região do campo que contém o ponto P2 .
- Opção (C) ……………. 10 pontos
1.2. As partículas energéticas constituintes do vento solar, ao entrarem na alta atmosfera terrestre, provocam manifestações de luz conhecidas por auroras.
As auroras mais comuns apresentam cor verde, o que se deve, essencialmente, à presença de oxigénio atómico.
- 10ºano – Química – Domínio 2 – subdomínio 1 (Energia dos eletrões nos átomos)
1.2.1. Na alta atmosfera terrestre, encontra-se oxigénio atómico, mas raramente se encontra nitrogénio atómico, porque a ligação covalente na molécula de dinitrogénio tem energia de ligação do que a ligação covalente na molécula de dioxigénio.
(A) dupla … menor
(B) dupla … maior
(C) tripla … menor
(D) tripla … maior
- Opção (D)
⇒ A ligação covalente na molécula de dinitrogénio é uma ligação covalente tripla, N≡N, e na molécula de dioxigénio estabelece-se uma ligação covalente dupla, O=O.
⇒ A energia da ligação covalente entre dois átomos é tanto mais forte quanto maior a densidade eletrónica na zona internuclear, logo é mais forte quando os átomos se ligam por uma ligação tripla, N≡N, do que quando a ligação é dupla, O=O. Para quebrar uma ligação mais forte, é necessário que a radiação tenha maior energia por fotão, ou seja, tenha maior frequência.
⇒ Assim, a ligação dupla da molécula de dioxigénio necessita de menor energia para ser quebrada do que a ligação tripla da molécula de dinitrogénio, originando o oxigénio atómico.
- Opção (D) ……………. 10 pontos
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
1.2.2. A cor observada nas auroras mais comuns deve-se à de radiação, associada a transições eletrónicas para níveis de energia do átomo de oxigénio.
(A) emissão … inferiores
(B) emissão … superiores
(C) absorção … inferiores
(D) absorção … superiores
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (A)
⇒ A energia dos eletrões num átomo é tanto maior quanto mais elevado for o nível, n, ocupado.
⇒ Quando um eletrão passa de um nível n com energia para um nível de menor energia (n inferior), E1, se o átomo estiver isolado (baixa pressão), e, como tal, não acontecerá desexcitação por choque entre partículas, ocorre emissão de radiação de energia igual à diferença dessas duas energias, ΔE = E2 – E1 .
- Opção (A) ……………. 10 pontos
1.3. O satélite de observação solar SOHO contém instrumentos que permitem estudar distúrbios do vento solar.
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
1.3.1. O SOHO orbita o Sol com movimento circular uniforme e com o mesmo período orbital da Terra. Nos diagramas que se seguem, considere d a distância média da Terra ao Sol.
Admita que a distância do SOHO ao Sol é 99 vezes superior à distância do SOHO à Terra.
Qual dos diagramas (A, B, C ou D) pode representar as acelerações centrípetas, na mesma escala, no SOHO, ac(SOHO), e na Terra, acT?

- Opção (B)
⇒ De acordo com o enunciado, a distância do SOHO ao Sol é 99 vezes a distância do SOHO à Terra.
⇒ Dado que o período orbital do SOHO é igual ao período orbital da Terra em torno do Sol, e como ω = 2π/T, conclui-se que ambos têm a mesma velocidade angular, ω.
⇒ Como ac = ω2 r, e o raio da trajetória da Terra é superior ao raio da trajetória do SOHO, a aceleração centrípeta da Terra é superior à do SOHO.
- Opção (B) ……………. 10 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
1.3.2. O satélite SOHO está equipado com painéis fotovoltaicos.
Considere que a potência média da radiação solar por unidade de área, na órbita do satélite, é 1370 W m-2 e que o conjunto de painéis fotovoltaicos instalados no satélite tem um rendimento médio de 20%.
Admita que a potência útil dos painéis é 1500 W.
Qual das expressões seguintes permite calcular a área total de painéis fotovoltaicos no SOHO?

- Opção (B) ……………. 10 pontos
2. Uma rapariga deixa-se baloiçar presa numa corda inextensível, que está atada a um coqueiro, como se representa na Figura 2 (que não está à escala).

A rapariga parte do repouso em A e oscila presa à corda até C, passando pelo ponto intermédio, B.
Em A e em C, a rapariga encontra-se à mesma altura, considerando-se como nível de referência a superfície da água.
Considere que a rapariga pode ser representada pelo seu centro de massa, CM (modelo da partícula material), e que a resistência do ar é desprezável.
Considere a superfície da água como o nível de referência da energia potencial gravítica.
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
2.1. No movimento da rapariga entre os pontos A e B,
(A) a variação da energia cinética da rapariga é nula.
(B) apenas atuam, no CM da rapariga, forças conservativas.
(C) apenas atuam, no CM da rapariga, forças não conservativas.
(D) a variação da energia mecânica do sistema rapariga + Terra é nula.
- Opção (D)
⇒ A rapariga parte do repouso na posição A e atinge a velocidade máxima em B, pelo que varia a energia cinética entre A e B.
⇒ As forças que atuam sobre a rapariga são: a força gravítica, força conservativa, e a tensão da corda, cujo trabalho é nulo, pois é perpendicular em cada ponto à trajetória. Assim, pode concluir-se que a variação de energia mecânica do sistema rapariga + Terra é nula.
- Opção (D) ……………. 10 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
2.2. Ao atingir o ponto C, a rapariga larga a corda e cai verticalmente, atingindo a superfície da água no ponto D.
Mostre que a razão entre o módulo da velocidade da rapariga no ponto D, vD, e o módulo da velocidade da rapariga no ponto B, vB, ou seja, vD/vB, é 1,6.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Elementos de resposta:
⇒ iguala a energia mecânica entre dois pontos assinalados no percurso, obtendo a expressão 3 mg = ½ mvD2 (ou equivalente)
ou
- apresenta as equações do movimento 3 = ½ g t2 e vD = g t;
⇒ iguala a energia mecânica entre dois pontos assinalados no percurso, obtendo a expressão 3 m g = ½ m vB2 + 1,8 m g (ou equivalente);
⇒ mostra que | vD | / | vB | = 1,6

3. No laboratório da escola, um grupo de alunos realizou uma atividade experimental que consistia na medição de volumes de água e das massas respetivas. Os alunos usaram uma bureta graduada, um gobelé e uma balança digital.
Considere a temperatura constante ao longo de toda a atividade e que a massa do gobelé, vazio e seco, é 68,82 g.
- 10ºano – Química – Domínio 1 – subdomínio 1 (Massa e tamanho dos átomos)
- 10ºano – Química – A.l. – 1.1 – Volume e número de moléculas numa gota de água
3.1. Os alunos mediram o volume de água escoada para um gobelé.
A Figura 3 ilustra parte da bureta, graduada em cm3, estando representado o nível de água observado no início (I) e no final (II) de um dos ensaios.

A incerteza da leitura é ____, e o volume de água escoada no ensaio é ____.
(A) 0,05 cm3 … 15 cm3
(B) 0,05 cm3 … 0,85 cm3
(C) 0,10 cm3 … 1,15 cm3
(D) 0,10 cm3 … 0,85 cm3
- Opção (A)
⇒ Leituras na bureta:
- nível inicial – 1,60 cm3;
- nível final – 2,75 cm3;
⇒ Incerteza (metade do menor intervalo da escala) = 0,05 cm3
⇒ Volume de água escoada = (2,75 – 16,0) cm3 = 1,15 cm3
- Opção (A) ……………. 10 pontos
- 10ºano – Química – Domínio 1 – subdomínio 1 (Massa e tamanho dos átomos)
- 10ºano – Química – A.l. – 1.1 – Volume e número de moléculas numa gota de água
3.2. Na tabela estão registados os valores do volume, V, de água escoada para o gobelé e da massa, m, de água correspondente.

Calcule a massa de água correspondente ao volume de 61,0 cm3.
Na resposta:
– apresente a equação da reta de ajuste ao gráfico de m em função de V ;
– apresente o valor solicitado com três algarismos significativos.
Apresente todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
⇒ Recorrendo à calculadora gráfica, para os valores tabelados, a equação da reta que se ajusta ao gráfico de m em função de V é:
- m = 9,769 x 10-1 V + 3,637 x 10-2
⇒ De acordo com esta equação, o valor da massa de água correspondente ao volume de 61,0 cm3 é:
- m = 9,769 x 10-1 x 61,0 + 3,637 x 10-2 = 59,6 g
- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Apresenta a equação da reta de ajuste ao gráfico m = f (V) (m = 9,769 x 10-1 V + 3,637 x 10-2 ) (ver nota 1) …….. 5 pontos
⇒ Calcula a massa de água correspondente ao volume de 61,00 cm3 (59,6 g) (ver nota 2) …….. 5 pontos
Notas:
1. As unidades de massa e de volume na equação apresentada são, respetivamente, g e cm3.
Consideram-se válidas equações da reta de ajuste com outras unidades de massa ou de volume.
2. A apresentação do resultado final com um número de algarismos significativos diferente do solicitado no enunciado do item implica a desvalorização de dois pontos.
- 10ºano – Química – Domínio 1 – subdomínio 1 (Massa e tamanho dos átomos)
- 10ºano – Química – A.l. – 1.1 – Volume e número de moléculas numa gota de água
3.3. Um outro grupo de alunos efetuou a mesma atividade experimental, utilizando o mesmo material, tendo cometido um erro que foi detetado aquando do traçado do gráfico da Figura 4.

Identifique o erro sistemático cometido pelos alunos e justifique a sua resposta com base na análise do gráfico.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
⇒ Por análise do gráfico dado, verifica-se que a ordenada na origem é cerca de 70 g e que, portanto, para um volume de água escoada de 0 cm3 não corresponde a massa de 0 g.
⇒ Conclui-se que foi cometido um erro: os alunos não subtraíram a massa do gobelé vazio à massa do gobelé com água.
⇒ Pode concluir-se, por análise do gráfico, que a massa do gobelé, vazio e seco, é aproximadamente 70 g , o que está de acordo com o valor real dessa massa (68,82 g) .
- Elementos de resposta:
⇒ analisa o gráfico (refere que a ordenada na origem é, aproximadamente, 70 g OU que a um volume de 0 cm3 de água não corresponde a massa de 0 g) (ou equivalente);
⇒ identifica o erro cometido (refere que os alunos não subtraíram à massa do gobelé com água a massa do gobelé vazio).

4. Na Figura 5, está esquematizado um processo laboratorial destinado a estudar o aquecimento de uma amostra de água.
Montou-se um circuito elétrico com uma pilha, um interruptor e uma resistência de imersão, R.
Neste circuito, foram instalados dois aparelhos de medida, um voltímetro e um amperímetro.

- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
4.1. Qual das opções seguintes pode representar o processo responsável pelo aquecimento da água nesta experiência?

A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (C)
⇒ O processo representado responsável pelo aquecimento da água é a convecção.
⇒ A temperatura da água que está em contacto com a resistência aumenta, o que provoca uma diminuição da sua densidade. Logo, a água menos densa sobe, entrando em contacto com a água a temperaturas menores, arrefecendo.
⇒ Consequentemente, a sua densidade aumenta, pelo que volta a descer, gerando, assim, as correntes de convecção.
- Opção (C) ……………. 10 pontos
- 10ºano – Física – subdomínio 2 (Energia e fenómenos elétricos)
4.2. Num ensaio, foi aquecida uma amostra de água durante 10 minutos, usando-se uma resistência elétrica de imersão.
Mediu-se a diferença de potencial, U, de 8,17 V nos terminais da resistência e a corrente elétrica, I, de 700 mA no circuito.
Admita que estes valores se mantiveram constantes ao longo do ensaio.
Qual a energia dissipada pela resistência, por efeito Joule, durante este ensaio?
(A) 4,9 kJ
(B) 3,4 kJ
(C) 1,7 kJ
(D) 5,7 kJ
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (B)
- Δt = 10 min = 600 s
- U = 8,17 J
- I = 700 mA = 0,700 A
- Opção (B) ……………. 10 pontos
5. Considere o equilíbrio químico entre o tetróxido de dinitrogénio, N2O4 , e o dióxido de nitrogénio, NO2.
N2O4 (g) 2 NO2 (g) ΔH = 58,5 kJ
À temperatura de 25 ºC, a constante de equilíbrio, Kc , é 4,63 x 10-3.
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
5.1. Num reator de 7,50 dm3, introduziram-se 3,0 mol de N2O4 (g), à temperatura de 25 ºC.
Calcule a fração molar do NO2 (g) quando o sistema atingiu o equilíbrio, àquela temperatura.
Apresente todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
Este item pode ser resolvido por, pelo menos, dois processos.
- 1.º Processo
Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a variação da concentração do N2O4 até se atingir o equilíbrio (2,0 x 10-2 mol dm-3) …….. 3 pontos
⇒ Calcula a concentração do NO2 no equilíbrio(4,18 x 10-2 mol dm-3) (ver nota) …….. 2 pontos
⇒ Calcula a concentração do N2O4 no equilíbrio (3,79 x 10-1 mol dm-3) (ver nota) ……… 2 pontos
⇒ Calcula a fração molar do NO2 no equilíbrio (0,10) ……… 3 pontos
- 2.º Processo
Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a variação da quantidade do N2O4 até se atingir o equilíbrio (0,157 mol) …….. 3 pontos
⇒ Calcula a quantidade do NO2 no equilíbrio (0,314 mol) (ver nota) ……… 2 pontos
⇒ Calcula a quantidade do N2O4 no equilíbrio (2,84 mol) (ver nota) ……… 2 pontos
⇒ Calcula a fração molar do NO2 no equilíbrio (0,10) …….. 3 pontos
Notas:
- A ordem da segunda e da terceira etapas é arbitrária.
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
5.2. Noutro reator, foi introduzido NO2.
A Figura 6 mostra as variações das concentrações, em mol dm-3, de NO2 (g) e de N2O4 (g) até o equilíbrio ser atingido, à temperatura T.

Conclua, justificando, se a temperatura T é maior, menor ou igual a 25 ºC.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- T > 25ºC
- Kc = 4,63 x 10-3
- [NO2]e = 2,0 mol dm3
- [N2O4]e = 1,0 mol dm3
⇒ Para a reação inversa 2 NO2 (g) 2 NO2 (g), a constante será o inverso desta
que é superior à constante de equilíbrio a 25 ºC, Kc (T) > Kc (25 ºC)
- Isto significa que a reação é mais extensa à temperatura T do que a 25 ºC
⇒ Como a reação é endotérmica no sentido direto, ΔH >0, de acordo com o Princípio de Le Châtelier, se a temperatura aumentar, o equilíbrio evolui no sentido direto (sentido em que a reação absorve calor), de modo a contrariar a elevação de temperatura, aumentando a extensão da reação.
- Conclui-se, assim, que, nas reações endotérmicas, a constante de equilíbrio aumenta com a temperatura, como efetivamente se verifica.
⇒ Por esta razão, temos de concluir que a reação se efetuou a uma temperatura mais alta, ou seja, T > 25 ºC
- 11ºano – Química – Domínio 2 – subdomínio 2 (Reações de oxidação redução)
5.3. Para produzir o NO2 (g), recorreu-se a uma reação de oxidação-redução entre o ácido nítrico, HNO3 , e o cobre, traduzida por
Cu (s) + 4 HNO3 (aq) → Cu(NO3)2 (aq) + 2 NO2 (g) + 2 H2O (l)
O número de oxidação do nitrogénio na molécula de HNO3 é
(A) + 5, e esta é a espécie oxidante.
(B) + 6, e esta é a espécie oxidante.
(C) + 5, e esta é a espécie redutora.
(D) + 6, e esta é a espécie redutora.
- Opção (A)
⇒ Cálculo do número de oxidação de N em HNO3:
- 1 + x + 3 x (-2) = 0 ⇔ x = +5
⇒ Cálculo do número de oxidação de N em NO2:
- x + 2 x (-2) = 0 ⇒ x = + 4
⇒ Nesta reação, o número de oxidação do nitrogénio, N, passa de +5, em HNO3, para +4, em NO2.
⇒ Cada átomo de nitrogénio captou um eletrão, o que quer dizer que a molécula de HNO3 atuou como oxidante.
- Opção (A) ……………. 10 pontos
5.4. No laboratório, existe uma solução concentrada de HNO3 (M = 63,02 g mol-1; Ka muito elevado), com 68% (em massa) de HNO3 e massa volúmica 1,41 g cm-3.
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
5.4.1. Calcule o volume de solução concentrada que é necessário para preparar 250 cm3 de uma solução diluída de HNO3 com pH de 0,30.
Apresente todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- HNO3 (conc) : % m/m = 68%
- ρ = 1,41 g cm-3
- pH = 0,30
- V (HNO3 dil) = 250 cm3
- V (HNO3 conc) = ?
⇒ O pH da solução diluída de HNO3 é 0,30
- O HNO3 é um ácido muito forte (Ka muito elevado), logo a sua protólise é muito extensa.
Como, de acordo com a equação de protólise de HNO3 a proporção estequiométrica é 1:1, a quantidade de HNO3 (aq) que vai dar origem à solução diluída é praticamente igual à quantidade de H3O+ na solução diluída, ou seja, 0,125 mol.
⇒ A massa de 1000 cm3 de solução concentrada será:
⇒ A massa de HNO3 presente em 100 cm3 de solução de ácido concentrado será:
⇒ A quantidade de HNO3 presente em de solução será:
⇒ Numa diluição, a quantidade de soluto existente na solução diluída e na solução concentrada mantém-se.

Este item pode ser resolvido por, pelo menos, dois processos.
- 1.º Processo
Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a concentração de HNO3 na solução diluída (0,501 mol dm-3) …….. 3 pontos
⇒ Calcula a concentração de HNO3 na solução concentrada (15,2 mol dm-3) …….. 4 pontos
⇒ Calcula o volume da solução concentrada de HNO3 necessário à preparação da solução diluída (8,2 cm3) ……… 3 pontos
- 2.º Processo
Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a quantidade de HNO3 na solução diluída (0,125 mol) …….. 4 pontos
⇒ Calcula a massa da solução concentrada de HNO3 (11,6 g) …….. 3 pontos
⇒ Calcula o volume da solução concentrada de HNO3 necessário à preparação da solução diluída (8,2 cm3) ……… 3 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
5.4.2. Qual é o par ácido-base conjugado resultante da ionização do ácido nítrico em água?
(A) HNO3 / H2O
(B) HNO3 / NO3–
(C) H2O / NO3–
(D) H3O+ / NO3–
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (B)
⇒ A reação de ionização de ácido nítrico em água é expressa por:
HNO3 (aq) + H2O (l) → NO3– (aq) + H3O+ (aq)
⇒ Como um par conjugado ácido-base é um conjunto de duas partículas que diferem entre si em 1 H+, e desta ionização resulta o anião NO3–, que, com o respetivo ácido conjugado HNO3, constitui um par ácido-base que só difere em um protão.
- Opção (B) ……………. 10 pontos
6. Um avião a jato, de massa m (em kg), aterra com pouco combustível na pista retilínea de um porta-aviões, de acordo com a Figura 7, que não está à escala.
No momento em que atinge a pista, o módulo da velocidade do avião é 65 m s-1.
Durante a aterragem, um cabo de retenção, CR, provoca uma desaceleração progressiva do avião, na secção horizontal da pista.
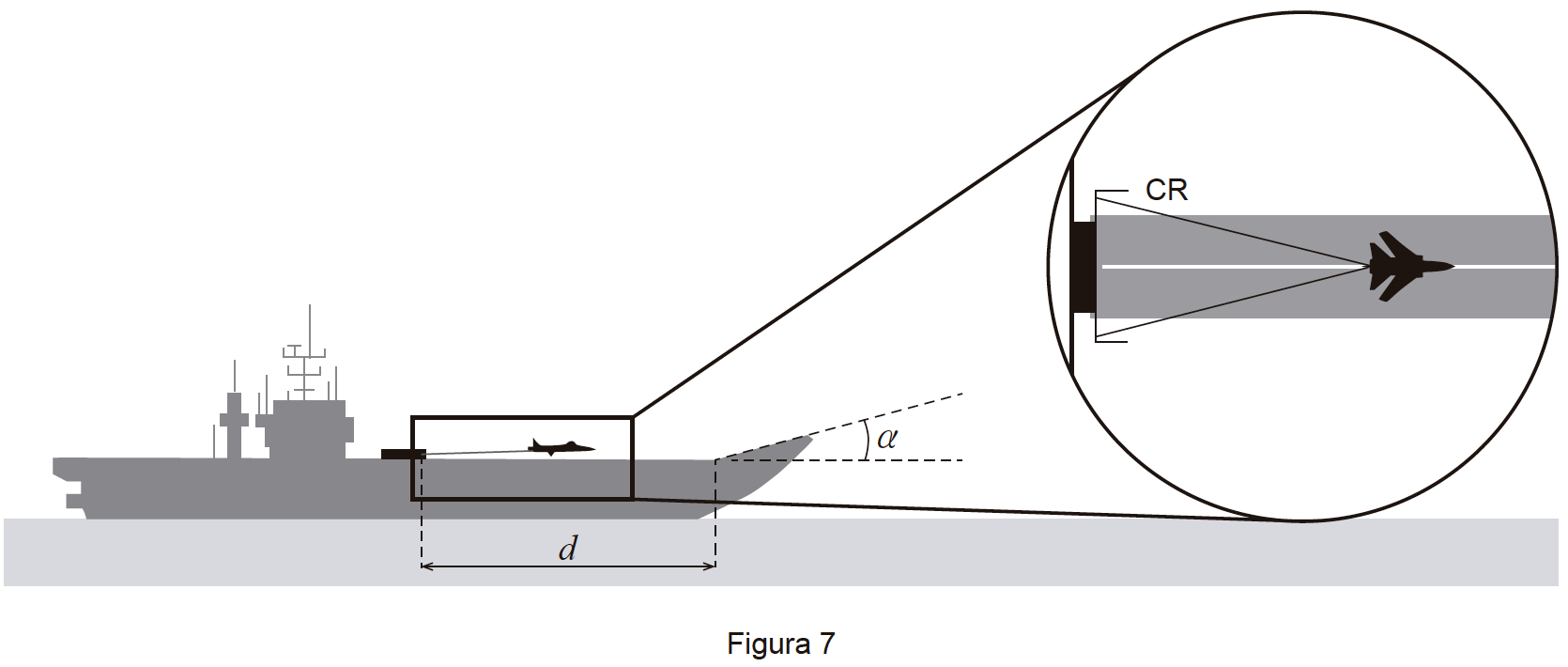
Admita que o cabo de retenção é responsável por uma diminuição de 91,5% da velocidade inicial do avião, mas sofre rotura ao fim de 3,5 s.
Aos 7,8 s , o avião acaba por se imobilizar na secção inclinada da pista.
Na Figura 8, apresenta-se o gráfico do módulo da resultante das forças que atuam no avião durante a aterragem, em função do tempo.

Considere que o avião pode ser representado pelo seu centro de massa (modelo da partícula material) e que as forças de atrito e de resistência do ar são desprezáveis.
- 11ºano – Física – Domínio 1 – subdomínio 1 (Tempo, posição e velocidade)
6.1. O gráfico da Figura 8 permite concluir que o avião apresenta, entre
(A) 0 s e 3,5 s, movimento uniformemente retardado e, entre 3,5 s e 5,5 s, movimento uniforme.
(B) 0 s e 3,5 s, movimento uniformemente retardado e, entre 5,5 s e 7,8 s, movimento uniforme.
(C) 3,5 s e 5,5 s, velocidade constante e, entre 5,5 s e 7,8 s, aceleração de módulo constante.
(D) 3,5 s e 5,5 s, aceleração de módulo constante e, entre 5,5 s e 7,8 s, velocidade constante.
- Opção (C)
Da análise do gráfico representado na figura 8 do enunciado, verifica-se que, entre:
⇒ 0 s e 3,5 s, o módulo da resultante das forças que atuam sobre o avião é variável e oposta ao sentido do movimento, logo o movimento é retardado, mas não uniformemente retardado, pois a aceleração não é constante.
⇒ 3,5 s e 5,5 s, o módulo da resultante das forças que atuam sobre o avião é nulo, pois a aceleração é nula, logo o avião tem movimento retilíneo e uniforme e velocidade constante.
⇒ 5,5 s e 7,8 s, o módulo da resultante das forças que atuam sobre o avião é constante, bem como o módulo da sua aceleração.
- Opção (C) ……………. 10 pontos
- 11ºano – Física – Domínio 1 – subdomínio 1 (Tempo, posição e velocidade)
6.2. Na aterragem, o avião percorre, na secção horizontal da pista retilínea, uma distância, d, de 169 m.
No intervalo de tempo ]0,0; 3,5[ s , o avião percorre _____ do percurso horizontal retilíneo.
(A) 73%
(B) 82%
(C) 89%
(D) 93%
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (D)
⇒ Como o cabo de retenção provoca uma diminuição de 91,5% da velocidade inicial, ao fim de 3,5 s, quando o cabo sofre rotura, a velocidade será:
- v = 65 x (1,00 – 0,915) = 5,5 m s-1
⇒ Entre 3,5 s e 5,5 s, o avião percorre a pista com movimento retilíneo e uniforme, pois a resultante das forças é nula, e a distância percorrida é:
- d = v x Δt ⇔ d = 5,5 x (5,5 – 3,5) = 11 m
⇒ Como o comprimento total e retilíneo da pista é 169 m, então, no intervalo de tempo de 0,0 s a 3,5 s, o avião percorreu 169 – 11 = 158 m, que corresponde a uma percentagem de:

- Opção (D) ……………. 10 pontos
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
6.3. Entre 5,5 s e 7,8 s , o avião, sujeito a uma força resultante não nula, percorre uma trajetória retilínea com uma inclinação α em relação à direção horizontal da pista, tal como se representa na Figura 7.
Calcule, a partir da leitura dos valores do gráfico, a amplitude do ângulo α.
Apresente todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
Este item pode ser resolvido por, pelo menos, dois processos.
- 1.º Processo
Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Regista, a partir do gráfico, o módulo da força resultante que atua no avião no intervalo de tempo ]5,5; 7,8[ s ( |Fr| = 0,24 mg ) …….. 3 pontos
⇒ Estabelece uma relação de igualdade entre uma das componentes da força gravítica e a força resultante no intervalo de tempo ]5,5; 7,8[ s (mg sin α = 0,24 mg) …….. 4 pontos
⇒ Calcula o ângulo a (14º) ……… 3 pontos
- 2.º Processo
Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a altura máxima atingida na secção inclinada da pista (1,53 m) …….. 3 pontos
⇒ Calcula a distância percorrida na secção inclinada da pista no intervalo de tempo ]5,5; 7,8[ s (6,36 m) …….. 4 pontos
⇒ Calcula o ângulo α (14º) ……… 3 pontos
7. Na construção de aviões a jato, é utilizado titânio, Ti (s), que pode ser obtido pela reação entre o composto TiX4 (em que X representa genericamente um elemento não metálico) e o magnésio fundido, Mg (l).
A reação é expressa por
TiX4 (g) + 2 Mg (l) → Ti (s) + 2 MgX2 (l)
- 11ºano – Química – Domínio 1 – subdomínio 1 (Aspetos quantitativos das reações químicas)
7.1. Para obtenção de titânio, fez-se reagir 1, 85 x 105 mol de TiX4 com 1,72 x 103 kg de Mg.
Determine o rendimento da reação ao obter-se 1,21 x 103 kg de Ti (s).
Apresente todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- n (TiX4) = 1,85 x 105 mol
- m (Mg) = 1,72 x 103 kg
- m (Ti)obtido = 1,21 x 103 kg
TiX4 (g) + 2 Mg (l) → Ti (s) + 2 MgX2 (l)

- Conclui-se, assim, que o Mg é o reagente limitante.
De acordo com a estequiometria da reação, 2 mol de Mg (2 x 24,31 g) podem teoricamente originar 1 mol de Ti (47,87 g).
⇒ Assim, prevê-se que 7,075 x 104 mol de Mg poderiam formar 3,538 x 104 mol de Ti (s)

- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Identifica, recorrendo a cálculos, o Mg como o reagente limitante …….. 3 pontos
⇒ Calcula a quantidade de Ti que se prevê formar, de acordo com a estequiometria (3,538 x 104 mol ) …….. 3 pontos
⇒ Calcula o rendimento da reação (71,4 %) ……… 4 pontos
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
7.2. O composto TiX4 é um composto molecular de geometria tetraédrica.
A Figura 9 apresenta o espectro do átomo do elemento representado pela letra X, obtido por espectroscopia fotoeletrónica (PES), contendo informação de todos os eletrões do átomo deste elemento.

De acordo com o espectro apresentado, pode concluir-se que a primeira energia de ionização deste elemento é
(A) 273 MJ mol-1 e o elemento é o flúor.
(B) 1,25 MJ mol-1 e o elemento é o flúor.
(C) 273 MJ mol-1 e o elemento é o cloro.
(D) 1,25 MJ mol-1 e o elemento é o cloro.
- Opção (D)
⇒ O espetro apresenta uma série de energias de remoção de eletrões (cada pico corresponde a um valor de energia de remoção), e as intensidades das linhas são proporcionais ao número de eletrões em cada subnível.
⇒ Analisando as bandas apresentadas, verifica-se que estão de acordo com a configuração 1s2 2s2 2p6 3s2 3p5 , ou seja, trata-se do cloro.
⇒ Verifica-se, também, que os eletrões mais facilmente removíveis (aos que corresponde uma energia de remoção de 1,25 MJ/mol) são 5 eletrões (3p), existindo mais 2 eletrões com energia de remoção da mesma ordem de grandeza (2,44 MJ/mol) que pertencem ao mesmo nível, subnível 3s.
⇒ Assim, o valor 1,25 MJ/mol, a menor energia para remover 1 eletrão do átomo de cloro, é a sua primeira energia de ionização.
- Opção (D) ……………. 10 pontos
8. A Figura 10, que não está à escala, representa uma montagem laboratorial que inclui um espelho e um pentaprisma de vidro transparente.
Um feixe de luz laser, propagando-se inicialmente no ar, é refletido no espelho, entrando no pentaprisma perpendicularmente a uma das suas faces.
Na figura, representa-se ainda parte dos trajetos dos feixes resultantes das sucessivas reflexões e refrações nas faces do prisma.

- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
8.1. Quando o feixe de luz passa do ar para o pentaprisma,
(A) mantém-se a frequência, mas o módulo da velocidade de propagação diminui.
(B) diminui a frequência, mas o módulo da velocidade de propagação mantém-se.
(C) diminui a frequência e diminui o módulo da velocidade de propagação.
(D) mantém-se a frequência e mantém-se o módulo da velocidade de propagação.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (A)
⇒ A frequência de uma radiação monocromática não depende do meio de propagação, logo mantém-se constante quando muda de meio.
⇒ A velocidade de propagação do feixe de luz depende do meio de propagação.
⇒ Da figura 10, verifica-se que o feixe de luz se afasta da normal, ao passar do vidro para o ar, o que evidencia que o índice de refração do vidro é superior ao do ar.
⇒ Como n = c/v, a velocidade de propagação do feixe de luz no vidro é inferior à do ar.
- Opção (A) ……………. 10 pontos
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
8.2. A luz no interior do pentaprisma incide com um mesmo ângulo a em duas faces, refletindo-se tal como se representa na Figura 10.
Considere que o índice de refração do vidro que constitui o pentaprisma é 1,52.
Demonstre que, nestas condições, não ocorre reflexão total da luz no pentaprisma, apresentando todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
⇒ Como o ângulo de incidência é igual ao ângulo de reflexão e a soma dos ângulos internos de um triângulo é , verifica-se, por observação da figura 10, que:
- 90º + 4 α = 180º ⇒ α = 22,5º
⇒ De acordo com a Lei de Snell-Descartes, e sabendo que o ângulo-limite é o ângulo de incidência para o qual o ângulo de refração é igual a 90º, vem:
- nvidro sin αlim = nar sin 90º = 1 ⇔ sin αlim = 1/1,52 ⇒ αlim = 41,3º
⇒ Como o ângulo incidente (22,5º) é inferior ao ângulo-limite (41,3º), não ocorre reflexão total.
FIM






 2 NO2 (g) ΔH = 58,5 kJ
2 NO2 (g) ΔH = 58,5 kJ








