2022 – Época Especial – Prova Escrita de FQ A
Voltar a: Física e Química
- Prova Escrita de Física e Química A – versão 1
- Prova 715: Época especial – 2022
A prova inclui 16 itens, devidamente identificados no enunciado, cujas respostas contribuem obrigatoriamente para a classificação final.
Dos restantes 8 itens da prova, apenas contribuem para a classificação final os 4 itens cujas respostas obtenham melhor pontuação.
1. A água, H2O, é uma substância que apresenta propriedades físicas e químicas particulares.
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
1.1. A molécula de água apresenta, no total,
(A) oito eletrões, dos quais dois são não ligantes.
(B) oito eletrões, dos quais quatro são não ligantes.
(C) dez eletrões, dos quais dois são não ligantes.
(D) dez eletrões, dos quais quatro são não ligantes.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (D)
⇒ A molécula de água, H2O, apresenta, no total, dez eletrões (oito eletrões do átomo de oxigénio mais dois eletrões, um de cada um dos átomos de hidrogénio).
⇒ De acordo com a fórmula de estrutura da molécula de água, verifica-se que estes átomos se unem de acordo com a regra do octeto.
⇒ Como o átomo de oxigénio tem seis eletrões de valência e o átomo de hidrogénio tem um eletrão de valência, ocorre o compartilhamento de dois dupletos, estabelecendo duas ligações simples O-H, ficando assim o átomo de oxigénio rodeado por oito eletrões, como o átomo de néon, e os átomos de hidrogénio por dois eletrões, como o átomo de hélio.
⇒ Esta molécula apresenta, assim, quatro eletrões de valência ligantes e quatro eletrões de valência não ligantes.
- Opção (D) ……………. 10 pontos
- 11ºano – Química – Domínio 1 – subdomínio 1 (Aspetos quantitativos das reações químicas)
1.2. A água pode ser obtida a partir da reação entre o dioxigénio, O2 , e o di-hidrogénio, H2 .
Tal reação é traduzida por
O2 (g) + 2 H2 (g) → 2 H2O (g)
Num recipiente fechado, introduziram-se 6 mol de O2 e 10 mol de H2 .
Após reação completa,
(A) foram obtidas 16 mol de H2O (g).
(B) ficou por reagir 1 mol de O2 (g).
(C) foram consumidas 6 mol de H2 (g).
(D) ficaram por reagir 2 mol de H2 (g).
- Opção (B)
⇒ Cálculo do reagente limitante:

- o H2 é o reagente limitante.
⇒ Após a reação completa, o H2 será totalmente consumido (10 moles).
⇒ De acordo com a estequiometria da reação, 1 (H2) : 1 (H2O), após reação completa deveriam obter-se ) 10 mol de H2O.
⇒ Como a estequiometria da reação em relação aos reagentes é 1 (O2) : 2 (H2), o consumo de 10 moles de H2, reagente limitaste, deveriam consumir 5 mol de de O2, ficando por reagir 6 −5 = 1 mol de O2.
- Opção (B) ……………. 10 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
1.3. A água é uma substância que reage com ela própria, ainda que em pequena extensão.
A reação de autoionização da água é traduzida por
2 H2O (l) OH– (aq) + H3O+ (aq)
Na tabela seguinte, estão representados os valores do produto iónico da água, Kw , a diferentes temperaturas, θ, expressas em ºC.

Explique, com base na análise da tabela, como varia o pOH da água pura em função do aumento da temperatura.
Escreva um texto estruturado, utilizando linguagem científica adequada.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
⇒ De acordo com a tabela, Kw aumenta com o aumento da temperatura.
- Assim, aumentando a temperatura, o equilíbrio da reação de autoionização da água evolui no sentido direto, aumentando a [H3O+] e a [HO–].
pOH = – log [HO−]
⇒ O aumento da [HO−] conduz a uma diminuição do pOH.
- Conclusão: o pOH da água diminui por aumento de temperatura.
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
1.4. Quando se coloca uma determinada massa de água líquida num congelador, observa-se um aumento do volume da água durante a sua solidificação.
Comparativamente à água líquida, o gelo apresenta
(A) maior massa volúmica e ligações de hidrogénio mais intensas.
(B) maior massa volúmica e ligações de hidrogénio menos intensas.
(C) menor massa volúmica e ligações de hidrogénio mais intensas.
(D) menor massa volúmica e ligações de hidrogénio menos intensas.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (C)
⇒ A massa volúmica de uma substância, ρ, é a massa por unidade de volume dessa substância, isto é:
- ρ = m/V
⇒ Se, quando se congela uma determinada massa de água, se observa um aumento de volume, a sua massa volúmica diminui.
⇒ A menor densidade do gelo em relação à água é explicada pelo facto de, na solidificação da água líquida, cada molécula de água se ligar por 4 ligações de hidrogénio a 4 moléculas de água, resultando, daí, a formação de grandes anéis hexagonais com espaços vazios no seu interior.
- Opção (C) ……………. 10 pontos
2. Num certo local, foi construído um sistema de aquecimento de água de baixo custo, que funciona como a seguir se descreve.
O sistema é constituído por um coletor solar e por um reservatório, encontrando-se este numa posição mais elevada em relação àquele.
A água, que circula no coletor solar dentro de tubos, é aquecida pelo Sol e sobe, por convecção, ao reservatório.
A água mais fria do reservatório desce para o coletor. A repetição cíclica deste processo possibilita o aquecimento da água do reservatório.
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
2.1. Nos esquemas seguintes, as setas indicam o sentido da circulação da água.
Qual dos esquemas apresenta a forma mais eficiente de ligar o coletor solar ao reservatório, para aquecer a água do reservatório?

- Opção (B)
⇒ A água mais quente, acumulada na parte superior do coletor, solar deve ser ligada à parte superior do reservatório.
⇒ A água mais fria, contida na parte inferior do reservatório, deve ser ligada à parte inferior do coletor solar para ser aquecida pelo sol e subir, por convecção, ao reservatório, repetindo, assim, o processo de aquecimento.
- Opção (B) ……………. 10 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
2.2. O coletor solar foi construído com uma área de 2,5 m2, e o sistema coletor solar + reservatório foi cheio com 100 L de água.
Após 7,0 h de exposição solar, a temperatura da água subiu de 23 ºC para 41 ºC.
Admita que a irradiância solar média, no nível em que o coletor se encontra, é 600 W m-2 e que ρágua = 1,00 kg dm-3.
Considere desprezável o aquecimento do reservatório por exposição solar direta e a reflexão no coletor solar.
Calcule a energia dissipada neste processo de aquecimento.
Apresente todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a energia da radiação solar que incide no coletor em 7,0 h de exposição solar (E = 3,78 x 107 J) (ver nota) …….. 4 pontos
⇒ Calcula a energia que é absorvida pela água em 7,0 h de exposição solar (E = 7,52 x 106 J) (ver nota) ……… 3 pontos
⇒ Calcula a energia dissipada no processo de aquecimento considerado (E = 3,0 x 107 J) ……… 3 pontos
Nota:
- A ordem das três primeiras etapas é arbitrária.
3. Com vista a uma gestão energética económica e ambientalmente mais sustentável, a administração de uma rede de metropolitano adotou o procedimento seguinte no percurso entre cada duas estações:
– no primeiro quarto do tempo total do percurso, o comboio move-se com aceleração constante;
– de seguida, durante metade do tempo total, mantém uma velocidade constante;
– no último quarto do tempo total, reduz a sua velocidade uniformemente, até parar.
Considere uma trajetória retilínea e horizontal entre duas estações.
- 11ºano – Física – Domínio 1 – subdomínio 1 (Tempo, posição e velocidade)
3.1. Qual é o esboço do gráfico da posição em função do tempo que melhor corresponde ao movimento desse comboio entre duas estações?
Admita que o comboio pode ser representado pelo seu centro de massa (modelo da partícula material).

- Opção (C)
⇒ Como o comboio está sempre em movimento entre as duas estações, eliminam-se as opções (A) e (D), pois, nestes esboços, durante metade do tempo, a posição mantém-se.
⇒ No último quarto de tempo total, como reduz uniformemente a velocidade, o comboio tem movimento retilíneo uniformemente retardado, pelo que o declive das retas tangentes à curva em cada instante diminui, até se anular no final do percurso, quando atinge a velocidade nula.
- Opção (C) ……………. 10 pontos
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
3.2. Enquanto trabalha no interior de um túnel, um funcionário avista um comboio parado na estação, a 150 m de distância.
Por motivos de segurança, o funcionário imobiliza-se junto à parede do túnel, à espera que o comboio passe.
A Figura 1 representa o movimento do comboio desde que parte da estação até que inicia a sua passagem pelo funcionário com uma velocidade de 10 m s-1.

A Figura 2 representa o instante em que a última carruagem passa, na totalidade, pelo funcionário.
Considere que o comboio tem 80 m de comprimento e que se movimenta com aceleração constante.

Calcule o intervalo de tempo, Dt , desde a partida do comboio da estação até que a última carruagem passa pelo funcionário, como se representa na Figura 2.
Apresente todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
O comboio desloca-se com movimento retilíneo uniformemente acelerado.
Relativamente à primeira parte do percurso (até a frente do comboio passar pelo funcionário), a velocidade aumenta 0 m s-1 de até 10 m s-1.
⇒ Assim, recorrendo às leis deste movimento, tem-se:

⇒ Para o percurso total de 230 m, vem:

- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula o módulo da aceleração do comboio (0,333 m s-2) …….. 5 pontos
⇒ Calcula o intervalo de tempo, Δt (37 s) ……… 5 pontos
4. Uma das opções de mobilidade sustentável nas cidades passa pelo uso da bicicleta como meio de transporte.
Na Figura 3, que não está à escala, está representada uma ciclista que se desloca numa trajetória retilínea, numa ciclovia.
A ciclovia tem um troço horizontal, entre A e B, e um troço de inclinação constante, entre B e C.

O conjunto, de massa m, constituído pela ciclista e pela sua bicicleta não motorizada pode ser representado pelo seu centro de massa (modelo da partícula material).
- 10ºano – Química – Domínio 2 – subdomínio 3 (Transformações químicas)
4.1. Considere a roda traseira da bicicleta como um sistema fechado.
No troço de A a B, a roda cedeu ao exterior 12 J, como calor, tendo sido realizado sobre ela um trabalho de 22 J.
Qual foi a variação da energia interna da roda?
(A) + 34 J
(B) + 10 J
(C) – 10 J
(D) – 34 J
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (B)
⇒ De acordo com a 1.ª Lei da Termodinâmica:
- ΔU = Q + W
⇒ Por convenção, a energia recebida pelo sistema é positiva e a energia cedida é negativa.
- ΔU = – 12 + 22 = + 10 J
- Opção (B) ……………. 10 pontos
4.2. No planeamento das ciclovias, recomenda-se que sejam evitadas rampas com uma inclinação longitudinal superior a 5%.
Admita que uma inclinação de 5% significa que, por cada 100 m de pista inclinada percorrida, há um desnível de 5 m na vertical.
Com o objetivo de determinar a inclinação aproximada do troço entre B e C da ciclovia, foi realizada a seguinte experiência:
– quando a ciclista passou na posição B, observou que o velocímetro da bicicleta marcava 30 km h-1;
– quando iniciou a subida, na posição B, deixou de pedalar, percorrendo 40 m até parar na posição C.
Admita que, no trajeto de B a C, foi dissipada 30% da energia mecânica do conjunto ciclista + bicicleta e que as forças dissipativas se mantiveram constantes ao longo de todo o percurso.
Considere o troço horizontal da ciclovia como nível de referência da energia potencial gravítica.
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
4.2.1. Verifique se a inclinação da ciclovia cumpre a recomendação indicada.
Mostre como chegou à verificação solicitada, apresentando todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Elementos de resposta:
⇒ considera EmB = EcB e EmC = EpgC (ou equivalente);
⇒ considera EmC = 0,70 EmB ;
⇒ calcula a altura do ponto C em relação ao nível de referência (2,4 m);
⇒ verifica que a inclinação da ciclovia não cumpre a recomendação indicada (a inclinação da ciclovia é 6,1 %) (ou equivalente).

- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
4.2.2. Nos esquemas seguintes, está representado o conjunto ciclista + bicicleta durante a realização da experiência, numa posição entre B e C.
Em qual dos esquemas se encontram representados, embora não à escala, o vetor resultante das forças que atuam no conjunto, FR, e o vetor aceleração, a , durante a subida?

- Opção (D)
⇒ O conjunto sobe a rampa de B a C com movimento retilíneo uniformemente retardado, visto que para em C e, como as forças dissipativas são constantes, a resultante das forças que atuam no conjunto é constante.
- Consequentemente a aceleração é constante.
⇒ Assim, a resultante das forças que atuam sobre o conjunto e, consequentemente, a aceleração têm sentido contrário ao do movimento, isto é, de C para B.
- Opção (D) ……………. 10 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
4.2.3. Qual das opções seguintes pode representar os esboços dos gráficos da energia cinética, Ec , e da energia potencial gravítica, Epg , do conjunto ciclista + bicicleta + Terra, em função da altura, h, correspondentes ao trajeto de B a C?

- Opção (A)
⇒ De B a C, a energia cinética diminui e a energia potencial aumenta.
⇒ Como as forças dissipativas são constantes, a resultante das forças que atuam no conjunto durante a subida é constante.

- Dado que Fa, sin α e mg são constantes, então a Ec = f (h) é representada por uma reta de declive negativo.
- Opção (A) ……………. 10 pontos
- 11ºano – Física – Domínio 2 – subdomínio 2 (Eletromagnetismo)
4.2.4. A indução eletromagnética, que permite a produção de corrente elétrica em muitos dispositivos, foi descoberta por Michael Faraday.
Algumas bicicletas dispõem de faróis cujas lâmpadas estão ligadas a um dínamo, que pode ser semelhante ao representado na Figura 4.
Quando a roda da bicicleta está em movimento, o eixo do dínamo gira, provocando a rotação do íman, e a lâmpada acende-se.
Quando a roda está parada, a lâmpada não se acende.
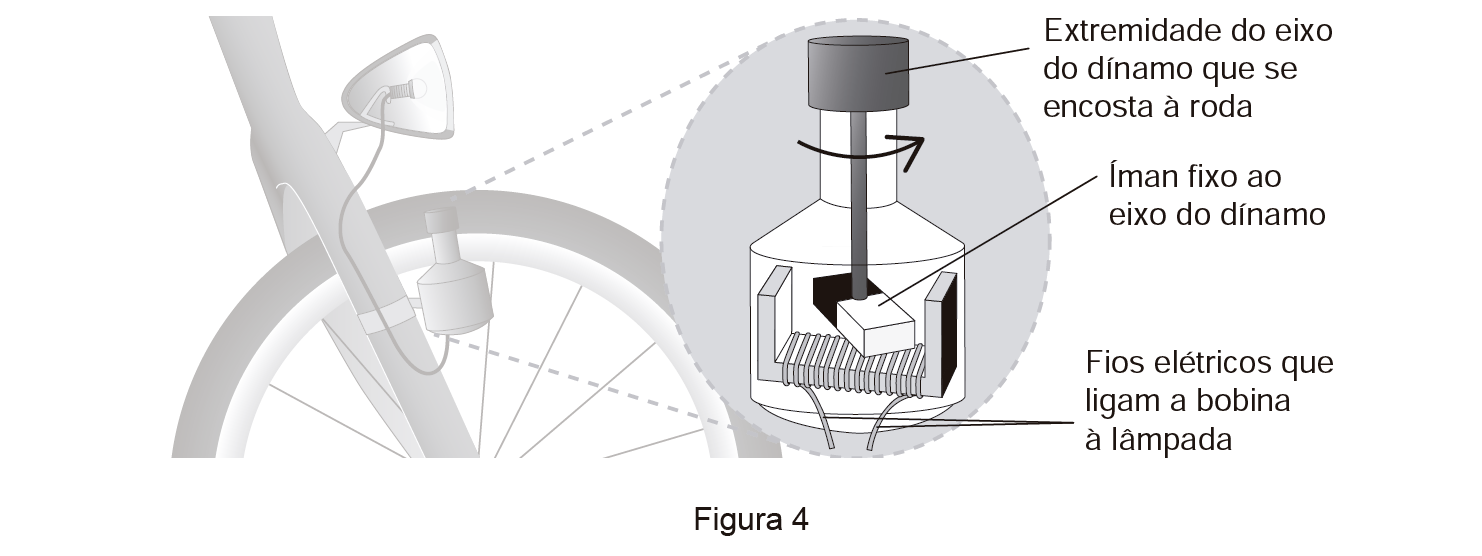
Explique, com base na lei de Faraday, a diminuição da corrente elétrica induzida no circuito (constituído por dínamo e lâmpada) à medida que a ciclista sobe a rampa, entre B e C, sem pedalar.
Escreva um texto estruturado, utilizando linguagem científica adequada.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
⇒ Com o movimento da roda da bicicleta, que se encontra encostada à extremidade do eixo do dínamo, ocorre a rotação do íman, o que provoca uma variação do fluxo magnético através da espira da bobina.
⇒ A variação do fluxo magnético gera uma corrente elétrica.
⇒ De acordo com a lei de Faraday,

a força eletromotriz induzida no circuito é, em módulo, igual à taxa de variação temporal do fluxo magnético que o atravessa.
⇒ À medida que a ciclista sobe a rampa, entre B e C, ocorre uma diminuição da velocidade da roda traseira da bicicleta, diminuindo, assim, a velocidade de rotação do íman ao longo da subida. Então, a variação temporal do fluxo magnético através das espiras é cada vez menor.
- Em conclusão, ao longo da subida há uma diminuição da força eletromotriz induzida e, consequentemente, uma diminuição da corrente elétrica no circuito.
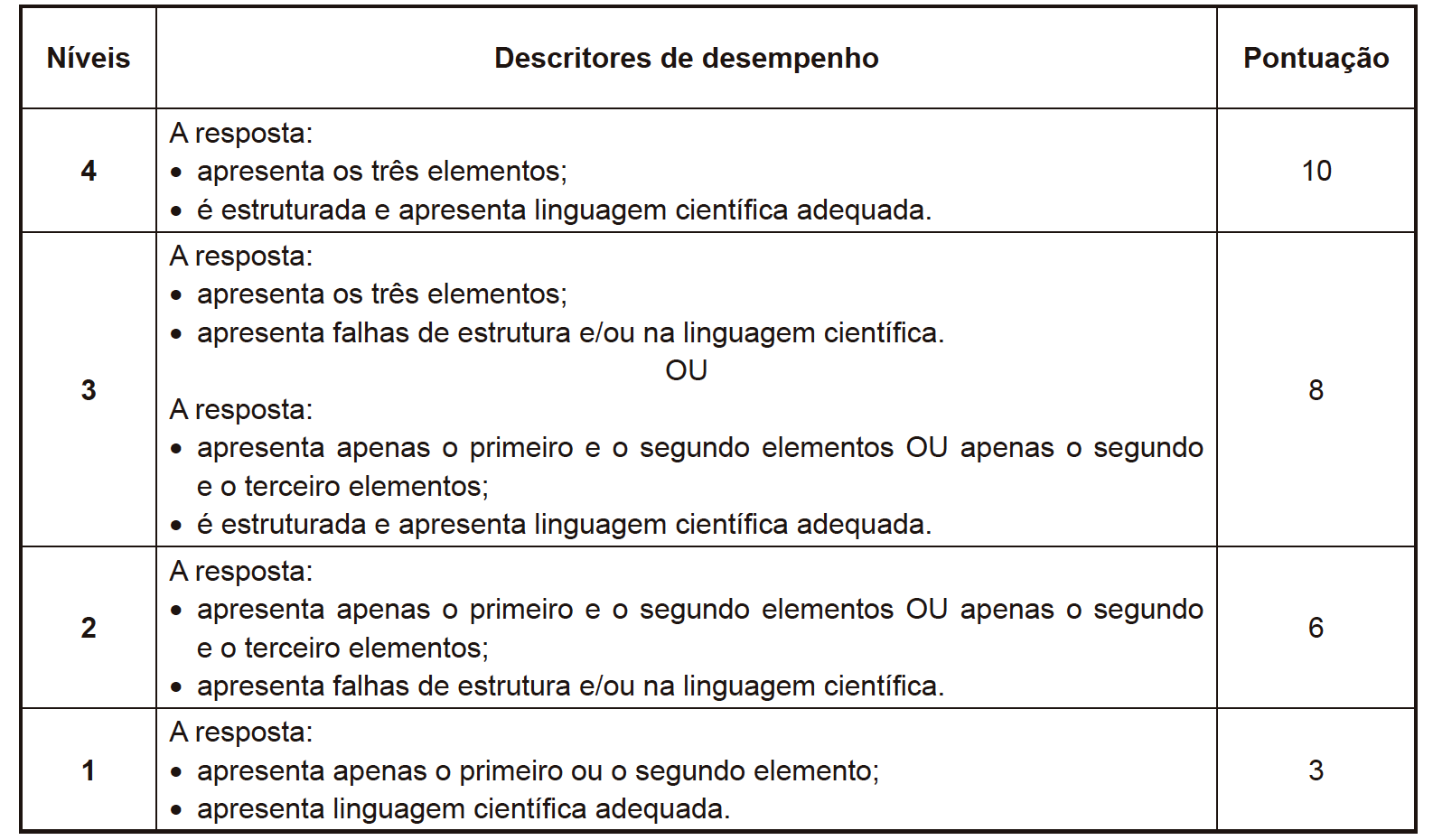
- Elementos de resposta:
⇒ refere que há diminuição da velocidade de rotação do íman ao longo da subida [com a diminuição da velocidade de rotação da roda traseira da bicicleta] (ou equivalente);
⇒ refere que, ao longo da subida, uma mesma variação do fluxo magnético através das espiras da bobina ocorre em intervalos de tempo cada vez maiores;
⇒ refere que, [de acordo com a lei de Faraday,] ao longo da subida, há uma diminuição da força eletromotriz induzida e, consequentemente, da corrente elétrica induzida no circuito.
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
4.3. As bicicletas têm uma corrente que liga uma roda dentada dianteira, D, movimentada pelos pedais, a uma roda dentada traseira, T, fixa à roda traseira, tal como se representa na Figura 5.

Considere uma rotação completa da roda dentada dianteira, D, em 1 s.
Mostre que, quanto maior for a razão dos raios das duas rodas dentadas, rD/rT, maior será a frequência de rotação da roda dentada traseira, T.
Comece por relacionar as velocidades lineares das rodas dentadas D e T.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Elementos de resposta:
⇒ considera que a velocidade linear das duas rodas dentadas é igual;
⇒ deduz a expressão que relaciona os raios com a frequência de rotação das rodas dentadas D e T (rT × f T = rD × fD);
⇒ mostra que, para fD = 1 s-1 , o aumento da razão dos raios rD/rT implica o aumento da frequência de rotação da roda dentada traseira, fT.

5. No âmbito da agricultura inteligente (ou smart farming), aposta-se na hidroponia, uma técnica de cultivo de espécies vegetais que não necessita de solo e em que se usam ferramentas tecnológicas.
Esta forma de cultivo mais sustentável pode ser implantada em meio urbano, permite economizar água e reforça a segurança alimentar.
5.1. No processo de fotossíntese, as plantas não necessitam de absorver radiação em todo o espectro da luz visível.
A clorofila a, nos cloroplastos das plantas, absorve fundamentalmente radiação com comprimentos de onda de 430 nm e de 660 nm.
Em hidroponia, utilizam-se circuitos com associações de vários LED, que emitem, cada um deles, radiação com um dos comprimentos de onda referidos anteriormente.
Na Figura 6, representam-se curvas características de dois tipos de LED, X e Y, que poderão ser utilizados em iluminação em estações hidropónicas.

- 10ºano – Física – subdomínio 2 (Energia e fenómenos elétricos)
5.1.1. Para testar a adequação de dois LED, 1 e 2, montou-se um circuito elétrico no qual estes foram associados em paralelo com uma pilha ideal (de resistência interna nula) de força eletromotriz 9,0 V.
O circuito elétrico inclui ainda um aparelho de medida (amperímetro) e duas resistências elétricas, R e outra, de 360 X, de acordo com a Figura 7.

Para preservar a longevidade e o bom funcionamento dos LED, a corrente elétrica que atravessa cada LED não pode exceder 20 mA.
Dada esta condição, para uma corrente elétrica de 40 mA, lida no amperímetro, o valor de R é
(A) 280 X, e o LED 2 corresponde ao LED Y da Figura 6.
(B) 225 X, e o LED 2 corresponde ao LED Y da Figura 6.
(C) 280 X, e o LED 2 corresponde ao LED X da Figura 6.
(D) 225 X, e o LED 2 corresponde ao LED X da Figura 6.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (A) ……………. 10 pontos
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
5.1.2. Para determinar o comprimento de onda da componente espectral de maior intensidade da radiação emitida por um LED, realizou-se uma atividade experimental de difração.
A montagem experimental está esquematizada na Figura 8.

Com uma rede de difração de 1000 linhas por mm, situada a uma dada distância, L, do LED ligado, observa-se um espectro, estando a cor da componente espectral de maior intensidade a uma dada distância, λ, do LED.
O comprimento de onda, λ, da componente espectral de maior intensidade pode ser obtido a partir da expressão
d sen θ = n λ
em que:
– n corresponde à ordem do máximo (o primeiro máximo visível tem n = 1);
– d representa a distância entre o centro de duas linhas consecutivas na rede de difração;
– θ representa o ângulo entre a direção perpendicular à rede de difração e a direção entre o observador e o primeiro máximo da componente espectral.
Num dos ensaios realizados, mediu-se uma distância L de 150 mm e obteve-se uma distância b de 72 mm.
Calcule o comprimento de onda da componente espectral de maior intensidade do LED.
Apresente todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula o ângulo θ (25,6º) (ver nota)
ou
- Calcula o seno do ângulo θ
(ver nota) …….. 4 pontos
⇒ Calcula a distância entre o centro de duas linhas consecutivas na rede de difração, d (1,00 x 10-6 m) (ver nota) ……… 2 pontos
⇒ Calcula o comprimento de onda do LED (4,3 x 10-7 m) ……… 4 pontos
Notas:
- A ordem das três primeiras etapas é arbitrária.
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
5.2. Nesta técnica, utilizam-se estações hidropónicas constituídas por várias unidades.
Uma determinada unidade hidropónica beneficia de um enriquecimento do ar em dióxido de carbono, CO2 , para valores de 800 ppm (em volume). A percentagem de referência de CO2 no ar é 0,038% (em volume).
Admita que o volume de ar da unidade hidropónica é 3,0 dm3 e que, nas condições de pressão e temperatura desta unidade, o volume molar é 24,0 dm3 mol-1.
Calcule o aumento da quantidade de CO2 , na unidade hidropónica, caso se proceda ao referido enriquecimento do ar em CO2 , nas condições de pressão e temperatura indicadas.
Apresente todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- 1.º Processo
Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula o volume de CO2 nas condições de referência (3,80 x 10-4 dm3 em 1 dm3 de ar OU 1,14 x 10-3 dm3 em 3 dm3 de ar) (ver nota 1) …….. 3 pontos
⇒ Calcula a quantidade de CO2 no ar enriquecido (8,00 x 10-4 dm3 em 1 dm3 de ar OU 2,40 x 10-3 dm3 em 3 dm3 de ar) (ver nota 1) …….. 3 pontos
⇒ Calcula o aumento da quantidade de CO2 (5,3 x 10-5 mol) (ver nota 2) ……… 4 pontos
- 2.º Processo
Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Calcula a quantidade de CO2 nas condições de referência (1,58 x 10-5 mol em 1 dm3 de ar OU 4,75 x 10-5 mol em 3 dm3 de ar) (ver notas 1 e 2) …….. 3 pontos
⇒ Calcula a quantidade de CO2 no ar enriquecido (3,33 x 10-5 mol em 1 dm3 de ar OU 1,00 x 10-4 mol em 3 dm3 de ar) (ver notas 1 e 2) …….. 3 pontos
⇒ Calcula o aumento da quantidade de CO2 (5,3 x 10-5 mol) (ver nota 2) ……… 4 pontos
Notas:
1. A ordem das duas primeiras etapas é arbitrária.
2. No caso de ser utilizado um volume molar em condições PTN, considera-se um erro de tipo 2.
- 11ºano – Química – Domínio 2 – subdomínio 3 (Soluções e equilíbrio de solubilidade)
5.3. Durante o período de crescimento das espécies vegetais utiliza-se o ião potássio em soluções aquosas.
Para preparar uma solução aquosa de sulfato de potássio, K2SO4 (aq), diluída, adicionaram-se iguais volumes de água dura, com uma concentração de Ca2+ de 0,010 mol dm-3, e de uma solução de K2SO4 (aq) previamente preparada.
Após a mistura, a concentração de SO42- (aq) na solução diluída é 9,00 x 10-3 mol dm-3.
Admita que, à temperatura a que se realizou a diluição, o produto de solubilidade, Ks , do sulfato de cálcio, CaSO4 , é 7,1 x 10-5 e que são desprezáveis as contribuições dos iões K+ e SO42- provenientes da água dura.
Na solução diluída, a concentração do ião potássio, K+, é
(A) 1,80 x 10-2 mol dm-3 , e há formação de precipitado, CaSO4 (s).
(B) 1,80 x 10-2 mol dm-3 , e não há formação de precipitado, CaSO4 (s).
(C) 9,00 x 10-3 mol dm-3 , e há formação de precipitado, CaSO4 (s).
(D) 9,00 x 10-3 mol dm-3 , e não há formação de precipitado, CaSO4 (s).
- Opção (B)
⇒ A reação de precipitação de CaSO3 (s) pode ser representada pela equação:
Ca2+ (aq) + SO42- (aq) CaSO4 (g)
Depois de misturar volumes iguais das duas soluções, a concentração do ião Ca2+ (aq) proveniente da água dura reduz-se a metade, porque o volume total da solução duplicou.
- [Ca2+] = 0,0050 mol dm-3
⇒ O valor do produto iónico é:
- Qr = [Ca2+] x [SO42-] = 0,0050 x 9,00 x 10-3 = 4,50 x 10-5
Como Qr < Ks, não há formação de precipitado.
Como não ocorreu precipitado:
- K2SO4 (aq) → 2 K+ (aq) + SO42- (aq) ,
⇒ A concentração do ião potássio, K+ (aq), na solução diluída, é:
- [K+ (aq)] = 2 x [K2SO4 (aq)] = 2 x 9,00 x 10-3 = 1,80 x 10-2 mol dm-3
- Opção (B) ……………. 10 pontos
6. Considere um sistema gasoso fechado em que as espécies A, B e C são intervenientes numa reação química e x, y e z correspondem aos seus coeficientes estequiométricos.
Esta reação pode ser traduzida por
z C (g) x A (g) + y B (g)
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
6.1. A Figura 9 apresenta o gráfico que traduz a evolução, ao longo do tempo, da quantidade de cada uma das espécies, A, B e C, até ser atingido o estado de equilíbrio, à temperatura T.

De acordo com a Figura 9, os coeficientes estequiométricos x, y e z são, respetivamente,
(A) 2, 3 e 1.
(B) 2, 1 e 3.
(C) 3, 2 e 1.
(D) 3, 1 e 2.
- Opção (D)
z C (g) x A (g) + y B (g)
⇒ De acordo com a figura 9, verifica-se que a variação das quantidades relativas das espécies A, B e C, desde o início da reação até à situação de equilíbrio são, respetivamente, 6 mol: 2 mol: 4 mol, o que corresponde a uma proporção de 3:1:2.
Conclui-se, assim, que:
- x = 3
- y = 1
- z = 2
- Opção (D) ……………. 10 pontos
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
6.2. Para estudar o efeito da utilização de um catalisador na reação, introduziu-se a mesma quantidade da espécie C em dois reatores iguais, nas mesmas condições de pressão e temperatura.
A um dos reatores, adicionou-se ainda o catalisador.
Considere que a temperatura, T, se manteve constante nos dois reatores.
No reator ao qual se adicionou o catalisador, aumentou
(A) a extensão da reação.
(B) a constante de equilíbrio, Kc , à temperatura T.
(C) a velocidade da reação.
(D) a percentagem de A e B na mistura reacional de equilíbrio.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (C)
⇒ Como a temperatura, T, se mantém constante nos dois reatores, a constante de equilíbrio da reação mantém-se.
⇒ A constante de equilíbrio de uma reação determina a sua extensão. Assim, como a constante de equilíbrio se mantém, a sua extensão é a mesma.
- Os catalisadores não afetam a extensão das reações. Diminuem o tempo necessário para se atingir o equilíbrio químico, isto é, aumentam a velocidade da reação.
- Opção (C) ……………. 10 pontos
7. Num laboratório, um grupo de alunos pretende titular, com rigor, uma solução aquosa de hidróxido de sódio, NaOH (aq), utilizando uma solução-padrão de ácido clorídrico, HCl (aq), de concentração 0,280 mol dm-3.
A reação que ocorre pode ser traduzida por
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l)
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
7.1. Uma solução aquosa de 80,0 ml de NaOH (M = 40,00 g mol-1) foi preparada a partir de uma amostra impura do reagente sólido, da qual se gastou 1,20 g.
Retiraram-se 20,0 ml dessa solução e titulou-se esta quantidade de solução com a solução-padrão de HCl, tendo-se obtido a curva de titulação representada na Figura 10.
Admita que as impurezas são inertes.

Calcule a massa de impurezas na amostra inicial de NaOH.
Apresente todos os cálculos efetuados.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
⇒ A partir do gráfico representado na figura 10, lê-se que o volume de titulante gasto até atingir o ponto de equivalência (p.e.) é 25,0 ml.
Assim, a quantidade de titulante, HCl, gasto até atingir o p.e. é:
- n (HCl) = V (HCl) x c (HCl) = 25,0 x 10-3 x 0,280 = 7,00 x 10-3 mol
⇒ De acordo com a estequiometria da reação traduzida pela equação da titulação referida, a proporção estequiométrica entre os reagentes é de 1:1.
⇒ Sabendo que, no ponto de equivalência, a quantidade de titulante adicionada e a quantidade de titulado inicial estão em proporção estequiométrica, a quantidade de NaOH que reage até atingir o ponto de equivalência, contida em 20,0 ml de solução, será 7,00 x 10-3 mol.
⇒ Em 80,0 ml, a quantidade de NaOH puro:
- nNaOH = 4 x 7,00 x 10-3 = 2,80 x 10-2 mol
⇒ A massa de NaOH puro existente em 80,0 ml de solução é:
- m = n x M = 2,80 x 10-2 x 40,00 = 1,12 g
⇒ A massa de impurezas :
- mimpurezas = 1,20 – 1,12 = 0,08 g
- Determina o valor solicitado, percorrendo as etapas seguintes:
⇒ Lê, no gráfico, o volume de titulante gasto no ponto de equivalência ( 25 ml ) …….. 2 pontos
⇒ Calcula a quantidade de NaOH que reage até se atingir o ponto de equivalência ( 7,00 x 10-3 mol ) …….. 3 pontos
⇒ Calcula a quantidade de NaOH puro que existe em 80 ml de solução (0,0280 mol) ……… 2 pontos
⇒ Calcula a massa de impurezas (0,08 g) ……… 3 pontos
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
7.2. O sal cloreto de sódio é constituído pelos iões sódio, Na+, e cloreto, Cl–.
Os iões Na+ e Cl–, no estado fundamental,
(A) apresentam, ambos, sete eletrões de valência.
(B) têm configurações eletrónicas iguais.
(C) apresentam, ambos, cinco orbitais ocupadas.
(D) têm igual número de orbitais de valência.
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (D)
- 11Na+ ⇒ 1s2 2s2 2p6
- 17Cl– ⇒ 1s2 2s2 2p6 3s2 3p6
De acordo com a configuração eletrónica destas partículas, no estado fundamental, verifica-se que:
⇒ ambas apresentam oito eletrões de valência, (dois eletrões numa orbital s e seis eletrões em orbitais p).
⇒ têm configurações eletrónicas diferentes.
⇒ apresentam, ambas, quatro orbitais de valência, (ns, npx, npy e npz).
- Opção (D) ……………. 10 pontos
7.3. O sódio e o cloro situam-se no mesmo período da tabela periódica.
- 10ºano – Química – Domínio 1 – subdomínio 3 (Tabela periódica)
7.3.1. No estado fundamental, o átomo de sódio tem raio atómico e energia de ionização do que o átomo de cloro.
(A) maior … maior
(B) menor … maior
(C) menor … menor
(D) maior … menor
A pontuação obtida na resposta contribui obrigatoriamente para a classificação final da prova.
- Opção (D)
O sódio e o cloro pertencem ao mesmo período da Tabela Periódica e aos grupos 1 e 17, respetivamente.
⇒ Como o raio atómico diminui genericamente da esquerda para a direita ao longo de um período, r (Na) > r (Cl)
⇒ A energia de ionização aumenta, genericamente, ao longo de um período. Logo, Ei (Na) < Ei (Cl).
- Opção (D) ……………. 10 pontos
- 10ºano – Química – Domínio 1 – subdomínio 1 (Massa e tamanho dos átomos)
7.3.2. O elemento cloro apresenta dois isótopos estáveis, o cloro-35 (35Cl) e o cloro-37 (37Cl), de massas isotópicas relativas 34,97 e 36,97, respetivamente.
O isótopo cloro-35 é
(A) mais abundante e tem menos dois neutrões do que o cloro-37.
(B) mais abundante e tem menos dois protões do que o cloro-37.
(C) menos abundante e tem menos dois neutrões do que o cloro-37.
(D) menos abundante e tem menos dois protões do que o cloro-37.
- Opção (A)
Como os isótopos são átomos com o mesmo número atómico, Z, mas diferente número de massa, A, diferem somente no número de neutrões.
- cloro-35 ⇒ 17 protões, 17 eletrões e neutrões
- cloro-37 ⇒ 17 protões, 17 eletrões e neutrões
O cloro tem menos 2 neutrões do que o cloro 37
Como a massa atómica relativa de um elemento é a média ponderada das massas isotópicas relativas dos isótopos naturais desse elemento, isto é, uma média que tem em conta a abundância relativa dos isótopos (Xi), e como o cloro só apresenta dois isótopos naturais.
- Ar (Cl) = X35 x 34,97 + X37 x 36,97
Como o valor da massa atómica relativa do cloro, Ar (Cl) = 35,45 , é mais próximo do valor da massa do isótopo 35Cl, podemos deduzir que a abundância relativa do isótopo 35Cl superior do isótopo 37Cl.
- Opção (A) ……………. 10 pontos
FIM


 OH– (aq) + H3O+ (aq)
OH– (aq) + H3O+ (aq)













Na primeira questão não deveria ser 10 eletrões de valência? Os 6 do oxigénio mais os 2 dos hidrogénios? Porquê 10?
Olá Mariana, na pergunta não fala em eletrões de valência, mas em eletrões.