2018 – 2ª Fase – Prova Escrita de FQ A
Voltar a: Física e Química
- Prova Escrita de Física e Química A – versão 1
- Prova 715: 2.ª Fase – 2018
GRUPO I
1. Uma bola é lançada verticalmente para cima, numa situação em que a resistência do ar é desprezável.
Considere que a bola pode ser representada pelo seu centro de massa (modelo da partícula material).
Em relação a um referencial unidimensional, Oy, com origem no solo e sentido positivo de baixo para cima, a componente escalar da posição, y, da bola é descrita pela equação
y = 1,20 + 6,0t − 5,0t2 (SI)
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
1.1. Qual das opções pode representar a aceleração, a , da bola e a resultante das forças, FR , que nela atuam durante a subida?
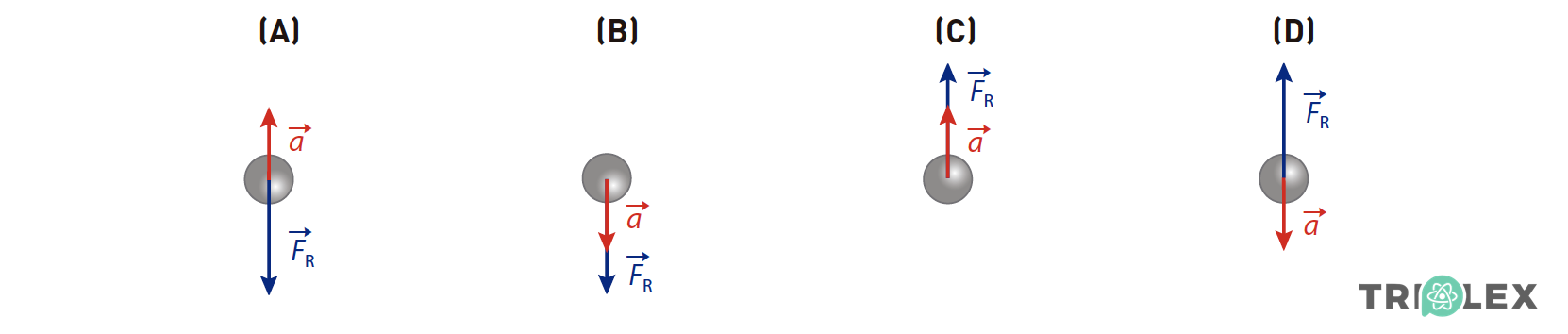
- Opção (B)
⇒ De acordo com a expressão dada, a bola move-se, inicialmente, com um movimento retardado: parte da posição 1,20 m, com velocidade inicial apontando para cima (a componente escalar da velocidade inicial, em relação a Oy, 6,0 m/s, é positiva ) e com aceleração apontando para baixo ( a componente escalar da aceleração, em relação a Oy, -10,0 m/s2 , é negativa); na subida, a velocidade tem sentido oposto ao da aceleração, e portanto a velocidade diminui.
⇒ A resultante das forças aplicadas num objeto, dada por Fr = ma, é sempre colinear com a aceleração e tem o mesmo sentido. Deste modo, também, aponta para baixo (neste caso é a força gravítica).
- Opção (B) ……………. 6 pontos
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
1.2. Calcule a distância percorrida pela bola desde que é lançada até atingir a posição de altura máxima.
Recorra exclusivamente às equações do movimento, y(t) e v(t).
Apresente todas as etapas de resolução.
⇒ Quando a altura da bola é máxima, v = 0 m s-1
- v = vo + a t ⇒ v = 6,0 – 10 t (SI) ⇔ 0 = 6,0 – 10 t ⇔ t = 0,60 s
- y = 1,20 + 6,0 (0,6) – 5 (0,6)2 ⇔ y=3,0 m
⇒ d = 3,0 – 1,20 = 1,8 m
ou
A expressão dada tem a forma y(t) = yo + vot + ½ at2 , ou seja , a equação do movimento retilíneo com aceleração constante ( movimento uniformemente variado). Para este tipo de movimento, a componente escalar da velocidade do objeto é dada por v(t) = v0 + a t.
Deste modo, o tempo, ts, que decorre até a bola parar é:
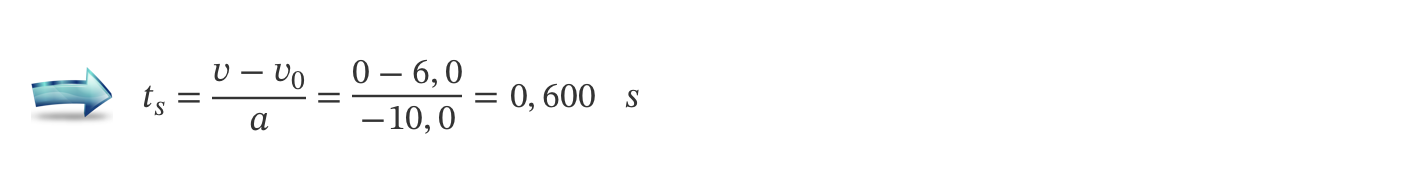
⇒ A componente escalar da posição em que a bola se encontra nesse momento é:
- y(t) = yo + vot + ½ at2 = 1,20 + 6,0 (0,6) – 5 (0,6)2 ⇔ y=3,0 m
⇒ A distância percorrida pela bola é o módulo da diferença entre as componentes escalares das posições final e inicial, ou seja:
- Δy = y – yo = (3 ,00 – 1,20) m = 1,8 m
- Etapas de resolução:
⇒ Cálculo do instante em que a bola atinge a posição de altura máxima (t = 0,600 s) …….. 5 pontos
⇒ Cálculo da distância percorrida pela bola até atingir a posição de altura máxima (d = 1,8 m) …….. 5 pontos
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
2. Uma bola, de massa 58,0 g , atada a uma corda, descreve trajetórias circulares, de raio 22 cm, num plano horizontal. Verifica-se que a bola descreve 20 voltas completas em 8,1 s , com velocidade de módulo constante.
Considere que a bola pode ser representada pelo seu centro de massa (modelo da partícula material).
Determine a intensidade da resultante das forças que atuam na bola, no movimento considerado.
Apresente todas as etapas de resolução.
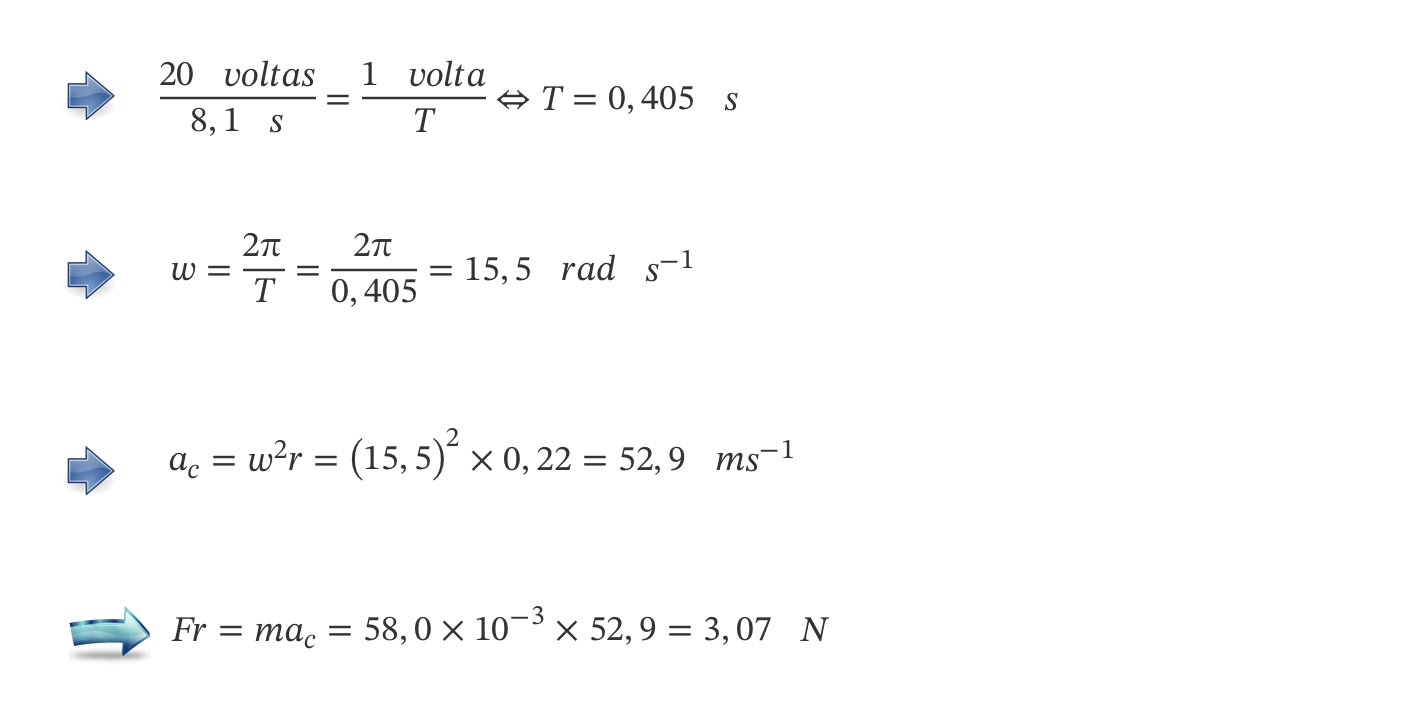
ou
A distância que a bola percorre durante os 8,1 s é igual a 20 perímetros de um círculo de raio 22 cm, ou seja :
- s = 20 x 2 π x 22 = 2,76 x 103 cm
Como o módulo da velocidade da bola é constante, este é dado por

Calcular movimento circular uniforme a aceleração é centrípeta:

O módulo da força centrípeta é dado pela Segunda Lei de Newton:
- Fr = m a = 0,058 x 52,9 = 3,1 N
- Etapas de resolução:
⇒ Cálculo do módulo da velocidade da bola (v = 3,41 ms-1)
ou
- Cálculo do módulo da velocidade angular da bola (w = 15,5 rad s-1) …….. 4 pontos
⇒ Cálculo do módulo da aceleração da bola (a = 52,9 ms-2) …….. 3 pontos
⇒ Cálculo da intensidade da resultante das forças que atuam na bola (F = 3,1 N) …….. 3 pontos
GRUPO II
Numa aula laboratorial, estudou-se o movimento vertical de queda e de ressalto de diversas bolas, em condições em que a resistência do ar pode ser considerada desprezável.
Na atividade realizada, utilizou-se um sensor de posição ligado a um sistema de aquisição automática de dados. Em cada ensaio realizado, abandonou-se uma das bolas de uma posição situada sob o sensor, como representado na Figura 1 (que não está à escala).
Considere o solo como nível de referência da energia potencial gravítica.
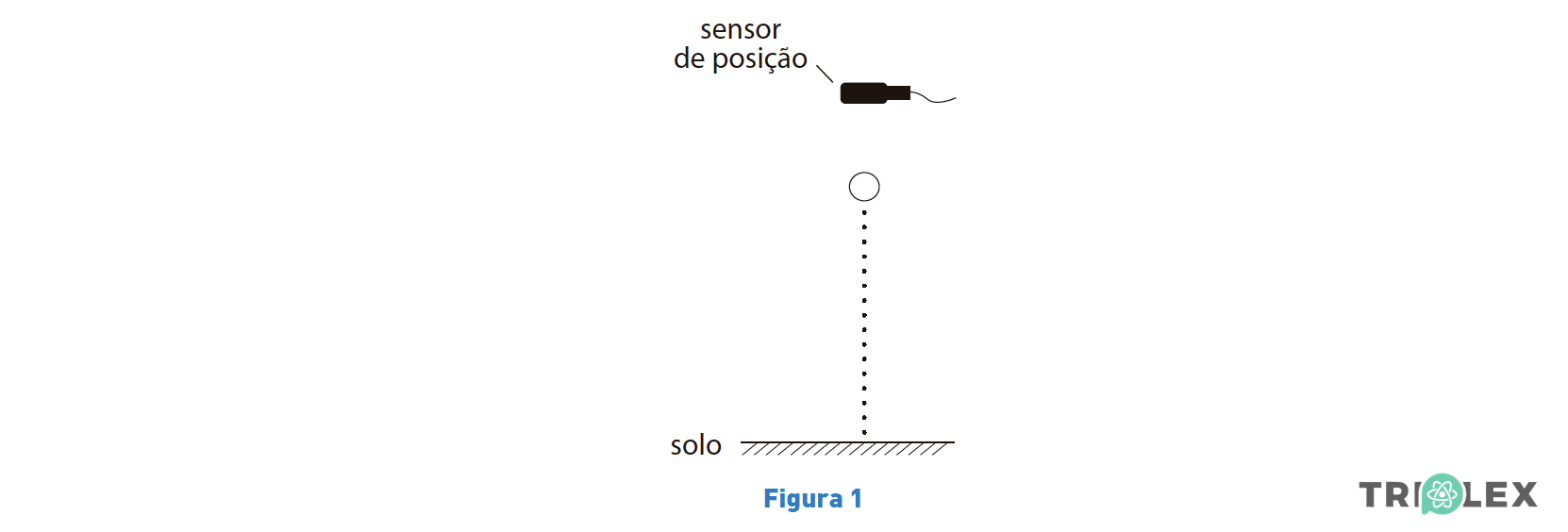
A Figura 2 apresenta o gráfico da distância de uma das bolas ao sensor, em função do tempo, obtido num dos ensaios realizados.

- 10ºano – Física – subdomínio 1 (Energia e movimentos)
- 10ºano – Física – A.l. – 1.2 – Movimento vertical de queda e ressalto de uma bola
1. Qual foi a distância percorrida pela bola desde a posição em que foi abandonada, sob o sensor, até colidir pela primeira vez com o solo?
(A) 1,10 m
(B) 0,20 m
(C) 1,30 m
(D) 0,34 m
- Opção (A)
⇒ O sensor mede a distância entre ele e a bola.
⇒ No instante t = 0 s a bola encontra-se a 0,20 m do detetor.
⇒ Quando é largada, a bola afasta-se do detetor até embater no solo.
⇒ Após a colisão, a bola inverte o sentido do movimento, e volta a aproximar-se do detetor.
⇒ O gráfico mostra 3 embates no solo, todos ocorrendo a uma distância de 1,30 m do detetor.
⇒ A distância percorrida pela bola desde a posição em que foi abandonada até à primeira colisão com o solo é (1,30 – 0,20) m = 1,10 m
- Opção (A) ……………. 6 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
- 10ºano – Física – A.l. – 1.2 – Movimento vertical de queda e ressalto de uma bola
2. No segundo ressalto, em que instante a energia potencial gravítica do sistema bola + Terra é máxima?
⇒ No segundo ressalto , a energia potencial gravítica do sistema bola + Terra é máxima no instante 1,67 s.
⇒ Os maiores valores da energia potencial gravítica do sistema ocorrem quando a bola está mais afastada do solo, portanto, mais perto do detetor (mínimos locais do gráfico da distância em função do tempo).
⇒ Após a segunda colisão com o solo, a bola atinge a altura máxima no instante t = 1,67 s, tendo subido até ficar a 0,78 m do detetor.
- Nessa posição encontra-se a uma distância do solo de (1 ,30 – 0,78) m = 0,52 m.
- 1,68 s …….. 6 pontos
Nota – Aceita-se qualquer valor no intervalo [1,65; 1,70] s.
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
- 10ºano – Física – A.l. – 1.2 – Movimento vertical de queda e ressalto de uma bola
3. No terceiro ressalto, a bola terá atingido uma altura máxima de 0,37 m.
Qual terá sido o módulo da velocidade com que a bola abandonou o solo, nesse ressalto?
(A) 2,7 m s-1
(B) 1,9 m s-1
(C) 1,4 m s-1
(D) 3,8 m s-1
- Opção (A)
⇒ Durante o movimento de subida só atua a força gravítica (força conservativa), logo, nesse movimento, verifica-se conservação da energia mecânica.

ou
⇒ Desde o ressalto no solo até à posição de altura máxima, o movimento da bola é uniformemente retardado. Para este movimento, pode-se calcular a velocidade inicial, vo, sabendo que

- Opção (A) ……………. 6 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
- 10ºano – Física – A.l. – 1.2 – Movimento vertical de queda e ressalto de uma bola
4. Explique, com base em considerações energéticas, porque é que a altura máxima atingida pela bola nos sucessivos ressaltos é cada vez menor.
Apresente, num texto estruturado e com linguagem científica adequada, a explicação solicitada.
(A) A energia mecânica do sistema bola + Terra diminui em cada uma das sucessivas colisões da bola com o solo.
(B) Na posição de altura máxima atingida pela bola em cada um dos sucessivos ressaltos, a energia mecânica do sistema bola + Terra é igual à energia potencial gravítica do sistema, uma vez que, nessa posição, a energia cinética da bola é nula.
(C) Conclui-se que, nos sucessivos ressaltos, a energia potencial gravítica do sistema nas posições de altura máxima atingidas pela bola é cada vez menor, pelo que a altura máxima atingida pela bola nos sucessivos ressaltos é também cada vez menor.
ou
(A) Em cada uma das colisões da bola com o solo , a energia cinética com que a bola sai do solo é inferior a energia cinética com que a bola chega ao solo.
(B) Em cada um dos sucessivos ressaltos, a energia cinética com que a bola sai do solo é igual a energia potencial gravítica do sistema bola + Terra na posição de altura máxima atingida pela bola, uma vez que, nessa posição, a energia cinética da bola é nula .
(C) Conclui-se que, nos sucessivos ressaltos, a energia potencial gravítica do sistema nas posições de altura máxima atingidas pela bola é cada vez menor, pelo que a altura máxima atingida pela bola nos sucessivos ressaltos é também cada vez menor .
- Tópicos de resposta:
A) A energia mecânica do sistema bola + Terra diminui em cada uma das sucessivas colisões da bola com o solo.
B) Na posição de altura máxima atingida pela bola em cada um dos sucessivos ressaltos,a energia mecânica do sistema bola + Terra é igual à energia potencial gravítica do sistema, uma vez que, nessa posição, a energia cinética da bola é nula.
C) Conclui-se que, nos sucessivos ressaltos, a energia potencial gravítica do sistema nas posições de altura máxima atingidas pela bola é cada vez menor, pelo que a altura máxima atingida pela bola nos sucessivos ressaltos é também cada vez menor.
ou
A) Em cada uma das colisões da bola com o solo, a energia cinética com que a bola sai do solo é inferior à energia cinética com que a bola chega ao solo.
B) Em cada um dos sucessivos ressaltos, a energia cinética com que a bola sai do solo é igual à energia potencial gravítica do sistema bola + Terra na posição de altura máxima atingida pela bola, uma vez que, nessa posição, a energia cinética da bola é nula.
C) Conclui-se que, nos sucessivos ressaltos, a energia potencial gravítica do sistema nas posições de altura máxima atingidas pela bola é cada vez menor, pelo que a altura máxima atingida pela bola nos sucessivos ressaltos é também cada vez menor.

GRUPO III
1. Na Figura 3, está representado o gráfico da variação da temperatura, Δθ, de uma amostra pura de 500 g de ferro, em função da energia, E, que seria necessário fornecer a essa amostra se o processo de aquecimento tivesse um rendimento de 100%.

- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
1.1. Quando aquela amostra foi aquecida por uma fonte de potência 40 W, durante 1,6 minutos, a sua temperatura aumentou 10,0 ºC.
Qual foi o rendimento deste processo de aquecimento?
(A) 71%
(B) 42%
(C) 58%
(D) 29%
- Opção (C) ……………. 6 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
1.2. Um recipiente contém 1,50 kg de água, à temperatura de 20,0 ºC. Uma esfera de ferro, de massa 850 g e inicialmente à temperatura de 70,0 ºC, é introduzida na água.
Determine a temperatura de equilíbrio do sistema água + esfera, admitindo que o sistema é isolado.
Apresente todas as etapas de resolução.
Determinação cFe:

Determinação θequilibrio:
Se o sistema água + ferro estiver isolado, então a energia cedida pela esfera de ferro será totalmente utilizada no aquecimento da água. A energia cedida, sob a forma de calor, pelo ferro é transferida para a água.
Por outras palavras, a esfera de ferro tem uma variação de energia – Q e a água uma variação de energia Q, dada por:

- Etapas de resolução:
⇒ Cálculo da capacidade térmica mássica do ferro (c = 449,2 J kg-1 ºC-1)
ou
- Cálculo da capacidade térmica da esfera de ferro (C = 381,8 J ºC-1) …….. 5 pontos
⇒ Cálculo da temperatura de equilíbrio do sistema água + esfera (θ = 22,9 ºC) …….. 5 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
2. A energia necessária à fusão de 1,0 kg de ferro, inicialmente à temperatura de fusão, é 2,47 x 102 kJ.
Que energia mínima, em joule, tem de ser absorvida por 500 g de ferro, à temperatura de fusão, para que o ferro se funda completamente?

- Opção (C) ……………. 6 pontos
GRUPO IV
1. Uma bobina encontra-se imóvel numa zona do espaço onde existe um campo magnético uniforme.
Os planos das espiras da bobina são paralelos entre si e fazem sempre o mesmo ângulo com a direção do campo magnético.
- 11ºano – Física – Domínio 2 – subdomínio 2 (Eletromagnetismo)
1.1. Qual deverá ser a amplitude do ângulo entre os planos das espiras e a direção do campo, para que, mantendo-se todas as outras condições, o módulo do fluxo magnético através da bobina seja máximo?
⇒ Para maximizar o módulo do fluxo magnético , a amplitude do ângulo entre os planos das espiras e a direção do campo é 90°.
⇒ O fluxo magnético é igual ao produto do módulo do campo magnético pela área de cada espira, pelo número de espiras e pelo cosseno do ângulo entre o campo magnético e um vetor normal aos planos das espiras.
⇒ O valor do módulo do fluxo magnético é maximizado quando o cosseno do ângulo é igual a 1 ou a -1 o que acontece quando esse ângulo é 0° ou 180º, ou seja, quando o campo é paralelo à normal aos planos das espiras, logo, perpendicular aos planos das espiras.
- 90º (ou equivalente) …………. 6 pontos
Nota – A ausência de unidade não implica qualquer desvalorização.
- 11ºano – Física – Domínio 2 – subdomínio 2 (Eletromagnetismo)
1.2. Num dado intervalo de tempo, a intensidade do campo magnético, B, varia com o tempo, t, de acordo com o esboço de gráfico representado na Figura 4.

Qual é o esboço de gráfico que pode representar o módulo do fluxo magnético, Um , que atravessa a bobina, em função do tempo, t, no intervalo de tempo [0, t1]?

- Opção (D)
- Φm = B A cos α
⇒ Sabendo que A cos α é constante, conclui-se que o fluxo magnético é diretamente proporcional à intensidade do campo magnético.
- Opção (D) ……………. 6 pontos
2. Duas bobinas, I e II, ligadas a osciloscópios, rodam em zonas do espaço distintas, nas quais existem campos magnéticos constantes e uniformes.
A análise dos sinais obtidos nos ecrãs dos osciloscópios permitiu estabelecer que as forças eletromotrizes, UI e UII , geradas nos terminais das bobinas I e II, respetivamente, variam com o tempo, t , de acordo com as expressões
UI = 7,5 x 10-2 sin (20π t) (SI)
UII = 1,5 x 10-3 sin (20π t) (SI)
- 11ºano – Física – Domínio 2 – subdomínio 2 (Eletromagnetismo)
2.1. Comparando as forças eletromotrizes, UI e UII , geradas nos terminais das bobinas I e II, respetivamente, é possível concluir que
(A) a área de cada espira da bobina I é diferente da área de cada espira da bobina II.
(B) o número de espiras da bobina I é diferente do número de espiras da bobina II.
(C) as bobinas estão sujeitas a campos magnéticos da mesma intensidade.
(D) as bobinas estão a rodar com velocidades angulares do mesmo módulo.
- Opção (D)
⇒ As duas expressões indicam que as forças eletromotrizes induzidas têm diferentes amplitudes, mas a mesma frequência angular (w = 20π rad s-1 ).
⇒ A amplitude da força eletromotriz depende do número de espiras e da área de cada uma das espiras da bobina que roda no campo magnético uniforme.
⇒ As expressões não permitem concluir se é o número de espiras ou se é a área das duas bobinas que é diferente.
- A frequência angular da força eletromotriz induzida é igual ao módulo da velocidade angular de rotação das bobinas, e como as frequências das duas forças eletromotrizes são iguais, também serão iguais os módulos das velocidades angulares das duas bobinas.
- Opção (D) ……………. 6 pontos
- 11ºano – Física – Domínio 2 – subdomínio 2 (Eletromagnetismo)
2.2. Em qual das figuras seguintes está representado o sinal obtido no ecrã do osciloscópio ligado à bobina I, caso a base de tempo e o amplificador vertical estejam regulados como indicado nessas figuras?

- Opção (B) ……………. 6 pontos
GRUPO V
O ácido nítrico é um ácido forte, segundo a teoria de Brönsted-Lowry.
1. O cobre metálico reage com soluções concentradas de ácido nítrico, podendo a reação que ocorre ser traduzida por
Cu (s) + 4 HNO3 (aq) → Cu(NO3)2 (aq) + 2 NO2 (g) + 2 H2O (l)
- 11ºano – Química – Domínio 2 – subdomínio 2 (Reações de oxidação redução)
1.1. Na reação considerada, o número de oxidação do nitrogénio varia
(A) de +5 para +4, atuando o ião nitrato como oxidante.
(B) de +1 para +2, atuando o ião nitrato como oxidante.
(C) de +5 para +4, atuando o ião nitrato como redutor.
(D) de +1 para +2, atuando o ião nitrato como redutor.
- Opção (A)
⇒ Com exceção dos peróxidos e dos superóxidos, quando os átomos do oxigénio estabelecem ligações com átomos de elementos diferentes, o número de oxidação do oxigénio é – 2.
⇒ Com exceção dos hidretos metálicos, o número de oxidação do hidrogénio quando se encontra ligado a átomos diferentes é + l.
⇒ As substâncias compostas ácido nítrico , HNO3 , nos reagentes, nitrato de cobre , Cu(NO3)2, e dióxido de nitrogénio, NO2 , nos produtos , têm todas uma estrutura eletricamente neutra.
A soma dos números de oxidação dos átomos presentes , naqueles compostos, tem de ser nula.
Ácido nítrico:
- HNO3 : n.o.(H) + n.o.(N) + 3 x n.o.(O)= 0 ⇔ +1 + n.o.(N) + 3 x (-2) = 0 ⇔ n.o. (N) = +5
Dióxido de nitrogénio:
- NO2 : n.o.(N) + 2 x n.o. (O) = 0 ⇔ n.o.(N) + 2 x (-2) = 0 ⇔ n.o. (N) = +4
No nitrato de cobre, o número de oxidação do nitrogénio é também +5, porque o nitrogénio se liga a três átomos de oxigénio de modo semelhante ao que se verifica no ácido nítrico.
Nos reagentes , o cobre , Cu (s), substância elementar, tem número de oxidação 0.
⇒ Nos produtos, no nitrato de cobre (substância iónica formada pelos iões nitrato NO3, e cobre, Cu2+) o cobre tem número de oxidação + 2.
- Como o número de oxidação do cobre aumentou, de 0 para + 2, ele foi oxidado, donde se pode concluir que o ião nitrato atua como oxidante .
- Opção (A) ……………. 6 pontos
- 11ºano – Química – Domínio 1 – subdomínio 1 (Aspetos quantitativos das reações químicas)
1.2. Que massa de cobre é necessária para reagir completamente com 500 cm3 de uma solução de ácido nítrico de concentração 14,0 mol dm-3 ?
(A) 445 g
(B) 222 g
(C) 111 g
(D) 890 g
- Opção (C) ……………. 6 pontos
2. Considere uma solução de ácido nítrico cuja concentração é 3,94 mol dm-3, contendo 22,0 %, em massa, de HNO3 (M = 63,02 g mol-1).
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
2.1. Calcule a massa volúmica da solução.
Apresente todas as etapas de resolução.
- Etapas de resolução:
⇒ Cálculo da quantidade de HNO3 que existe em 100 g de solução (n = 0,3491 mol) …….. 4 pontos
⇒ Cálculo do volume de solução que contém 0,3491 mol de HNO3 (V = 8,860 x 10-2 dm3) …….. 4 pontos
⇒ Cálculo da massa volúmica da solução (ρ = 1,13 x 103 g dm-3) …….. 2 pontos
ou
⇒ Cálculo da massa de HNO3 que existe em 1 dm3 de solução (m = 248,3 g) …….. 4 pontos
⇒ Cálculo da massa de solução que contém 248,3 g de HNO3 (m = 1,129 x 103 g) …….. 4 pontos
⇒ Cálculo da massa volúmica da solução (ρ = 1,13 x 103 g dm-3) …….. 2 pontos
ou
⇒ Cálculo do volume de solução que contém 1 mol de HNO3 (V = 0,2538 dm3) …….. 4 pontos
⇒ Cálculo da massa de solução que contém 1 mol de HNO3 (m = 286,5 g) …….. 4 pontos
⇒ Cálculo da massa volúmica da solução (ρ = 1,13 x 103 g dm-3) …….. 2 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
(A) 1,90 x 1022
(B) 4,74 x 1021
(C) 1,19 x 1021
(D) 2,37 x 1021
- Opção (D) ……………. 6 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
2.2.2. Qual é a concentração do ião OH– (aq ) nessa solução, a 25 ºC?
Apresente o resultado com dois algarismos significativos.
Ácido forte:
- [HNO3] = [H3O+] = 7,88 x 10-3 mol dm-3
⇒ Kw = [H3O+] [OH–] ⇔ 1,0 x 10-14 = 7,88 x 10-3 x [OH–] ⇔ [OH–] = 1,27 x 10-12 mol dm-3
- 1,3 x 10-12 mol dm-3 …………. 6 pontos
GRUPO VI
1. O ácido fluorídrico, HF (aq ), é um ácido fraco cuja reação de ionização em água pode ser traduzida por
HF (aq ) + H2O ( l ) ⇋ F– (aq ) + H3O+ (aq )
Considere uma solução de ácido fluorídrico, de concentração 0,080 mol dm-3.
A 25 ºC, o pH dessa solução é 2,14.
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
1.1. Determine a constante de acidez do ácido fluorídrico, a 25 ºC.
Apresente todas as etapas de resolução.
- Etapas de resolução:
⇒ Cálculo da concentração do ião H3O+ (aq) e identificação da concentração deste ião com a concentração do ião F– (aq ) ([H3O+] = [F–] = 7,24 x 10-3 mol dm-3) …….. 4 pontos
⇒ Cálculo da concentração de ácido fluorídrico não ionizado ([HF] = 7,28 x 10-2 mol dm-3) …….. 3 pontos
⇒ Cálculo da constante de acidez do ácido fluorídrico, a 25 ºC (Ka = 7,2 x 10-4) …….. 3 pontos
- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
1.2. Conclua como variará a quantidade de ácido ionizado em solução se, à solução de ácido fluorídrico, a temperatura constante, forem adicionadas algumas gotas de uma solução concentrada de uma base forte.
Apresente, num texto estruturado e com linguagem científica adequada, a fundamentação da conclusão solicitada.
(A) Os iões OH– (aq), provenientes da solução adicionada, reagem com os iões H3O+ (aq) existentes na solução de ácido fluorídrico, o que conduz a uma diminuição da concentração do ião H3O+ (aq) .
(B) De acordo com o princípio de Le Châtelier, a diminuição da concentração do ião H3O+ (aq) favorece a reação que conduz a um aumento da concentração deste ião , pelo que a quantidade de ácido ionizado em solução aumentará.
ou
- A diminuição da concentração do ião H3O+ (aq), provocando uma diminuição do quociente da reação, favorece a reação que conduz a um aumento deste quociente, pelo que a quantidade de ácido ionizado em solução aumentará.
- Tópicos de resposta:
A) Os iões OH– (aq), provenientes da solução adicionada, reagem com os iões H3O+ (aq) existentes na solução de ácido fluorídrico, o que conduz a uma diminuição da concentração do ião H3O+ (aq).
B) De acordo com o princípio de Le Châtelier, a diminuição da concentração do ião H3O+ (aq) favorece a reação que conduz a um aumento da concentração deste ião, pelo que a quantidade de ácido ionizado em solução aumentará.
ou
A diminuição da concentração do ião H3O+ (aq), provocando uma diminuição do quociente da reação, favorece a reação que conduz a um aumento deste quociente, pelo que a quantidade de ácido ionizado em solução aumentará.

- 11ºano – Química – Domínio 1 – subdomínio 2 (Equilíbrio químico)
1.3. Escreva a equação química que traduz a reação da base conjugada do ácido fluorídrico com a água.
- F– (aq) + H2O (l) ⇋ HF (aq) + OH– (aq)
- F– (aq) + H2O (l) ⇋ HF (aq) + OH– (aq) ……. 6 pontos
Notas:
1. A ausência de indicação ou a indicação incorreta de pelo menos um dos estados físicos das espécies envolvidas na reação implica uma desvalorização de 2 pontos.
2. A apresentação de → (em vez de ⇋) implica uma desvalorização de 2 pontos.
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
1.4. Pretende-se preparar 500 cm3 de uma solução de HF (aq), de concentração em massa 4,0 x 10-2 g dm-3, a partir da solução de concentração 0,080 mol dm-3.
Determine o volume da solução de concentração 0,080 mol dm-3 que é necessário medir para preparar a solução pretendida.
Apresente todas as etapas de resolução.
- Etapas de resolução:
⇒ Cálculo da concentração da solução a preparar (c = 2,00 x 10-3 mol dm-3 ) …….. 4 pontos
⇒ Cálculo do volume da solução de concentração 0,080 mol dm-3 necessário para preparar a solução pretendida (V = 1,25 x 10-2 dm3) …….. 6 pontos
ou
⇒ Cálculo da concentração em massa da solução de concentração 0,080 mol dm-3 (cm = 1,60 g dm-3) …….. 4 pontos
⇒ Cálculo do volume da solução de concentração 0,080 mol dm-3 necessário para preparar a solução pretendida (V = 1,25 x 10-2 dm3) …….. 6 pontos
- 11ºano – Química – Domínio 2 – subdomínio 3 (Soluções e equilíbrio de solubilidade)
2. O fluoreto de chumbo, PbF2, é um sal cujo produto de solubilidade é 4,1 x 10-8, a 25 ºC.
O equilíbrio que se estabelece entre o sal sólido e os iões resultantes da dissolução do sal em água pode ser traduzido por
PbF2 (s) ⇋ Pb2+ (aq ) + 2 F– (aq )
Qual é a solubilidade deste sal em água, a 25 ºC?
(A) 5,5 x 10-3 mol dm-3
(B) 2,2 x 10-3 mol dm-3
(C) 3,4 x 10-3 mol dm-3
(D) 2,0 x 10-4 mol dm-3
- Opção (B) ……………. 6 pontos
GRUPO VII
- 10ºano – Química – Domínio 2 – subdomínio 1 (Ligação química)
1. Na molécula HF, existem, no total, _____ pares de eletrões de valência, dos quais _____ pares são não ligantes.
(A) oito … três
(B) oito … dois
(C) quatro … três
(D) quatro … dois
- Opção (C)
⇒ Sendo a fórmula de estrutura a molécula H-F, verifica-se que a molécula apresenta quatro pares de eletrões de valência, sendo apenas um deles ligante.
- Opção (C) ……………. 6 pontos
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
2. Os átomos de flúor e de cloro, no estado fundamental, têm o mesmo número de
(A) eletrões em orbitais s.
(B) eletrões em orbitais do cerne do átomo.
(C) orbitais completamente preenchidas.
(D) orbitais semipreenchidas.
- Opção (D)
9F: 1s2 2s2 2p5
17Cl: 1s2 2s2 2p6 3s2 3p5
⇒ São elementos do mesmo grupo, mas pertencentes a períodos diferentes.
- Apresentam o mesmo número de eletrões de valência distribuídos pelo mesmo número de orbitais, tendo, nos dois casos, uma orbital de valência semipreenchida.
- Opção (D) ……………. 6 pontos
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
3. O espectro de emissão do átomo de hidrogénio, na região do visível, apresenta uma primeira risca a 3,0 x 10-19 J, uma segunda risca a 4,1 x 10-19 J, e outras riscas a valores superiores de energia.
Qual é a variação de energia do átomo de hidrogénio quando o eletrão transita do nível n = 4 para o nível n = 3?
(A) -7,1 x 10-19 J
(B) -4,1 x 10-19 J
(C) -3,0 x 10-19 J
(D) -1,1 x 10-19 J
- Opção (D)
⇒ n = 3 → n = 2 : E = 3,0 x 10-19 J
⇒ n = 4 → n = 2 : E = 4,1 x 10-19 J
- ΔE4→3 = 3,0 x 10-19 – 4,1 x 10-19 = -1,1 x 10-19 J
- Opção (D) ……………. 6 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
4. Numa mistura gasosa constituída por HF (g), N2 (g) e He (g), 1/5 das moléculas presentes são de N2 (g) e 1/4 das moléculas presentes são de He (g).
Nessa mistura, a fração molar de HF ( g ) é
(A) 0,55
(B) 0,45
(C) 0,20
(D) 0,89
- Opção (A) ……………. 6 pontos
FIM











