2016 – 2ª Fase – Prova Escrita de Física e Química A
Voltar a: Física e Química
- Prova Escrita de Física e Química A – versão 1
- Prova 715: 2.ª Fase – 2016
GRUPO I
Um dos procedimentos mais comuns em laboratório é a preparação de soluções aquosas por diluição de soluções mais concentradas, de concentração conhecida, habitualmente designadas por soluções-mãe.
Na preparação rigorosa de uma solução por diluição, é necessário medir com rigor um determinado volume da solução mais concentrada, transferir esse volume de solução para um balão volumétrico (de capacidade igual ao volume de solução pretendido) e completar o volume de solução pretendido com água até ao traço de referência do balão. Durante a preparação da solução, esta deve ser agitada.
Em laboratório, é também possível determinar a densidade (massa volúmica) de soluções utilizando diferentes métodos, um dos quais é a picnometria de líquidos. Este método baseia-se na determinação da massa de solução contida num picnómetro cuja capacidade foi previamente calibrada, a uma mesma temperatura.
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
- 10ºano – Química – A.l. – 2.3 – Diluição de soluções
- 11ºano – Física – A.l. – Medições
1. Para «medir com rigor um determinado volume da solução mais concentrada» (terceira e quarta linhas do texto), utiliza-se
(A) uma proveta.
(B) uma pipeta.
(C) um gobelé.
(D) um balão volumétrico.
- Opção (B)
⇒ A proveta e o gobelé não têm precisão suficiente para medições rigorosas de volume de líquidos.
⇒ Um balão volumétrico não se pode utilizar para transferir um volume fixo de líquido pois a precisão (tolerância) de um balão volumétrico reporta-se ao volume contido (“in”) e não ao volume saído (“out”) como nas pipetas e nas buretas.
- Opção (C) ……………. 5 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
- 10ºano – Química – A.l. – 2.3 – Diluição de soluções
2. Se pretendesse preparar 250,0 cm3 de uma solução cinco vezes mais diluída do que a solução-mãe, que volume da solução-mãe teria de medir?
(A) 5,0 cm3
(B) 10,0 cm3
(C) 50,0 cm3
(D) 200,0 cm3
- Opção (C)
⇒ Se se pretende preparar uma solução cinco vezes mais diluída do que a solução-mãe, ou seja, com um fator de diluição, f, igual a 5, o volume de solução concentrada a usar deve ser cinco vezes menor, pois
- f = cinicial/cfinal = Vfinal/Vinicial
⇒ Como se pretende 250,0 cm3 de solução diluída, ter-se-ia de medir 250,0/5 = 50,00 cm3 de solução-mãe.
- Opção (C) ……………. 5 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
- 10ºano – Química – A.l. – 1.3 – Densidade relativa de metais
3. Considere uma solução-mãe de cloreto de potássio, KCl(aq), que contém 2,35 x 10-3 mol de KCl por cada 1,00 g de solução.
A massa volúmica desta solução foi determinada por picnometria, tendo sido obtidos, a uma mesma temperatura, os dados apresentados na tabela seguinte.

Admita que quer preparar, por diluição dessa solução-mãe, uma solução de KCl de concentração 0,27 mol dm-3.
Calcule o fator de diluição a considerar na preparação da solução diluída de KCl.
Apresente todas as etapas de resolução.
Massa de solução-mãe contida no picnómetro:
- m = 1145,09 – 31,552 g = 113,54 g
Como esta solução-mãe de cloreto de potássio contém 2,35 x 10-3 mol de KCl por 1,00 g de solução, a quantidade de KCl existente nesta solução é:
- n = 113,54 g x 2,35 x 10-3 mol g-1 = 2,668 x 10-1 mol
Concentração da solução-mãe de KCl:
- [KCl]0 = n/V = 2,668 x 10-1/ 98,73 x 10-3 = 2,702 mol dm-3
Para obter uma solução de concentração 0,27 mol dm-3 teria de diluir a solução 10 vezes
- fator de diluição = cinicial/cfinal = Vfinal/Vinicial = 2,702 /0,27 = 10
- Etapas de resolução:
A) Cálculo da massa de solução-mãe de KCl contida no picnómetro (m = 113,54 g) (ver nota) …….. 2 pontos
B) Cálculo do volume de 1,00 g da solução-mãe (V = 0,8696 cm3)
OU
- Cálculo da massa de 1,00 cm3 da solução-mãe (m = 1,150 g)
OU
- Cálculo da quantidade de KCl existente em 113,54 g da solução-mãe (n = 0,2668 mol) …….. 5 pontos
C) Cálculo da concentração da solução-mãe de KCl (c = 2,702 mol dm-3) …….. 5 pontos
D) Cálculo do fator de diluição (10) …….. 3 pontos
Nota – O arredondamento do valor da massa de solução-mãe de KCl contida no picnómetro implica a pontuação desta etapa com zero pontos.
4*. A picnometria de líquidos permite determinar de forma indireta a massa volúmica de uma solução.
Que instrumento utilizaria se quisesse determinar de forma direta a massa volúmica de uma solução?
*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
⇒ Os densímetros são instrumentos que permitem determinar de forma direta a massa volúmica, ou densidade, de líquidos.
⇒ Esta medição direta baseia-se na lei de Arquimedes. O densímetro flutua no líquido, estando, portanto, em equilíbrio, ou seja, a resultante das forças que nele atuam é nula.
⇒ Atuando duas forças sobre o densímetro, o peso e a impulsão, conclui-se que o módulo da impulsão exercida sobre o densímetro é igual ao módulo do seu peso.
⇒ Colocando o mesmo densímetro em líquidos de diversas densidades, o volume imerso será inversamente proporcional à densidade do líquido.
⇒ A graduação da escala do densímetro é estabelecida usando um líquido de densidade conhecida.
- Densímetro …………. 5 pontos
GRUPO II
- 11ºano – Química – Domínio 2 – subdomínio 3 (Soluções e equilíbrio de solubilidade)
1. A solubilidade do cloreto de potássio, KCl, em água, é 35,54 g de sal por 100 g de água, a 25 °C.
Considere uma solução saturada de KCl constituída apenas por este sal e por água.
Determine a quantidade de KCl dissolvida em 250 g dessa solução, a 25 °C.
Apresente todas as etapas de resolução.
⇒ A massa de solução que contém 35,54 g de KCl é:
- msolução = msoluto + msolvente = 35,54 + 100 = 135,54 g
⇒ Numa solução saturada de KCl, a uma determinada temperatura, a massa de KCl dissolvida é diretamente proporcional à massa de solução, pelo que:
⇒ A quantidade de KCl (M = 74,55 g mol-1) dissolvida em 250 g da solução saturada, a 25 C :

- Etapas de resolução:
A) Cálculo da massa de solução saturada que contém 35,54 g de KCl (m = 135,54 g) …….. 4 pontos
B) Cálculo da massa de KCl dissolvida em 250 g da solução saturada (m = 65,55 g) …….. 4 pontos
C) Cálculo da quantidade de KCl dissolvida em 250 g da solução saturada (n = 0,879 mol) …….. 2 pontos
ou
A) Cálculo da quantidade de KCl por 100 g de água, na solução saturada (n = 0,47673 mol) …….. 2 pontos
B) Cálculo da massa de solução saturada que contém 35,54 g (0,47673 mol) de KCl (m = 135,54 g) …….. 4 pontos
C) Cálculo da quantidade de KCl dissolvida em 250 g da solução saturada (n = 0,879 mol) …….. 4 pontos
- 11ºano – Química – Domínio 2 – subdomínio 3 (Soluções e equilíbrio de solubilidade)
2. A variação de entalpia (∆H ) associada ao processo de dissolução do KCl em água é positiva.
Preveja, com base no princípio de Le Châtelier, como variará a solubilidade deste sal em água à medida que a temperatura aumenta. Justifique a resposta.
KCl (s) ⇋ K+ (aq) + Cl– (aq) ΔH > 0
⇒ Como a variação de entalpia é positiva, ΔH > 0, o processo de dissolução do KCl em água é um fenómeno endotérmico.
⇒ O aumento da temperatura favorece a dissolução deste sal em água, pois, pelo Princípio de Le Châtelier, à medida que a temperatura aumenta, o equilíbrio evolui no sentido que contraria esse aumento de temperatura, ou seja, no sentido direto (endotérmico).
⇒ A solubilidade do KCl em água aumenta com o aumento de temperatura.
- A resposta integra os tópicos de referência seguintes ou outros de conteúdo equivalente:
A) O processo de dissolução do KCl em água é um processo endotérmico [, uma vez que a variação de entalpia a ele associada é positiva].
B) [Assim, de acordo com o princípio de Le Châtelier,] este processo de dissolução será favorecido por um aumento de temperatura, pelo que será de prever que a solubilidade do KCl em água aumente [à medida que a temperatura aumenta].

- 11ºano – Química – Domínio 2 – subdomínio 3 (Soluções e equilíbrio de solubilidade)
3. O perclorato de potássio, KClO4 , constituído pelos iões K+ e ClO4–, é um sal bastante menos solúvel em água do que o cloreto de potássio.
O produto de solubilidade do perclorato de potássio é 1,05 x 10-2, a 25 °C.
A solubilidade deste sal em água, a 25 °C, será
(A) 5,25 x 10-3 mol dm-3
(B) 1,05 x 10-2 mol dm-3
(C) 2,10 x 10-2 mol dm-3
(D) 1,02 x 10-1 mol dm-3
- Opção (D)
⇒ A equação que traduz o equilíbrio de solubilidade do perclorato de potássio, KClO4, em água é:
KClO4 (s) ⇌ K+ (aq) + ClO4− (aq)
⇒O produto de solubilidade é Ks = [K+]×[ClO4−] e, a 25 ºC, tem valor 1,05 × 10-2.
Dissolvendo-se s mol dm-3 de KClO4, verificar-se-á que [K+] = [ClO4−] = s mol dm-3.
- Ks = s2 ⇔ s = √𝐾s ⇔ s = 1,02 × 10-1 mol dm-3
- Opção (D) ……………. 5 pontos
GRUPO III
Considere uma amostra pura de 200 g de cloreto de potássio, KCl, inicialmente no estado sólido à temperatura de 980 K, à qual é fornecida energia com uma fonte de 300 W.

1. A Figura 1 representa um gráfico teórico da temperatura, T, dessa amostra em função do tempo, t.
No traçado do gráfico, admitiu-se um rendimento de 100% para o processo de transferência de energia considerado.
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
1.1. Se a potência da fonte fosse maior,
(A) seria necessária mais energia para a temperatura da amostra aumentar 1 K.
(B) seria necessária menos energia para fundir completamente a amostra.
(C) a mesma energia seria transferida num intervalo de tempo menor.
(D) a mesma energia provocaria um maior aumento da energia interna do sistema.
- Opção (C)
⇒ A potência da fonte relaciona-se com a energia transferida e com o intervalo de tempo em que é transferida essa energia pela fórmula:
- 𝑃 = 𝐸/Δ𝑡 ⇔ 𝐸=𝑃 ×Δ𝑡
Assim, para a mesma energia transferida (E), quanto maior for a potência da fonte menor terá de ser o intervalo de tempo em que ocorre essa transferência de energia.
(A) Inválida, porque a energia necessária para que a temperatura da amostra aumente 1 K só depende da massa e da natureza da substância que constitui a amostra.
(B) Inválida, porque a energia para fundir a amostra só depende da massa e da natureza da substância que constitui a amostra.
(D) Inválida, porque se a potência da fonte fosse menor, para que a energia transferida fosse a mesma, o intervalo de tempo teria de ser maior. Assim, fornecendo a mesma energia, independentemente da potência da fonte, o aumento de energia interna do sistema seria o mesmo.
- Opção (C) ……………. 5 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
1.2. De acordo com o gráfico, qual será a variação da temperatura da amostra de KCl considerada no intervalo de tempo [0; 36] s?
⇒ Para o intervalo de tempo [0; 36] s, tem-se: T0 = 980 K e T36 = 1044 K
- ΔT = T36 – T0 ⇒ ΔT = 1044 – 980 = 64 K
⇒ A variação da temperatura da amostra no intervalo de tempo considerado é igual a 64 K.
- 64 K Ou 64 ºC …….. 5 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
1.3. Considere os intervalos de tempo [0; 36] s, [36; 273] s e [273; 310] s, e admita que a amostra de KCl constitui um sistema fechado.
A variação da energia interna do sistema
(A) é nula apenas em dois dos intervalos de tempo considerados.
(B) é nula nos três intervalos de tempo considerados.
(C) é diferente de zero apenas em dois dos intervalos de tempo considerados.
(D) é diferente de zero nos três intervalos de tempo considerados.
- Opção (D)
⇒ A variação de energia interna está relacionada, a nível interno, com variações de energia cinética e variações de energia potencial.
⇒ No primeiro intervalo de tempo a amostra encontra-se sólida sofrendo um aumento de temperatura, o que evidencia variação de energia interna.
⇒ No intervalo de tempo [36; 273] s está a ocorrer a mudança de fase, ou seja, a amostra está a passar do estado sólido ao estado líquido, havendo aumento da energia interna.
⇒ No último intervalo de tempo referido, há um aumento da temperatura, que se traduz por um aumento da energia interna da amostra.
- Ocorre variação de energia interna nos três intervalos de tempo referidos.
- Opção (D) ……………. 5 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
1.4. Calcule a energia necessária para fundir 1,0 kg de KCl que se encontra à temperatura de fusão.
Apresente todas as etapas de resolução.
⇒ A energia necessária para fundir a amostra de KCl é a energia por ela absorvida no intervalo de tempo em que a temperatura permaneceu constante, ou seja, no intervalo [36, 273] s.
⇒ Sendo o rendimento de 100% a energia absorvida, 𝐸absorvida, pela amostra é igual à fornecida pela fonte, 𝐸fonte, naquele intervalo:
- 𝐸absorvida = 𝐸fonte = 𝑃Δ𝑡 = 300 W x (273 − 36) s = 7,110 x 104 J (energia necessária para fundir 200 g, a massa 𝑚 da amostra, de KCl).
⇒ Para fundir 𝑚′ = 1,0 kg de KCl será necessária uma energia 𝐸’absorvida

ou
⇒ A energia, 𝐸, necessária para a fusão de uma amostra de massa 𝑚 é:
- 𝐸 = 𝑚Δ𝐻fusão ⟹ 𝑃Δ𝑡 = 𝑚Δ𝐻fusão ⟹ 300 W x (273 − 36)s = 0,200 kg x Δ𝐻fusão ⟹ Δ𝐻fusão = 3,56 x 105 J kg−1
em que Δ𝐻fusão é a variação de entalpia mássica de fusão (energia por unidade de massa de cloreto de potássio, KCl, necessária para a fusão).
- Conclui-se que para fundir 1,0 kg de KCl é necessária uma energia de 3,6 x 105 J.
- Etapas de resolução:
A) Determinação da energia necessária para fundir a amostra de KCl (7,110 x 104 J)
ou
- Determinação do intervalo de tempo necessário para fundir, nas mesmas condições, 1,0 kg de KCl (Δt = 1,19 x 103 s) …….. 5 pontos
B) Determinação da energia necessária para fundir 1,0 kg de KCl (E = 3,6 x 105 J) …….. 5 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
1.5. A capacidade térmica mássica do KCl sólido e a capacidade térmica mássica do KCl líquido são semelhantes.
Mostre, com base no gráfico da Figura 1 e sem efetuar cálculos, que esta afirmação é verdadeira.
⇒ O gráfico da figura 1 traduz como varia a temperatura da amostra de KCl com o tempo de fornecimento de energia.
No intervalo de tempo [0; 36] s a amostra está sólida e no intervalo [273; 310] s está no estado líquido.
⇒ O declive da reta no primeiro intervalo de tempo (estado sólido) é aproximadamente igual ao declive da reta no intervalo em que a amostra se encontra no estado líquido, ou seja, há uma variação de temperatura semelhante num intervalo de tempo aproximadamente igual.
⇒ O declive dessas retas está relacionado com a capacidade térmica mássica da substância. Sendo a energia transferida pela fonte dada por E = P Δt e a energia recebida pela amostra E = m c ΔT,
- 𝑃 Δ𝑡 = 𝑚 𝑐 Δ𝑇 ⇔ Δ𝑇= (𝑃/𝑚 𝑐) Δ𝑡
⇒ Como a potência da fonte se mantém e a massa também, pode concluir-se que a capacidade térmica mássica do cloreto de potássio no estado sólido e no estado líquido são semelhantes.
- A resposta integra os tópicos de referência seguintes ou outros de conteúdo equivalente:
A) [ O gráfico representado na figura mostra que] a reta correspondente ao aquecimento da amostra de KCl sólido e a reta correspondente ao aquecimento da amostra de KCl líquido têm declives semelhantes.
B) O declive de cada uma dessas retas depende da capacidade térmica mássica do KCl sólido e da capacidade térmica mássica do KCl líquido, respetivamente, da potência da fonte e da massa da amostra.
Como [, na situação considerada,] a potência da fonte e a massa da amostra são as mesmas, conclui-se que a capacidade térmica mássica do KCl sólido e a capacidade térmica mássica do KCl líquido são semelhantes.

2. O cloreto de potássio é constituído pelos iões K+ e Cl–.
- 10ºano – Química – Domínio 1 – subdomínio 1 (Massa e tamanho dos átomos)
2.1. A amostra considerada contém 2,68 mol de KCl. Quantos iões existem, no total, na amostra?
Apresente o resultado com três algarismos significativos.
KCl → K+ + Cl–
n (KCl) = 2,68 mol; n (iões) = 2 x 2,68 = 5,36 mol de iões
⇒ Como N = n x NA, o número de iões existentes, no total, na amostra será:
- N (iões) = 5,36 mol x 6,02 x 1023 iões mol-1 = 3,23 x 1024 iões
ou
⇒ Dado que cada “agregado” KCl é formado por dois iões, o número total de iões existentes em 2,68 mol de KCl será:
- (1 mol de KCl) / (2×6,02×1023 iões) = (2,68 mol de iões KCl)/(𝑁 (iões))
- N (iões) = 3,227 × 1024 iões
Assim, o resultado com três algarismos significativos será 3,23 × 1024 iões.
Outro processo:
- Determinar o número de entidades KCl.
N(KCl) = n(KCl) × NA ⇔ N(KCl) = 2,68 × 6,02 × 1023 ⇔ N(KCl) =1,613 × 1024
⇒ Determinar o número de iões em 1,613 × 1024 entidades KCl.
- N(iões) = N(KCl) × 2 ⇔ N(iões) = 1,613 × 1024 ×2 ⇔ N(iões) = 3,227 × 1024
⇒ O resultado com três algarismos significativos será 3,23 × 1024 iões.
- 3,23 x 1024 [iões] …….. 5 pontos
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
2.2. Os iões K+ e Cl–, no estado fundamental, apresentam
(A) ambos apenas seis eletrões de valência.
(B) o mesmo número de orbitais de valência.
(C) configurações eletrónicas diferentes.
(D) ambos apenas cinco orbitais ocupadas.
- Opção (B)
⇒ 19K – 1s2 2s2 2p6 3s2 3p6 4s1; K+ – 1s2 2s2 2p6 3s2 3p6 (Quatro orbitais de valência)
⇒ 17Cl – 1s2 2s2 2p6 3s2 3p5; Cl− – 1s2 2s2 2p6 3s2 3p6 (Quatro orbitais de valência)
Os iões K+ e Cl– são partículas isoeletrónicas, pelo que têm a mesma configuração eletrónica. Têm o mesmo número de orbitais de valência, quatro.
O número de eletrões de valência destas partículas é 8 e não 6.
As configurações eletrónicas não são diferentes.
- Como o número de orbitais ocupadas por ambos os iões é 9 (1s, 2s, 2px, 2py, 2pz, 3s, 3px, 3py, 3pz).
- Opção (B) ……………. 5 pontos
GRUPO IV
O lítio, Li, e o potássio, K, são elementos do grupo 1 da tabela periódica.
- 10ºano – Química – Domínio 1 – subdomínio 3 (Tabela periódica)
1. A energia de ionização do lítio é 519 kJ mol-1.
Transcreva e complete o esquema seguinte de modo a obter uma equação química que traduza a ionização de 1 mol de átomos de lítio, no estado fundamental, isolados e em fase gasosa, quando lhes é fornecida uma energia de 519 kJ.
Li(g) → _____ + _____
⇒ O esquema representa o processo de ionização do lítio, no estado fundamental. Assim, se uma mole de átomos de lítio, no estado fundamental, isolados e no estado gasoso, receberem a energia de 519 kJ ocorrerá a remoção de uma mole de eletrões e a formação de uma mole de iões lítio (Li+).
⇒ O esquema que traduz a equação química que evidencia a referida ionização é:
- Li (g) → Li+ (g) + 1 e–
- Li (g) → Li+ (g) + e–…….. 5 pontos
Nota – A omissão da indicação do estado físico das espécies envolvidas na reação não implica qualquer desvalorização.
2. O lítio reage com a água, sendo a reação traduzida por
2 Li (s) + 2 H2O ( l ) → 2 LiOH (aq ) + H2 (g)
- 11ºano – Química – Domínio 1 – subdomínio 1 (Aspetos quantitativos das reações químicas)
2.1. A reação do lítio com a água é uma reação completa, o que implica que
(A) ambos os reagentes se esgotem no decurso da reação.
(B) a quantidade dos produtos formados seja igual à quantidade inicial dos reagentes.
(C) a massa dos produtos formados seja igual à massa inicial dos reagentes.
(D) pelo menos um dos reagentes se esgote no decurso da reação.
- Opção (D)
⇒ Uma reação completa é aquela em que pelo menos um dos reagentes se esgota. Assim, essa reação terá rendimento 100%.
⇒ Para que ambos os reagentes se esgotassem, era necessário que estivessem na proporção estequiométrica adequada no sistema reacional.
- Opção (D) ……………. 5 pontos
- 11ºano – Química – Domínio 2 – subdomínio 2 (Reações de oxidação redução)
2.2. Na reação considerada, o lítio ______ , atuando como _______ .
(A) oxida-se … redutor
(B) oxida-se … oxidante
(C) reduz-se … redutor
(D) reduz-se … oxidante
- Opção (A)
⇒ O número de oxidação do lítio passa de zero, em Li(s), a + 1 em LiOH (aq). A variação do número de oxidação, Δn.o. (Li) = + 1 – 0 = + 1.
⇒ Como Δn.o. > 0, o lítio sofreu oxidação; cada átomo liberta um eletrão, logo, atua como redutor (da água, neste caso).
ou
⇒ Analisando os números de oxidação dos átomos presentes na reação, verifica-se que:
- n.o. (Li)Li = 0
- n.o. (H)água = +1
- n.o. (O)água = -2
- n.o (Li)LiOH = +1
- n.o. (H)LiOH = +1
- n.o. (O)LiOH = -2
- n.o. (H)H2 = -2
⇒ Dado que o número de oxidação do lítio passa de zero a +1, significa que o lítio cede um eletrão pelo que sofre oxidação e como tal atua como redutor.
- Opção (A) ……………. 5 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
2.3. Numa tina contendo 200 cm3 de água, fez-se reagir um pequeno pedaço de lítio. No final da reação, verificou-se que, a 25 ºC, o pH da solução resultante era 13,27.
Determine o volume, medido nas condições normais de pressão e de temperatura, de H2(g) que se terá formado na reação.
Admita que o volume da solução resultante é igual ao volume inicial de água.
Apresente todas as etapas de resolução.
⇒ Determinar a concentração de iões hidróxido (OH–) na solução resultante da reação.
- pH = 13,27 ⇒ [H3O+] = 10-pH ⇔ [H3O+] = 10-13,27 ⇔ [H3O+] = 5,37 × 10-14 mol dm-3
Como a reação ocorre a 25 ºC, Kw = 10-14.
- [H3O+]×[OH–] = 10-14 ⇔ 5,37 × 10-14 × [OH–] = 10-14 ⇔ [OH–] = 0,186 mol dm-3
Outro processo:
A 25 ºC, pH + pOH = 14.
- pOH = 14 – pH ⇔ pOH = 14 – 13,27 ⇔ pOH = 0,73
Como [OH–] = 10-pOH ⇔ [OH–] = 10-0,73 ⇔ [OH–] = 0,186 mol dm-3.
⇒ Determinar a quantidade de hidrogénio, H2 (g), formado.
⇒ A quantidade de iões OH– formada é
- 𝑐= 𝑛/𝑉⇔ 𝑛 =𝑐 x 𝑉 ⇔ 𝑛 =0,186 × 200 × 10−3
- 𝑛 (HO−)=0,0372 mol
- n(OH-) = n(LiOH) ⇔ n(LiOH)= 0,0372 mol
⇒ Tendo em consideração a estequiometria da reação,
- n(H2) = 12 n(LiOH) ⇔ n(H2) = ½ (0,0372) = 0,0186 mol de H2
⇒ Determinar o volume de hidrogénio, H2 (g), formado na reação nas condições PTN.
- 𝑛 = 𝑉/𝑉m ⇔ 𝑉 =𝑛 x 𝑉m ⇔ 𝑉=0,0186 mol × 22,4 dm3 / mol ⇔ 𝑉 = 0,42 dm3 de H2
⇒ O volume de H2 (g), medido nas condições normais de pressão e de temperatura que se terá formado na reação foi 0,42 dm3 de H2.
- Etapas de resolução:
A) Cálculo da concentração de OH– na solução resultante (c = 1,86 x 10-1 mol dm-3) …….. 3 pontos
B) Cálculo da quantidade de OH– na solução resultante (n = 3,72 x 10-2 mol) …….. 2 pontos
C) Cálculo do volume, medido nas condições nomais de pressão e de temperatura, de H2(g) que se terá formado na reação. (V = 4,2 x 10-1 dm-3) …….. 5 pontos
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
2.4. Explique, com base nas configurações eletrónicas dos respetivos átomos no estado fundamental, porque é que o potássio reage mais vigorosamente com a água do que o lítio.
2 Li (s) + 2 H2O (l) → 2 LiOH (aq) + H2 (g) // 3Li – 1s2 2s1
2 K (s) + 2 H2O (l) → 2 KOH (aq) + H2 (g) // 19K – 1s2 2s2 2p6 3s2 3p6 4s1
⇒ Ambos os átomos possuem um só eletrão de valência, ns1, mas o eletrão de valência do potássio encontra-se num nível energético superior (n = 4) ao nível energético em que se encontra o eletrão de valência do lítio (n = 3).
⇒ Assim, no potássio, esse eletrão está menos ligado ao núcleo porque existem mais eletrões em camadas interiores que efetuam a “blindagem” do núcleo, isto é, tornam menor a carga nuclear efetiva.
⇒ Por isso, o potássio é o que necessita de menos energia para a água lhe remover um eletrão (ou seja, tem menor energia de ionização).
⇒ Como na reação do lítio e do potássio com a água ocorre a libertação do eletrão de valência dos respetivos átomos, o potássio perde mais facilmente o seu eletrão de valência e, portanto, reage mais vigorosamente com a água do que o lítio.
- A resposta integra os tópicos de referência seguintes ou outros de conteúdo equivalente:
A) O eletrão de valência do átomo de potássio encontra-se num nível energético superior ao nível energético em que se encontra o eletrão de valência do átomo de lítio.
B) [Assim, por comparação com o átomo de lítio,] o eletrão de valência do átomo de potássio encontra-se mais afastado do respetivo núcleo, sofrendo menor atração por parte deste e sendo, por isso, mais facilmente removido.
C) A reação do lítio e a reação do potássio com a água envolvem a perda do eletrão de valência dos átomos respetivos [, pelo que a reação do potássio com a água será mais vigorosa do que a reação do lítio].
Nota – A apresentação das configurações eletrónicas dos átomos de lítio e de potássio no estado fundamental não é, por si só, equivalente ao tópico de referência A. Assim, uma resposta que apresente exclusivamente aquelas configurações eletrónicas deve ser classificada com zero pontos. No caso em que a resposta integre os tópicos de referência B e/ou C, a apresentação, no tópico de referência A, apenas daquelas configurações eletrónicas constituirá um fator de desvalorização da resposta, de acordo com os Critérios Gerais de Classificação.

GRUPO V
1. Uma bola de ténis, de massa m, cai verticalmente, depois de abandonada a 1,70 m do solo. A bola colide com o solo e ressalta, atingindo num primeiro ressalto a altura máxima de 0,94 m.
Considere desprezável a força de resistência do ar, e admita que a bola pode ser representada pelo seu centro de massa (modelo da partícula material).
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
- 10ºano – Física – A.l. – 1.2 – Movimento vertical de queda e ressalto de uma bola
1.1. Qual das expressões seguintes permite calcular o trabalho realizado pela força gravítica que atua na bola, no deslocamento entre a posição em que a bola é abandonada e a posição em que, após o primeiro ressalto, a bola atinge a altura máxima?
(A) -10 m x ( 0,94 – 1,70)
(B) 10 m x ( 0,94 – 1,70)
(C) -10 m x ( 0,94 + 1,70)
(D) 10 m x ( 0,94 + 1,70)
- Opção (A)
Partindo do conceito de trabalho, o trabalho do peso será dado por:
- 𝑊P = |P| x |Δ𝑟⃗| × cos α
⇒ Sendo a massa da bola, m, o módulo da aceleração gravítica 10 m s-2, o módulo de deslocamento dado por |yf – yi| = |0,94 – 1,70| e o ângulo entre a força (Peso) e o deslocamento 0º, a expressão do trabalho realizado pelo peso no deslocamento referido será:
- 𝑊𝑃 = 𝑚 × 10 × |0,94−1,70| x cos0º= − 𝑚 ×10 (0,94−1,70)
Outro processo:
- 𝑊𝑃 = − ΔEp = − (𝐸f − 𝐸i) = – (m × 10 × 0,94 – m × 10 × 1,70) = -10 m (0,94 – 1,70)
- Opção (A) ……………. 5 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
- 10ºano – Física – A.l. – 1.2 – Movimento vertical de queda e ressalto de uma bola
1.2. Se a percentagem de energia dissipada for a mesma em todas as colisões com o solo, é de prever que, num segundo ressalto, a bola atinja uma altura máxima de
(A) 0,18 m
(B) 0,42 m
(C) 0,52 m
(D) 0,55 m
- Opção (C)
- hqueda (1) = 1,70 m;
- hressalto (1) = 0,94 m;
- hqueda (2) = 0,94 m;
- hressalto (2) = ?
⇒ Durante a queda da bola, e, também durante a sua subida, apenas atua a força gravítica, conservando-se a energia mecânica do sistema bola + Terra.
⇒ Antes da colisão, a energia mecânica do sistema no momento em que atinge o solo é igual à energia potencial gravítica na sua posição mais alta.
⇒ Após a colisão, a energia mecânica do sistema é igual à energia potencial gravítica quando a bola atinge uma nova altura máxima (nessas duas posições a energia cinética da bola é nula).
Conclui-se que a variação de energia mecânica durante uma colisão é igual à variação de energia potencial gravítica entre essas posições:
- no 1.º ressalto entre as posições de alturas ℎ1, i = 1,70 m e ℎ1, f = 0,94 m
- no 2.º ressalto entre as posições de alturas ℎ2, i = 0,94 m e ℎ2, f que se pretende calcular.
Designando as variações de energia mecânica no 1.º e 2.º ressaltos por Δ𝐸m,1 e Δ𝐸m,2, respetivamente, e considerando que a proporção de energia mecânica perdida nestes dois ressaltos é a mesma, obtêm-se:

Como, no 2.º ressalto, a bola cai de uma altura ℎ2,i = 0,94 m e atinge, após o ressalto, uma altura máxima ℎ2,f que se encontra 0,42 m abaixo desta, obtém-se ℎ2,f = 0,52 m:
- Δℎ2 = −0,42 m ⟹ ℎ2,f − ℎ2,i = −0,42 m ⟹ ℎ2,f − 0,94 m = −0,42 m ⟹ ℎ2,f = 0,52 m.
- Opção (C) ……………. 5 pontos
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
- 10ºano – Física – A.l. – 1.2 – Movimento vertical de queda e ressalto de uma bola
1.3. Durante a colisão da bola com o solo, a força exercida pela bola sobre o solo e a força exercida pelo solo sobre a bola têm, em cada instante,
(A) o mesmo sentido e intensidades diferentes.
(B) sentidos opostos e intensidades diferentes.
(C) o mesmo sentido e a mesma intensidade.
(D) sentidos opostos e a mesma intensidade.
- Opção (D)
⇒ A força exercida pela bola sobre o solo, aplicada neste, e a força exercida pelo solo sobre a bola, aplicada nesta, constituem um par ação-reação que, de acordo com a Terceira Lei de Newton, apresentam a mesma direção, a mesma intensidade e sentidos opostos.
- Opção (D) ……………. 5 pontos
2*. A Figura 2 (que não se encontra à escala) representa uma bola de ténis que passa sobre a rede de um campo de ténis com velocidade horizontal, v→, descrevendo uma trajetória parabólica até embater no solo.
Considere desprezável a força de resistência do ar, e admita que a bola pode ser representada pelo seu centro de massa (modelo da partícula material).
Tenha em conta o referencial bidimensional representado na Figura 2.

*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
2.1*. Qual é o esboço do gráfico que pode representar a componente escalar x da posição da bola, em função do tempo, t, desde o instante em que a bola passa sobre a rede até ao instante em que embate no solo?

*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
- Opção (B)
⇒ A componente escalar x da posição da bola, em função do tempo, t, é dada para por x = vx t. Trata-se da equação de um movimento uniforme.
⇒ Segundo o eixo OX o movimento é uniforme porque a resultante das forças nesta direção é nula. Deste modo, o módulo da velocidade nessa direção permanecerá constante.
- Há assim uma proporcionalidade direta entre a componente escalar, x, e o tempo, t.
- Opção (B) ……………. 5 pontos
2.2*. Em qual dos esquemas seguintes o vetor F pode representar a resultante das forças que atuam na bola, na posição assinalada?

*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
- Opção (D)
⇒ A única força que atua na bola de ténis durante o seu movimento é a força gravítica que a Terra exerce na bola.
- Esta força tem sempre a direção da vertical do lugar e é dirigida para o centro da Terra.
- Opção (D) ……………. 5 pontos
2.3*. A bola passa sobre a rede a 1,35 m do solo e embate no solo a 9,0 m da rede, como representado na Figura 2.
Calcule o módulo da velocidade com que a bola atinge o solo.
Apresente todas as etapas de resolução.
*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
⇒ As equações que traduzem as componentes escalares 𝑥 e 𝑦 da posição da bola em função do tempo, 𝑡, são:
- 𝑥 = 𝑥0 + 𝑣0𝑡
- 𝑦 = 𝑦0 − ½ 𝑔𝑡2
⇒ Nessas equações 𝑣0 é a componente escalar da velocidade inicial, velocidade da bola ao passar sobre a rede, segundo o eixo O𝑥 (𝑣0𝑥 = 𝑣0 = módulo da velocidade inicial;
- como a velocidade inicial é horizontal, a sua componente vertical é nula, 𝑣0𝑦 = 0) e 𝑔 o módulo da aceleração da gravidade.
⇒ Com os dados da Figura 2 determina-se o tempo que a bola demora a atingir o solo, 𝑡queda, e o módulo da velocidade inicial, 𝑣0:
- 9,0 = 0,0 + 𝑣0𝑡queda ⟹ 𝑣0 = 17,3 m s−1
- 0,0 = 1,35 − ½ 10 𝑡queda ⟹ 𝑡queda = 0,520 s
⇒ Durante a queda, a componente horizontal da velocidade, 𝑣𝑥, permanece constante (a componente do movimento segundo a direção horizontal é uniforme) e a componente vertical, 𝑣𝑦, aumenta proporcionalmente ao tempo decorrido:
- 𝑣𝑥 = 𝑣0
- 𝑣𝑦 = −𝑔𝑡
⇒ Assim, as componentes escalares da velocidade da bola ao atingir o solo, 0,520 s depois de ter passado sobre a rede são:
- 𝑣𝑥 = 17,3 m s−1 ⟹ 𝑣𝑥 = 17,3 m s−1
- 𝑣𝑦 = −10 m s−2 x 0,520 s ⟹ 𝑣𝑦 = −5,20 m s−1
⇒ O módulo da velocidade com que a bola atinge o solo, |𝑣⃗f|, determina-se com base no Teorema de Pitágoras:
- |𝑣⃗f| = √𝑣𝑥2 + 𝑣𝑦2 = 18 m s−1.
ou
⇒ Durante a queda da bola só atua sobre ela a força gravítica exercida pela Terra, logo há conservação da energia mecânica do sistema bola + Terra:
- 𝐸m,i = 𝐸m,f ⟹ 𝑚𝑔ℎi + ½ 𝑚𝑣i2 = 0 + ½ 𝑚𝑣f2 ⟹ 𝑣f2 = 2𝑔ℎi + 𝑣i2
⇒ O módulo da velocidade com que a bola atinge o solo, 𝑣f, é:
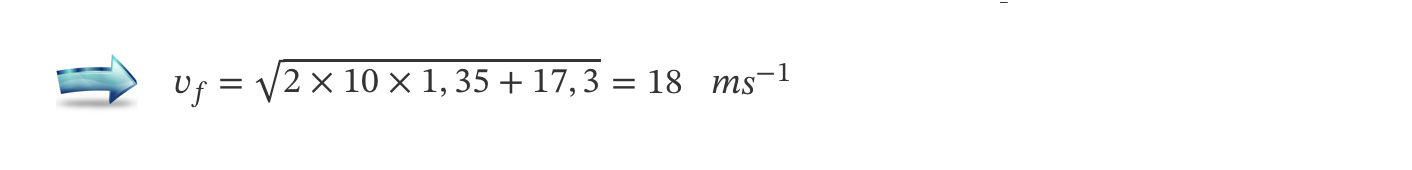
- Etapas de resolução:
A) Determinação do intervalo de tempo que decorre entre o instante em que a bola passa sobre a rede e o instante em que a bola atinge o solo (Δt = 0,520 s) …….. 5 pontos
B) Determinação do módulo da velocidade com que a bola passa sobre a rede (v = 17,3 m s-1) …….. 5 pontos
C) Determinação do módulo da velocidade com que a bola atinge o solo (v = 18 m s-1) …….. 5 pontos
GRUPO VI
Um feixe de radiação monocromática propaga-se no ar e incide numa face de um paralelepípedo de vidro.
Uma parte do feixe é refletida na face do paralelepípedo, enquanto outra parte passa a propagar-se no vidro, sendo o ângulo de refração menor do que o ângulo de incidência.
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
1. O comprimento de onda, no vácuo, da radiação utilizada na experiência é 6,5 x 10-7 m. Qual é a frequência, em hertz (Hz), dessa radiação eletromagnética?
Apresente o resultado com dois algarismos significativos.
⇒ Se a radiação de comprimento de onda 6,5 × 10−7 m se propaga no vácuo, a sua velocidade de propagação é 3,00 × 108 m s−1.
- 𝑐 = λ 𝑓 ⇔ 𝑓= 𝑐/λ ⇔ 𝑓= 4,62 ×1014 Hz
⇒ Como o resultado tem de ser apresentado com dois algarismos significativos será 4,6 ×1014 Hz.
Outro processo
- 𝑐 =λ/𝑇 ⇔ 𝑇 = λ/𝑐 ⇔ 𝑇 = 2,17 × 10−15 s
Como a frequência é o inverso do período
- 𝑓 = 1/𝑇 ⇔ 𝑓 = 4,61 × 1014 Hz
Como o resultado tem de ser apresentado com dois algarismos significativos será 4,6 × 1014 Hz.
- 4,6 x 1014 [Hz] …….. 5 pontos
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
2. Quando a radiação passa do ar para o vidro, a sua velocidade de propagação ______ e o seu comprimento de onda _____ .
(A) diminui … diminui
(B) diminui … aumenta
(C) aumenta … aumenta
(D) aumenta … diminui
- Opção (A)
⇒ Se, como é referido, o ângulo de refração no vidro é menor que o ângulo de incidência, significa que a radiação se propaga com menor velocidade no vidro do que no ar.
⇒ Como a mudança de meio ótico não altera a frequência da radiação e 𝑐 = λ 𝑓, se a velocidade de propagação diminuiu e a frequência se manteve, então o comprimento de onda da radiação no vidro teve de diminuir.
- Opção (A) ……………. 5 pontos
3. Para diversos ângulos de incidência na superfície de separação ar-vidro, mediram-se os ângulos de reflexão e de refração correspondentes.
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
- 11ºano – Física – A.l. – 3.1 – Ondas: absorção, reflexão, refração
3.1. Os resultados obtidos permitiram traçar o gráfico do ângulo de reflexão, αrefl, em função do ângulo de incidência, αi.
Qual é o esboço desse gráfico, assumindo a mesma escala nos dois eixos?

- Opção (B)
⇒ Na reflexão, o ângulo de incidência, ângulo definido pelo raio incidente e a normal à superfície no ponto de incidência, é igual ao ângulo de reflexão, ângulo definido pelo raio refletido e pela normal ao mesmo ponto. Isto é: αrefl = αi
⇒ Assim, o gráfico que traduz a variação do ângulo de reflexão em função do ângulo incidente é uma reta de declive igual a um.
- Opção (B) ……………. 5 pontos
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
- 11ºano – Física – A.l. – 3.1 – Ondas: absorção, reflexão, refração
3.2. Na tabela seguinte, estão registados os senos dos ângulos de incidência, sin αi, e os senos dos correspondentes ângulos de refração, sin αrefl.
Determine, para a radiação considerada, o índice de refração do vidro constituinte do paralelepípedo utilizado na experiência.
Na sua resposta, apresente a equação da reta de ajuste obtida, identificando as grandezas consideradas.
Apresente todas as etapas de resolução.
nar (índice de refração do ar) = 1,00
Obter a equação da reta que melhor se ajusta aos dos registados na tabela.
Recorrendo às potencialidades da máquina gráfica, inserindo os dados da tabela nas LISTAS e obtendo a equação sin αrefr = f (sin αi) é encontrada a equação:
- sin αrefr = 0,682 sin αi + 7 × 10-4
Determinar o índice de refração do vidro utlizado.
⇒ De acordo a lei de Snell-Descartes, n1 sin αi = n2 sin αrefr, ou seja, sin αrefr = 𝑛1/𝑛2 sin αi, onde n1 é o índice de refração do meio onde se propaga o feixe incidente e n2 o índice de refração do meio onde se propaga o feixe refratado.
Assim, o declive da reta obtida traduz a razão entre os índices de refração dos meios 1 e 2.
Por comparação entre a equação obtida com a máquina gráfica e a lei de Snell-Descartes, conclui-se
- que 𝑛1/𝑛2 = 0,682 ⇔ 1,00/𝑛2 = 0,682 ⇔ 𝑛2 = 1,50.
Outro processo:
Obter a equação da reta que melhor se ajusta aos dos registados na tabela.
Se o gráfico obtido traduzir a relação αi= f (sin αrefr), a equação da reta que melhor se ajusta aos dados registados na tabela será:
- sin αi = 1,47 sin αrefr – 8 × 10-4
Determinar o índice de refração do vidro utilizado.
Como
- n1 sin αi = n2 sin αrefr ⇔ sin αi = (𝑛2/𝑛1) sin αrefr
Assim:
- (𝑛2/𝑛1) = 1,47 ⇔ 𝑛2/1,00 = 1,47 ⇔ 𝑛2 =1,5
O índice de refração do vidro do paralelepípedo utilizado é 1,5.
- Etapas de resolução:
A) Apresentação, para o gráfico de sin αrefr em função de sin αi , da equação da reta de ajuste obtida (sin αrefr = 0,682 sin αi + 7 x 10-4)
ou
Apresentação, para o gráfico de sin αi em função de sin αrefr , da equação da reta de ajuste obtida (sin αi = 1,47 sin αrefr – 8 x 10-4) (ver nota) …….. 5 pontos
B) Determinação do índice de refração do vidro constituinte do paralelepípedo utilizado (n = 1,5) …….. 5 pontos
Nota – A não identificação ou a identificação incorreta de, pelo menos, uma das grandezas consideradas implica a pontuação desta etapa com zero pontos.
FIM




