2014 – Época Especial – Prova Escrita de Física e Química A
Voltar a: Física e Química
- Prova Escrita de Física e Química A – versão 1
- Prova 715: Época especial – 2014
GRUPO I
O magnésio é um metal valioso, usado, como metal estrutural leve, em ligas, em baterias e em sínteses químicas. Apesar de o magnésio ser abundante na crosta terrestre, é mais barato retirar este metal da água do mar. O método de obtenção do magnésio a partir da água do mar implica a utilização de calcário e de ácido clorídrico e envolve três tipos de reações: reações de precipitação, de ácido-base e de oxidação-redução.
Raymond Chang, Química, 5.ª ed., Lisboa, McGraw-Hill Portugal, 1994, p. 124 (adaptado)
1. Numa primeira fase, o calcário é aquecido a altas temperaturas, de modo a obter-se óxido de cálcio, CaO, que, quando tratado com água do mar, forma hidróxido de cálcio, Ca(OH)2.
1.1. O hidróxido de cálcio dissolve-se em água,
(A) ionizando-se completamente.
(B) dissociando-se completamente.
(C) ionizando-se parcialmente.
(D) dissociando-se parcialmente.
*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
- Opção (B)
⇒ O hidróxido de cálcio é um composto iónico formado pelos iões Ca2+ e HO–.
⇒ Mesmo no estado sólido, antes da dissolução em água, já se encontra completamente ionizado. Não é durante a dissolução que se dá a ionização.
⇒ Durante a dissolução do hidróxido de cálcio, ocorre a separação dos iões, ou seja, a dissociação completa e a solvatação desses iões 1neste caso, hidratação).
⇒ A dissociação é completa.
- Opção (B) …………. 5 pontos
- 11ºano – Química – Domínio 2 – subdomínio 1 (Reações ácido-base)
1.2. Preveja, justificando, se o pH da água do mar utilizada no tratamento de uma amostra de óxido de cálcio, CaO(s), aumenta, diminui ou se mantém constante.
⇒ O óxido de cálcio, quando tratado com água do mar, forma hidróxido de cálcio, Ca (OH)2, completamente dissociado, originando iões hidróxido:
- CaO (s) + H2O (l) → Ca2+ (aq) + 2 HO– (aq)
⇒ Aumentando, assim, a concentração de HO– (aq) na solução. Como [HO– (aq)] x [H3O+ (aq)] = Kw, o aumento da [HO– (aq)] conduz, consequentemente, a uma diminuição da concentração de [H3O+ (aq)].
⇒ Como pH = – log [H3O+ (aq)], a diminuição da concentração de [H3O+ (aq)] provoca um aumento de pH.
- Tópicos de referência:
A) A reação do CaO com a água origina Ca(OH)2 que [, dissolvendo-se na água do mar,] dá origem a iões OH– em solução.
B) O aumento da concentração de [iões] OH–(aq) conduz a uma diminuição da concentração de [iões] H3O+(aq) sendo, consequentemente, de prever que o pH da água do mar utilizada aumente ou equivalente.

2. Numa segunda fase, ocorre a precipitação dos iões magnésio, Mg2+(aq), existentes na água do mar, sob a forma de hidróxido de magnésio, Mg(OH)2.
- 11ºano – Química – Domínio 1 – subdomínio 1 (Aspetos quantitativos das reações químicas)
2.1. A precipitação do hidróxido de magnésio (M = 58,33 g mol-1) pode ser traduzida por
Mg2+(aq) + 2 OH–(aq) → Mg(OH)2 (s)
Admita que 1,0 kg de água do mar contém 0,052 moles de iões Mg2+(aq) e que se pretende obter, pelo menos, 1,0 kg de hidróxido de magnésio.
Que massa de água do mar terá, no mínimo, de ser utilizada?
(A) 17 kg
(B) 3,3 × 102 kg
(C) 52 kg
(D) 1,0 × 103 kg
- Opção (B)
- Massa de água do mar = 1,0 kg
- nMg2+ = 0,052 mol/kg
- m Mg(OH)2 = 1,0 kg
⇒ Cálculo da quantidade de hidróxido de magnésio que se pretende obter:
⇒ Cálculo da massa de água do mar que, no mínimo, terá de ser utilizada:
- De acordo com a estequiometria da reação de precipitação do hidróxido de magnésio, 1 : 1, a quantidade de hidróxido de magnésio obtido deve ser igual à quantidade de iões Mg2+ existente em solução.
⇒ Massa de água do mar utilizada 3,3 x 102 kg
- Opção (B) …………. 5 pontos
- 11ºano – Química – Domínio 2 – subdomínio 3 (Soluções e equilíbrio de solubilidade)
2.2. Os produtos de solubilidade do Ca(OH)2 e do Mg(OH)2 são, respetivamente, 6,5 × 10-6 e 7,1 × 10-12, a 25 ºC.
Comparando a solubilidade destes dois hidróxidos, conclui-se que o Mg(OH)2 é cerca de
(A) 106 vezes menos solúvel do que o Ca(OH)2.
(B) 106 vezes mais solúvel do que o Ca(OH)2.
(C) 102 vezes mais solúvel do que o Ca(OH)2.
(D) 102 vezes menos solúvel do que o Ca(OH)2.
- Opção (D)
Produto de solubilidade do hidróxido de cálcio:
- Ca(OH)2 (s) ⇋ Ca2+ (aq) + 2 OH– (aq)
⇒ Kps = [Ca2+] [OH–]2
Produto de solubilidade do hidróxido de magnésio:
- Mg(OH)2 (s) ⇋ Mg2+ (aq) + 2 OH– (aq)
⇒ Kps = [Mg2+] [OH–]2
Comparando a concentração do Ca2+ com a do Mg2+, vem:
- O Ca(OH)2 é 100 vezes mais solúvel,logo o Mg(OH)2 é 100 vezes menos solúvel.
- Opção (D) …………. 5 pontos
3. Numa terceira fase, o hidróxido de magnésio sólido, entretanto separado, reage com ácido clorídrico, formando cloreto de magnésio, MgCl2.
A reação que ocorre é traduzida por
Mg(OH)2(s) + 2 HCl(aq) → MgCl2(aq) + 2 H2O(l)
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
3.1. Considere que se utiliza uma solução de ácido clorídrico, de densidade 1,15 gcm-3, que contém 30%, em massa, de HCl.
Qual das expressões seguintes permite calcular a massa de HCl que existe em 500cm3 da solução?

- Opção (A) …………. 5 pontos
- 11ºano – Química – Domínio 1 – subdomínio 1 (Aspetos quantitativos das reações químicas)
3.2. Admita que se fez reagir 100 moles de Mg(OH)2 com HCl em excesso e que se obteve 50 moles de MgCl2.
A reação pode considerar-se completa, uma vez que
(A) um dos reagentes se esgotou.
(B) o rendimento foi inferior a 100%.
(C) ambos os reagentes se esgotaram.
(D) o rendimento foi igual a 100%.
- Nenhuma das opções.
⇒ Como o reagente HCl está em excesso, não se esgota, logo, a opção (C) é falsa, pois não se esgotam ambos os reagentes. A opção (A) também é falsa, pois se se esgotasse o reagente em defeito, obter-se-iam 100 moles de MgCl2 e não apenas 50 moles.
⇒ Como o HCl está em excesso, ou seja, o Mg (HO)2 é o reagente limitante, de acordo com a estequiometria da reação, 100 moles de Mg (OH)2 deveriam originar 100 moles de MgCl2 se o rendimento fosse 100%; como o rendimento de uma reação, η = (nobtido/nteórico ) x 100, e só se obtiveram 50 moles de MgCl2, pode-se concluir que η = (50/100) x 100 = 50%.
⇒ Assim, a opção (D) é falsa e a opção (B) é incompatível com “a reação poder ser considerada completa”.
ou
- A proporção estequiométrica é de 1 mol de Mg(OH)2 para 1 mol de MgCl2.
Logo, 100 mol Mg(OH)2 originam 100 mol de MgCl2.
Se apenas originaram 50 mol de MgCl, esgotou-se o outro reagente (HCl).
Nota: na realidade, o HCl não podia estar em excesso; estava, sim, em falta.
- Opção (A) …………. 5 pontos
- 11ºano – Química – Domínio 1 – subdomínio 1 (Aspetos quantitativos das reações químicas)
3.3. Considere uma outra situação em que o rendimento da reação é 70%.
Calcule a quantidade, em mole (mol), de hidróxido de magnésio que tem de reagir para ser possível obter, na prática, 2,5 kg de MgCl2 (M = 95,21 g mol-1).
Apresente todas as etapas de resolução.
Mg(OH)2(s) + 2 HCl(aq) → MgCl2(aq) + 2 H2O(l)
⇒ De acordo com a estequiometria da reação, entre Mg(OH)2 e MgCl2 ( 1 : 1), a quantidade de Mg(OH)2 que tem de reagir deve ser igual à quantidade MgCl2 que se obteria se o rendimento da reação fosse 100 %.
⇒ Cálculo da quantidade, em moles, de MgCl2 que se obteria se o rendimento da reação fosse 100% (nteórico) :

- Etapas de resolução:
A) Cálculo da massa de MgCl2 que se obteria se o rendimento da reação fosse 100% (m = 3,57 kg) ou equivalente ……… 5 pontos
B) Cálculo da quantidade de Mg(OH)2 que tem de reagir (n = 37 mol) …….. 5 pontos
- 11ºano – Química – Domínio 2 – subdomínio 2 (Reações de oxidação redução)
4. Numa última fase, depois da evaporação da água, o cloreto de magnésio sólido é fundido numa cuba de aço. O cloreto de magnésio fundido contém iões Mg2+ e Cl–. Faz-se então passar uma corrente elétrica através da cuba para reduzir os iões Mg2+ e oxidar os iões Cl–.
Escreva a equação química que traduz a reação de oxidação-redução relativa à redução dos iões Mg2+ e à oxidação dos iões Cl–, considerando que a oxidação dos iões Cl– origina uma substância diatómica.
Após a fusão: Mg2+ (Cl–)2 (l) → Mg2+ (l) + 2 Cl– (l)
Redução: Mg2+ (l) + 2e– → Mg (l)
Oxidação: 2 Cl– (l) → Cl2 (g) + 2 e–
Equação global: Mg2+ (l) + 2 Cl– (l) → Mg (l) + Cl2 (l)
- Mg2+(l) + 2 Cl–(l) → Mg(l) + Cl2 (g) …….. 5 pontos
Notas: – A omissão ou a indicação incorreta do(s) estado(s) físico(s) de uma ou mais espécies não implica qualquer desvalorização. – A apresentação de ⇋ (em vez de →) não implica qualquer desvalorização.
GRUPO II
Numa atividade laboratorial, um grupo de alunos preparou, com rigor, 100,00 cm3 de uma solução aquosa de sulfato de cobre (II), CuSO4, de concentração 0,400 mol dm-3, por dissolução de sulfato de cobre (II) penta-hidratado, CuSO4 • 5H2O, sólido.
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
1. Calcule a massa de sulfato de cobre penta-hidratado que foi necessário medir, para preparar essa solução.
Apresente todas as etapas de resolução.
- V (CuSO4 (aq)) = 100,00 cm3
- c (CuSO4 (aq)) = 0,400 mol dm-3
- m (CuSO4.5 H2O (s)) = ?
- M (CuSO4.5 H2O (s)) = 249,52 g mol-1
⇒ Cálculo da quantidade 1 mol de sulfato de cobre II existente em 100,00 cm3 de solução:
- c = n/V ⇔ n = c x V = 0,100 dm3 x 0,400 mol dm-3 = 4,00 x 10-2 mol
⇒ A quantidade (mol) de sulfato de cobre (II) existente em 100,00 cm3 de solução é igual à quantidade (mol) de sulfato de cobre (II) penta-hidratado necessário para preparar a solução.
⇒ Cálculo da massa de sulfato de cobre (II) penta-hidratado, CuSO4.5 H2O (s), necessária:
- n = m/M ⇔ m = n x M = 4,00 x 10-2 mol x 249,52 g mol-1 = 9,99 g
- Etapas de resolução:
A) Cálculo da quantidade de sulfato de cobre penta-hidratado necessária (n = 4,000 × 10-2 mol) …….. 5 pontos
B) Cálculo da massa de sulfato de cobre penta-hidratado necessária (m = 9,99 g) …….. 5 pontos
Nota – A apresentação de valores calculados com arredondamentos incorretos, ou com um número incorreto de algarismos significativos, não implica, por si só, qualquer desvalorização.
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
- 10ºano – Química – A.l. – 2.2 – Soluções a partir de solutos sólidos
- 11ºano – A.l. – Medições
2. De modo a pesar o sulfato de cobre penta-hidratado necessário para preparar a solução, os alunos colocaram um gobelet sobre o prato de uma balança.
Identifique a peça de material de laboratório que deve ser utilizada para transferir o sulfato de cobre penta-hidratado sólido para o goble.
- Espátula ou colher.
- Espátula …………………. 5 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
- 10ºano – Química – A.l. – 2.2 – Soluções a partir de solutos sólidos
- 11ºano – A.l. – Medições
3. Ao prepararem a solução, os alunos deixaram o menisco do líquido ultrapassar o traço de referência do balão volumétrico.
Qual é a atitude correta a tomar numa situação como essa?
(A) Ignorar o facto, uma vez que o colo do balão é estreito.
(B) Adicionar um pouco mais de soluto à solução preparada.
(C) Acertar o menisco pelo traço de referência, retirando líquido.
(D) Preparar uma nova solução, a partir do soluto sólido.
- Opção (D)
⇒ Independentemente da largura do colo do balão, iria conduzir a erro na concentração desejada, pois o volume era superior e era desconhecido.
⇒ Adicionar soluto conduziria a uma alteração da concentração da solução.
⇒ Retirar soluçãoacertaria o volume, mas perder-se-ia soluto existente na parte retirada.
⇒ Não há hipótese de remediar o mal; deve preparar-se nova solução.
- Opção (D) …………. 5 pontos
- 10ºano – Química – Domínio 2 – subdomínio 2 (Gases e dispersões)
- 10ºano – Química – A.l. – 2.3 – Diluição de soluções
4. Os alunos prepararam ainda, com rigor, a partir da solução de sulfato de cobre (II) inicialmente preparada, uma solução 2,5 vezes mais diluída.
Os alunos dispunham apenas do seguinte material:
• Balão volumétrico de 50 mL (± 0,06 mL)
• Pompete
• Pipeta graduada de 10 mL (± 0,05 mL)
• Pipeta volumétrica de 10 mL (± 0,02 mL)
• Pipeta graduada de 20 mL (± 0,10 mL)
• Pipeta volumétrica de 20 mL (± 0,03 mL)
• Pipeta graduada de 25 mL (± 0,10 mL)
• Pipeta volumétrica de 25 mL (± 0,03 mL)
Determine o volume da solução mais concentrada que os alunos tiveram de medir, de modo a prepararem a solução pretendida.
Selecione, de entre as pipetas referidas, a que permite a medição mais rigorosa do volume da solução mais concentrada.
Apresente todas as etapas de resolução.
- Fator de diluição: f = 2,5
- cinicial (CuSO4 (aq)) = 0,400 mol dm-3
⇒ Para obter uma solução 2,5 vezes mais diluída, ou seja, com fator de diluição igual a 2,5, o volume (V mL) de solução deve ser diluído a 2,5 V mL.
⇒ Normalmente, pipeta-se um dado volume de solução concentrada para um balão volumétrico, acrescentando água até ao traço de referência.
⇒ Das pipetas disponíveis deveríamos utilizar uma pipeta volumétrica (maior precisão).
⇒ Como dispomos de um balão volumétrico de 50 mL ± 0,06 mL), o volume da solução diluída a preparar vai ser de 50,00 mL.
⇒ O volume da solução concentrada será 2,5 vezes menor, ou seja: f = Vdiluído/Vconcentrado, o volume de solução concentrada é:
- Vconcentrado = Vdiluído/f = 50,00 mL/2,5 = 20,00 cm3.
⇒ Usaríamos a pipeta volumétrica de 20 mL (± 0,03 mL) para transferir a solução concentrada para o balão volumétrico, completando o volume a 50 mL ± 0,06 mL com água destilada.
- Etapas de resolução:
A) Cálculo do volume da solução mais concentrada que foi necessário medir (V = 20,00 cm3) …….. 5 pontos
B) Indicação da pipeta que permite a medição mais rigorosa do volume da solução mais concentrada (pipeta volumétrica de 20 mL) …….. 5 pontos
Nota – A apresentação de valores calculados com arredondamentos incorretos, ou com um número incorreto de algarismos significativos, não implica, por si só, qualquer desvalorização.
GRUPO III
O néon é um dos componentes vestigiais da atmosfera terrestre.
- 10ºano – Química – Domínio 1 – subdomínio 1 (Massa e tamanho dos átomos)
1. O néon-22 (22Ne) é um dos isótopos naturais do néon.
Quantos neutrões existem no núcleo de um átomo de néon-22?
(A) 22
(B) 20
(C) 12
(D) 10
- Opção (C)
⇒ No caso do néon-22, o número de massa (A) é 22 e o número atómico (Z) é 10.
⇒ Dado que A = Z + N, em que N é o número de neutrões, vem 22 = Z + 10, que conduz a N = 12 (12 neutrões).
⇒ 22 é o número de massa
⇒ 10 é o número atómico
⇒ 20 é o dobro do número atómico (opção sem sentido).
- Opção (C) …………. 5 pontos
- 10ºano – Química – Domínio 1 – subdomínio 2 (Energia dos eletrões nos átomos)
2. Num átomo de néon, no estado fundamental, os eletrões encontram-se distribuídos por
(A) dois níveis de energia.
(B) três níveis de energia.
(C) quatro níveis de energia.
(D) cinco níveis de energia.
- Opção (A)
⇒ A configuração eletrónica do átomo de Ne no estado fundamental é:
- 10Ne – 1s2 2s2 2p6.
⇒ Os eletrões deste átomo, no estado fundamental, situam-se nos níveis de energia n = 1 e n = 2.
⇒ O átomo não se encontra em estados excitados.
- Opção (A) …………. 5 pontos
3. Considere que, num átomo de néon num estado excitado, um dos eletrões se encontra numa orbital caracterizada pelo conjunto de números quânticos (3, 2, 1).
Esse eletrão encontra-se numa orbital do tipo
(A) s
(B) p
(C) d
(D) f
*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
- Opção (C)
⇒ O conjunto de números quânticos (3, 2, 1) caracteriza uma orbital com os seguintes valores para os números quânticos: n = 3, l = 2 e m = 1, ou seja, uma orbital 3d (l = 2)
⇒ Uma orbital s exigiria l = 0
⇒ Opções (B) e (D) são igualmente falsas porque exigiriam l = 1 e l = 3, respetivamente.
- Opção (C) …………. 5 pontos
- 10ºano – Química – Domínio 1 – subdomínio 3 (Tabela periódica)
4. Qual é o nome do elemento químico cujos átomos formam iões binegativos que apresentam, no estado fundamental, uma configuração eletrónica igual à do átomo de néon?
⇒ Se a configuração eletrónica do ião binegativo (com 2 eletrões a mais) é 1s2 2s2 2p6, o átomo neutro terá a configuração eletrónica 1s2 2s2 2p4, a que corresponde Z = 8.
- Trata-se do elemento oxigénio.
- Oxigénio …….. 5 pontos
GRUPO IV
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
1. A construção de paredes duplas, separadas por um material que promova o isolamento térmico, contribui para melhorar o comportamento térmico dos edifícios.
Um material que promova um bom isolamento térmico terá
(A) baixa capacidade térmica mássica.
(B) elevada capacidade térmica mássica.
(C) baixa condutividade térmica.
(D) elevada condutividade térmica.
- Opção (C)
⇒ Um bom isolamento térmico implica uma baixa taxa temporal de transferência de energia como calor por condução, Q/Δt, que é traduzida pela expressão:

⇒ Da análise desta expressão verifica-se que um material mau condutor de calor, um bom isolante térmico, é aquele que apresenta um baixo valor de k, ou seja, uma baixa condutividade térmica.
- Opção (C) …………. 5 pontos
2. Através das janelas de vidro simples, há transferência de energia entre o exterior e o interior de uma habitação, sob a forma de calor, por condução.
2.1. A sala de uma casa tem uma janela de vidro simples que dá para o exterior da habitação. O vidro dessa janela, de condutividade térmica 0,8Wm-1 K-1, tem 1,5 m de altura, 1,2 m de largura e 5,0 mm de espessura.
Qual das expressões seguintes permite calcular a energia transferida, sob a forma de calor, através do vidro dessa janela, em cada segundo, se a diferença de temperatura entre o exterior da habitação e o interior da sala for 10 ºC?

*O conteúdo deste item já não faz parte dos atuais referenciais programáticos da disciplina.
- Opção (B) …………. 5 pontos
- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
2.2. Explique o facto de a condutividade térmica dos gases ser, geralmente, muito inferior à dos sólidos.
⇒ O processo de transferência de energia, como calor, por condução, dá-se através de interações entre as partículas constituintes do meio material.
⇒ Nos gases estas interações são muito menos frequentes do que nos sólidos, dado que as suas partículas estão, em média, muito mais afastadas umas das outras do que nos sólidos, pelo que, para as mesmas condições, a quantidade de energia transferida como calor por unidade de tempo, Q/Δt, é menor nos gases.
Da expressão

⇒ Verifica-se que a condutividade térmica, k, é diretamente proporcional a Q/Δt, o que, de acordo com o acima analisado, explica o facto da condutividade térmica dos gases ser, em geral, inferior à dos sólidos.
- Tópicos de referência:
A) [De acordo com a expressão
a condutividade térmica de um material será [, para as mesmas condições,] tanto maior quanto maior for a taxa temporal de transferência de energia, sob a forma de calor, por condução [, através desse material].
B) O mecanismo de transferência de energia, sob a forma de calor, por condução, envolve interações entre as partículas do meio (ou equivalente).
C) Nos gases, essas interações são mais difíceis (ou equivalente) uma vez que as partículas se encontram, em média, muito mais afastadas umas das outras do que nos sólidos (ou equivalente). [Assim, a condutividade térmica dos gases é, geralmente, muito inferior à dos sólidos].

- 10ºano – Física – subdomínio 3 (Energia, fenómenos térmicos e radiação)
3. Pretende-se instalar um sistema de coletores solares, com rendimento de 40%, para aquecimento de água, numa habitação que consome, em média, nesse aquecimento, 8,8 kW h por dia.
Determine a área de coletores a ser instalada, admitindo que estes vão ser colocados numa posição em que a energia da radiação incidente na sua superfície é, em média, 3,6 × 109 J, por ano e por m2 de área de coletores.
Apresente todas as etapas de resolução.
- Etapas de resolução:
A) Cálculo da energia da radiação incidente necessária para produzir diariamente 8,8 kW h (E = 22,0 kW h) …….. 5 pontos
B) Cálculo da área de coletores (A = 8,0 m2) (ver nota) …….. 5 pontos
Nota – A utilização de energias relativas a intervalos de tempo diferentes no cálculo da área de coletores implica a pontuação desta etapa com zero pontos.
4. A radiação solar que incide num vidro, seja de uma janela, seja da cobertura dos coletores solares, é parcialmente transmitida através do vidro, parcialmente refletida nas interfaces vidro-ar e parcialmente absorvida pelo vidro.

A Figura 1 representa um feixe de radiação monocromática, muito fino, que se propaga no ar e incide na superfície de um vidro, de índice de refração 1,5 para essa radiação.
- nar (índice de refração do ar) = 1,0
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
4.1. Qual é o ângulo de refração, na situação representada na Figura 1?
(A) 19º
(B) 30º
(C) 35º
(D) 49º
- Opção (A)…………. 5 pontos
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
4.2. A frequência da radiação monocromática referida é 5,0 × 1014 Hz.
Calcule o comprimento de onda dessa radiação quando se propaga no vidro.
Apresente todas as etapas de resolução.
- Etapas de resolução:
A) Cálculo da velocidade de propagação da radiação monocromática no vidro (v = 2,00 × 108 m s-1) …….. 5 pontos
B)Cálculo do comprimento de onda da radiação referida quando se propaga no vidro (λ = 4,0 × 10-7 m) …….. 5 pontos
- 11ºano – Física – Domínio 2 – subdomínio 3 (Ondas eletromagnéticas)
4.3. O ângulo crítico na superfície de separação vidro-ar considerada é 42°.
Ocorre reflexão total nessa superfície quando a radiação, propagando-se inicialmente
(A) no ar, incide segundo um ângulo de incidência superior a 42°.
(B) no ar, incide segundo um ângulo de incidência inferior a 42°.
(C) no vidro, incide segundo um ângulo de incidência superior a 42°.
(D) no vidro, incide segundo um ângulo de incidência inferior a 42°.
- Opção (C)
⇒ Para que se verifique reflexão total é necessário que a radiação se propague inicialmente no meio com índice de refração mais elevado, logo, no vidro, e com um ângulo de incidência superior ao ângulo crítico, 42°.
- Opção (C)…………. 5 pontos
GRUPO V
1. Na Figura 2 (que não está à escala), estão representadas duas bolas, R e S, e um referencial unidimensional de eixo vertical, Oy, com origem no solo. A massa da bola R é superior à massa da bola S.
As bolas são abandonadas simultaneamente, de uma mesma altura, h, em relação ao solo.
Considere desprezável a resistência do ar e admita que cada uma das bolas pode ser representada pelo seu centro de massa (modelo da partícula material).

- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
1.1. Qual é a relação entre o tempo de queda da bola R e o tempo de queda da bola S?
⇒ Dado que a resistência do ar é desprezável, a resultante das forças que atuam sobre cada uma das bolas é igual ao respetivo peso
- Fr = P ⇔ ma = mg ⇔ a = g
aceleração do movimento de ambas é igual à aceleração gravítica.
⇒ De acordo com o referencial apresentado na figura 2 do enunciado e dado que ambas são abandonadas, v0 = 0, a equação que traduz a variação da componente escalar da posição de cada uma das bolas é:
- v = – gt

⇒ Da mesma figura verifica-se que a posição inicial das duas bolas é a mesma, y0 = h, logo, de acordo com a expressão anterior, conclui-se que os respetivos tempos de queda são iguais.
- O tempo de queda da bola R é igual ao tempo de queda da bola S.
- [Os tempos de queda das bolas R e S] são iguais …….. 5 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
1.2. As bolas R e S chegam ao solo com
(A) a mesma velocidade e a mesma energia cinética.
(B) a mesma velocidade e energias cinéticas diferentes.
(C) velocidades diferentes e energias cinéticas diferentes.
(D) velocidades diferentes e a mesma energia cinética.
- Opção (B)
⇒ Como a equação das velocidades de ambas as bolas é v = – g t e como ambas apresentam o mesmo tempo de queda, então atingem o solo com a mesma velocidade.
⇒Uma vez que a energia cinética depende da massa do sistema, Ec = ½ m v2, e a massa da bola R é superior à massa da bola S, conclui-se que ao atingirem o solo a energia cinética de R é superior à de S, ou seja, são diferentes.
- Opção (B)…………. 5 pontos
1.3. Admita que uma das bolas ressalta no solo sem que ocorra dissipação de energia mecânica.
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
- 10ºano – Física – A.l. – 1.2 – Movimento vertical de queda e ressalto de uma bola
1.3.1. O trabalho realizado pelo peso da bola, desde a posição em que foi abandonada até à posição em que atinge a altura máxima após o ressalto, é
(A) zero, porque essas posições estão à mesma altura.
(B) zero, porque o peso é perpendicular ao deslocamento.
(C) positivo, porque o peso tem a direção do deslocamento.
(D) positivo, porque essas posições estão a alturas diferentes.
- Opção (A)
⇒Desde a posição em que a bola é abandonada até à posição em que atinge a altura máxima após o ressalto há conservação de energia mecânica, logo, a energia potencial em ambos os instantes é a mesma, Ep0 = Ep, pois nestas posições a velocidade e a energia cinética são nulas, sendo a altura final igual à altura inicial, h, visto que para cada instante Ep = m g h.
⇒ O trabalho realizado pelo peso, uma força conservativa, que tem a direção do deslocamento, vertical, é:
- WP = – ΔEp ⇔ WP = – m g (h – h0)
⇒ Como h = h0, então WP = 0.
- Opção (A)…………. 5 pontos
- 10ºano – Física – subdomínio 1 (Energia e movimentos)
- 10ºano – Física – A.l. – 1.2 – Movimento vertical de queda e ressalto de uma bola
1.3.2. Desenhe, na sua folha de respostas, o(s) vetor(es) que representa(m) a(s) força(s) que atua(m) na bola, no seu movimento ascendente, após o ressalto no solo.
- 11ºano – Física – Domínio 1 – subdomínio 3 (Forças e movimentos)
1.3.3. Admita que, após ressaltar no solo, a bola inicia a subida com uma velocidade de módulo 4,0 ms-1.
Apresente o gráfico (obtido com a calculadora gráfica) da componente escalar, segundo o eixo Oy, da posição, y, da bola em função do tempo, t, desde o instante em que a bola inicia a subida (t = 0 s) até ao instante em que inverte o sentido do movimento.
Na sua resposta, deve:
• apresentar a equação y(t ), que traduz o movimento da bola após o ressalto no solo;
• reproduzir o gráfico, obtido com a calculadora, relativo ao intervalo de tempo considerado, indicando no gráfico:
– as grandezas representadas e as respetivas unidades;
– as coordenadas dos pontos que correspondem ao instante em que a bola inicia a subida e ao instante em que a bola inverte o sentido do movimento.
- Na resposta:
⇒é apresentada a equação y ( t ), que traduz o movimento da bola após o ressalto no solo ( y = 4,0 t – 5,0 t2 (SI)) (ver notas 1 e 2) …….. 5 pontos
⇒ é reproduzido o gráfico obtido com a calculadora (ver nota 3), com a indicação, no gráfico, das
– grandezas representadas (ver nota 4) …….. 4 pontos
– unidades em que essas grandezas estão expressas ……….. (1 + 1) …….. 2 pontos
– coordenadas do ponto que corresponde ao instante em que a bola inicia a subida …….. 1 pontos
– coordenadas do ponto que corresponde ao instante em que a bola inverte o sentido do movimento …….. 3 pontos

Notas:
1.A não apresentação de uma equação y (t) implica a classificação da resposta com zero pontos.
2.A apresentação de uma equação y (t) incorreta implica a pontuação desta etapa com zero pontos. As etapas seguintes serão pontuadas de acordo com os critérios de classificação desde que o gráfico reproduzido seja coerente com a equação apresentada.
3. A apresentação de um gráfico que não corresponda ao intervalo de tempo considerado implica a pontuação das etapas relativas à reprodução do gráfico com zero pontos.
4.A ausência de indicação ou a indicação incorreta, no gráfico, das grandezas representadas implica a pontuação desta etapa com zero pontos.
- 11ºano – Física – Domínio 1 – subdomínio 2 (Interações e os seus efeitos)
2. Na Figura 3 (que não está à escala), está representada uma calha inclinada, que termina num troço horizontal. A superfície do troço horizontal está revestida por um material rugoso.
Um paralelepípedo de massa 300 g foi abandonado na posição A, situada a uma altura de 25 cm em relação ao troço horizontal da calha.
Entre as posições A e B, a dissipação de energia mecânica foi desprezável. Entre as posições B e C, que distam 60 cm entre si, foi dissipada 20% da energia mecânica inicial do sistema paralelepípedo + Terra.
Considere que o paralelepípedo pode ser representado pelo seu centro de massa (modelo da partícula material) e considere o troço horizontal da calha como o nível de referência da energia potencial gravítica.
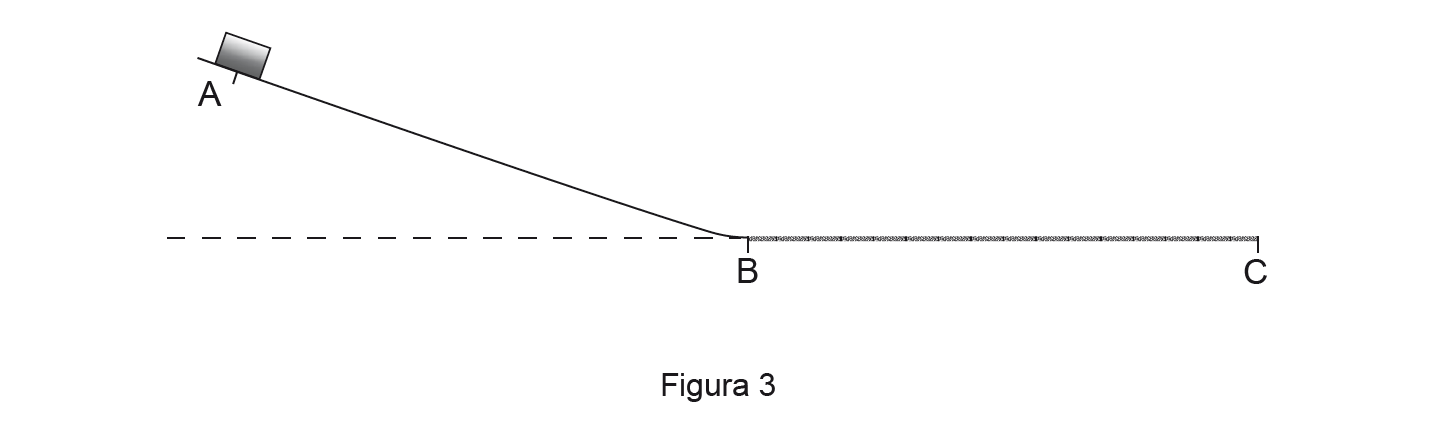
Determine o módulo da aceleração do paralelepípedo, no percurso BC, admitindo que a aceleração se mantém constante ao longo desse percurso.
Apresente todas as etapas de resolução.
- Etapas de resolução:
A)Cálculo da energia mecânica (ou da energia potencial gravítica) inicial do sistema paralelepípedo + Terra (E = 0,750 J) ……..2 pontos
B)Cálculo da variação da energia mecânica do sistema (ou da variação da energia cinética do paralelepípedo), entre as posições B e C (ΔE = -0,150 J) …….. 3 pontos
C)Cálculo da intensidade da resultante das forças que atuaram no paralelepípedo, no percurso BC (F = 0,250 N) …….. 5 pontos
D)Cálculo do módulo da aceleração do paralelepípedo, no percurso BC (a = 0,83 m s-2) …….. 5 pontos
FIM














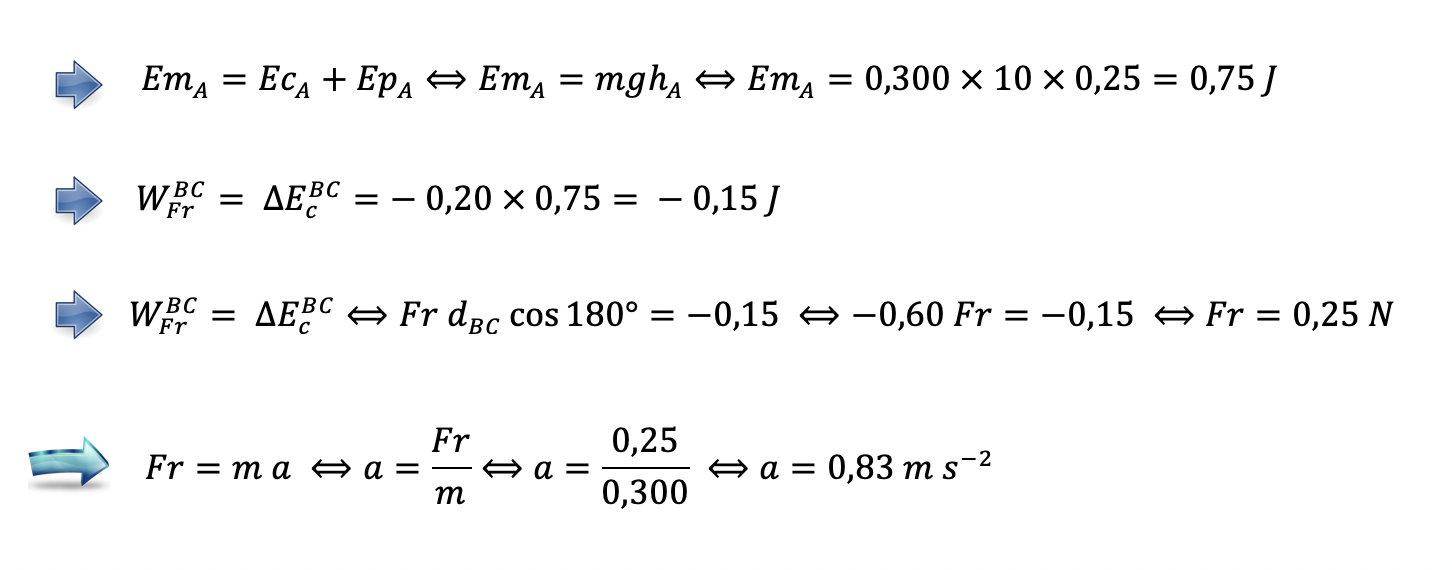

este tipo de conteúdo é extremamente útil bom trabalho. obrigada
Muito obrigado, Beatriz.